Los complejos alílicos de metales de transición son complejos de coordinación con alilo y sus derivados como ligandos . El alilo es el radical con la conectividad CH 2 CHCH 2 , aunque como ligando suele considerarse como un anión alilo CH 2 =CH−CH 2 − , que suele describirse como dos estructuras de resonancia equivalentes.
El ligando alilo se encuentra comúnmente en la química organometálica . Lo más común es que los ligandos alilo se unan a los metales a través de los tres átomos de carbono, el modo de unión η 3 . El grupo η 3 -alilo se clasifica como un ligando de tipo LX en el esquema de clasificación de ligandos LXZ de Green , que actúa como un donante 3e utilizando el conteo de electrones neutros y un donante 4e utilizando el conteo de electrones iónicos. Los complejos con alilo y otros ligandos son más comunes. Algunos ejemplos incluyen (η 3 -alilo)Mn(CO) 4 y CpPd(alilo) .

Los 1,3- dienos como el butadieno y el isopreno se dimerizan en las esferas de coordinación de algunos metales, dando lugar a complejos quelantes de bis(alilo). Estos complejos también surgen de la apertura del anillo del divinilciclobutano. Los complejos quelantes de bis(alilo) son intermediarios en la dimerización catalizada por metales del butadieno para dar lugar a vinilciclohexeno y cicloocta-1,5-dieno . [3]
También se conocen complejos con ligandos η 1 -alílicos (clasificados como ligandos de tipo X). Un ejemplo es CpFe(CO) 2 (η 1 -C 3 H 5 ), en el que solo el grupo metileno está unido al centro Fe (es decir, tiene la conectividad [Fe]–CH 2 –CH=CH 2 ). Como es el caso de muchos otros complejos η 1 -alílicos, la monohapticidad del ligando alílico en esta especie se ve reforzada por la regla de los 18 electrones , ya que CpFe(CO) 2 (η 1 -C 3 H 5 ) ya es un complejo de 18 electrones, mientras que un ligando η 3 -alílico daría como resultado un recuento de electrones de 20 y violaría la regla de los 18 electrones . Estos complejos pueden convertirse en derivados η 3 -alílicos mediante la disociación de un ligando neutro (de dos electrones) L. Para CpFe(CO) 2 (η 1 -C 3 H 5 ), la disociación de L = CO ocurre en condiciones fotoquímicas: [4]
Los complejos alílicos se generan a menudo mediante la adición oxidativa de haluros alílicos a complejos metálicos de baja valencia. Esta ruta se utiliza para preparar (alil) 2 Ni 2 Cl 2 : [5] [6]
Una adición oxidativa similar implica la reacción del bromuro de alilo con el nonacarbonilo de dihierro . [7] La ruta de adición oxidativa también se ha utilizado para los complejos de alilo de Mo(II): [8]
Otros métodos de síntesis implican la adición de nucleófilos a complejos de η 4 -dieno y la abstracción de hidruros de complejos de alquenos. [2] Por ejemplo, el cloruro de paladio (II) ataca a los alquenos para dar primero un complejo de alqueno, pero luego abstrae hidrógeno para dar un complejo de alqueno de diclorohidridopaladio, y luego elimina el cloruro de hidrógeno : [9]
Un complejo alílico puede transferir un ligando alílico a otro complejo. [10] Un complejo metálico aniónico puede desplazar un haluro para formar un complejo alílico. Sin embargo, si el centro metálico está coordinado con otros 6 o más ligandos, el alilo puede terminar "atrapado" como un ligando σ (η 1 -). En tales circunstancias, el calentamiento o la irradiación pueden dislocar otro ligando para liberar espacio para el enlace alqueno-metal. [11]
En principio, las reacciones de metátesis de sales pueden unir un ligando alílico a partir de un bromuro de alilmagnesio o un reactivo de alil litio relacionado. [2] Sin embargo, los precursores de sales de carbanión requieren una síntesis cuidadosa, ya que los haluros de alilo experimentan fácilmente el acoplamiento de Wurtz . Los haluros de alilo de mercurio y estaño parecen evitar esta reacción secundaria. [12]

Los ligandos de bencilo y alilo suelen presentar propiedades químicas similares. Los ligandos de bencilo suelen adoptar modos de enlace η 1 o η 3. Las reacciones de interconversión son paralelas a las de los ligandos de alilo η 1 o η 3 :
En todos los modos de enlace, el átomo de carbono bencílico está unido más fuertemente al metal, como lo indican las distancias de enlace MC, que difieren en aproximadamente 0,2 Å en complejos con enlaces η 3 . [14] La cristalografía de rayos X demuestra que los ligandos bencílicos en tetrabencilcirconio son altamente flexibles. Un polimorfo presenta cuatro ligandos bencílicos η 2 , mientras que otro polimorfo tiene dos ligandos bencílicos η 1 y dos η 2 . [13]
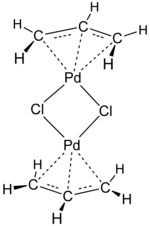
En términos de aplicaciones, un complejo de alilo popular es el cloruro de alilpaladio . [15]
La reactividad de los ligandos alílicos depende del complejo global, aunque la influencia del centro metálico se puede resumir aproximadamente como [16]
Estos complejos suelen ser electrofílicos (es decir, reaccionan con nucleófilos), pero los complejos de níquel- alilo suelen ser nucleofílicos (resp. con electrófilos). [17] En el primer caso, la adición puede ocurrir en lugares inusuales y puede ser útil en la síntesis orgánica . [18]