
La síntesis total de colesterol en química describe la síntesis total de la biomolécula compleja colesterol y se considera un gran logro científico. [1] El grupo de investigación de Robert Robinson con John Cornforth ( Universidad de Oxford ) publicó su síntesis en 1951 [2] y la de Robert Burns Woodward con Franz Sondheimer ( Universidad de Harvard ) en 1952. [3] Ambos grupos compitieron por la primera publicación desde 1950, con Robinson habiendo comenzado en 1932 y Woodward en 1949. Según el historiador Greg Mulheirn, el esfuerzo de Robinson se vio obstaculizado por su estilo de liderazgo de microgestión y el esfuerzo de Woodward se vio facilitado en gran medida por sus buenas relaciones con la industria química. Alrededor de 1949, los esteroides como la cortisona se producían a partir de recursos naturales pero eran caros. Las empresas químicas Merck & Co. y Monsanto vieron oportunidades comerciales para la síntesis de esteroides y no solo financiaron a Woodward sino que también le proporcionaron grandes cantidades de ciertos intermediarios químicos de plantas piloto. El trabajo duro también ayudó al esfuerzo de Woodward: uno de los compuestos intermedios se denominó Christmasterone, ya que fue sintetizado el día de Navidad de 1950 por Sondheimer.
También se han desarrollado otros esquemas de colesterol: el colesterol racémico fue sintetizado en 1966 por WS Johnson, [4] el enantiómero del colesterol natural fue informado en 1996 por Rychnovsky y Mickus, [5] en 2002 por Jiang & Covey [6] y nuevamente en 2008 por Rychnovsky y Belani. [7]
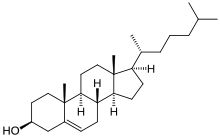
El colesterol es un alcohol tetracíclico y un tipo de esterol . A la estructura del esterol con el grupo alcohol en la posición 3 se le añaden 2 grupos metilo en las posiciones de carbono 10 y 13 y un grupo 2-isooctilo en la posición 17. La molécula está insaturada en la posición 5,6 con un grupo alqueno . El número total de estereocentros es 8. La molécula de colesterol no natural que también se ha sintetizado se llama ent-colesterol . 
La síntesis de Robinson es un ejemplo de la denominada síntesis de relevo. Como muchos de los intermediarios químicos (todos esteroides) ya eran conocidos y estaban disponibles a partir de recursos naturales, todo lo que se necesitaba para una síntesis formal era una prueba de que estos intermediarios podían unirse entre sí mediante síntesis química. El punto de partida para la síntesis de Robinson fue el 1,6-dihidroxinaftaleno 1 que se convirtió en unos 20 pasos en la entonces ya conocida androsterona 4 . Ruzicka ya había demostrado en 1938 que la androsterona podía convertirse en androstenediona 5 [8] y Robinson demostró su conversión a dehidroepiandrosterona 6 (nótese el grupo hidroxilo epimerizado ), también un compuesto ya conocido. [9] La conversión de 6 a pregnenolona 7 y luego a alopregnanolona 8 permitió la adición del grupo de cola como acetato en 9 y luego la conversión a colestanol 10 .

La conversión de colestanol en colesterol ya fue demostrada por oxidación de la cetona, bromación a bromocetona y eliminación a enona .

La conversión de colestenona en colesterol por el método de Dauben y Eastham (1950) [10] consistió en la reducción del acetato de enol ( hidruro de litio y aluminio ) y el fraccionamiento con digitonina para el aislamiento del isómero correcto.
El punto de partida para la síntesis de Woodward fue la hidroquinona 1 que se convirtió en cis-biciclo 2 en una reacción de Diels-Alder con butadieno . La conversión al isómero trans deseado 5 se logró mediante la síntesis de la sal de enolato de sodio 4 ( benceno , hidruro de sodio ) seguida de acidificación. La reducción ( hidruro de litio y aluminio ) dio luego el diol 6 , una deshidratación ( HCl /agua) dio el cetol 7 , la desoxigenación de su acetato por zinc elemental dio enona 8 , la formilación ( formiato de etilo ) dio enol 9 , la adición de etilvinilcetona de Michael ( t-butóxido de potasio / t-butanol ) dio la diona 11 que, al reaccionar con KOH en dioxano, dio el triciclo 12 en una condensación aldólica con eliminación del grupo formilo. En la siguiente serie de pasos, la oxidación ( tetróxido de osmio ) dio el diol 13 , la protección ( acetona / sulfato de cobre ) dio el acetónido 14, la hidrogenación (carbonato de paladio-estroncio) dio el 15 , la formilación ( formiato de etilo ) dio el enol 16 que, protegido como enamina 17 ( N -metilanilina / metanol ), dio a través del anión potasio 18 , ácido carboxílico 19 por reacción con cianoetileno usando tritón B como base.
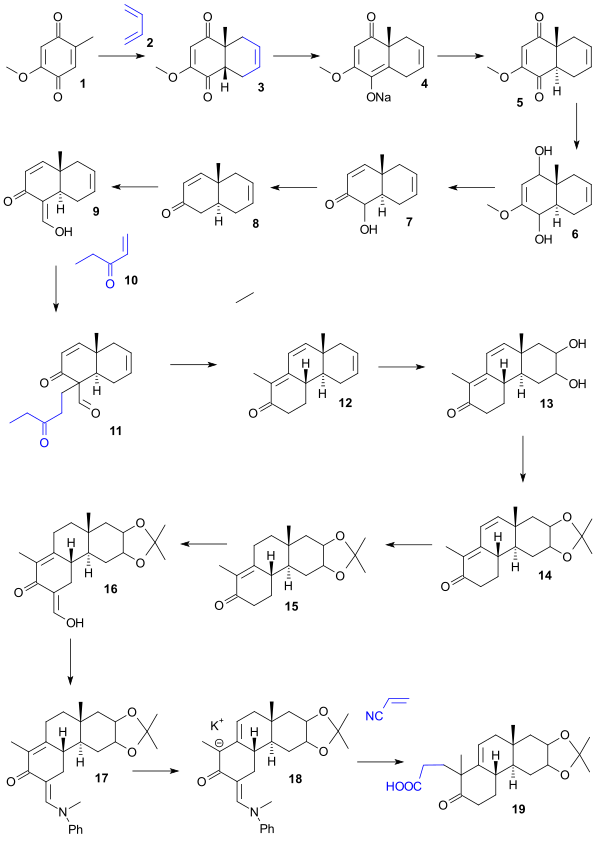
El ácido 19 se convirtió en lactona 20 ( anhídrido acético , acetato de sodio ) y la reacción con cloruro de metilmagnesio dio la cetona tetracíclica 21. El tratamiento con ácido peryódico (dioxano) y acetato de piperidina (benceno) dio el aldehído 24 a través del diol 22 (oxidación) y el dialdehído 23 (condensación aldólica). La oxidación con dicromato de sodio dio el ácido carboxílico 25 , el tratamiento con diazometano dio el éster metílico 26 y el borohidruro de sodio el alcohol alílico 27. La resolución quiral de este compuesto racémico con digitonina produjo el quiral 28 y en la oxidación de Oppenauer el quiral 29 . La hidrogenación ( catalizador de Adams ) dio el alcohol 30 , la oxidación con ácido crómico dio la cetona 31 , la reducción estereoselectiva con borohidruro de sodio dio el alcohol 32 , la hidrólisis seguida de acilación dio el acetato 33 , el tratamiento con cloruro de tionilo dio el cloruro de acilo 34 y el metilcadmio la cetona 35 .

En las etapas finales de la reacción de 35 con bromuro de isohexilmagnesio 36 se obtuvo el diol 37 , el tratamiento con ácido acético dio lugar a la deshidratación y luego la hidrogenación dio lugar al acetato 38. La hidrólisis de este éster dio lugar al colestanol 39. La ruta del colestanol al colesterol ya se conocía (véase: Síntesis de Robinson).
