La clorometilación de Blanc (también llamada reacción de Blanc ) es la reacción química de anillos aromáticos con formaldehído y cloruro de hidrógeno para formar clorometilarenos. La reacción está catalizada por ácidos de Lewis como el cloruro de cinc . [1] La reacción fue descubierta por Gustave Louis Blanc (1872-1927) en 1923. [2] [3]
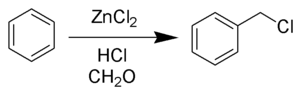
La reacción se lleva a cabo en condiciones ácidas y con un catalizador de ZnCl2 . Estas condiciones protonan el carbonilo del formaldehído, lo que hace que el carbono sea mucho más electrofílico. A continuación, el aldehído es atacado por los electrones aromáticos pi , seguido de la rearomatización del anillo aromático. El alcohol bencílico así formado se convierte rápidamente en cloruro en las condiciones de reacción.

Otras posibilidades para el electrófilo incluyen el catión (clorometil)oxonio (ClH 2 C–OH 2 + ) o el catión clorocarbenio (ClCH 2 + ), que se pueden formar en presencia de cloruro de zinc. [4] Estas especies pueden explicar el hecho de que los sustratos moderadamente y fuertemente desactivados que son inertes a las reacciones de Friedel-Crafts como acetofenona, nitrobenceno y p -cloronitrobenceno [5] muestran una reactividad marginal de utilidad sintética limitada en condiciones de clorometilación. [6] Los sustratos desactivados dan mejores resultados en condiciones de clorometilación modificadas utilizando metil éter de clorometilo (MOMCl) en presencia de 60% de H 2 SO 4 . [4]
Los arenos altamente activados, como los fenoles y las anilinas, no son sustratos adecuados, ya que sufren un ataque electrofílico adicional mediante la alquilación de Friedel-Crafts con el alcohol/cloruro bencílico formado de manera descontrolada. En general, la formación de un producto secundario, el diarilmetano, es un resultado común. [6]
Aunque la reacción es un medio eficiente para introducir un grupo clorometilo, la producción de pequeñas cantidades de bis(clorometil)éter altamente cancerígeno es una desventaja para las aplicaciones industriales.
Las reacciones correspondientes de fluorometilación, bromometilación y yodometilación también se pueden lograr, utilizando el ácido hidrohálico apropiado. [7]
La clorometilación de tioles se puede efectuar con HCl concentrado y formaldehído: [8]
La clorometilación también se puede efectuar utilizando metil éter clorometilado:
Esta reacción se emplea en la clorometilación del estireno en la producción de resinas de intercambio iónico y resinas Merrifield . [9]
La reacción se realiza con cuidado ya que, como la mayoría de las reacciones de clorometilación, produce bis(clorometil)éter altamente cancerígeno como subproducto.
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace )