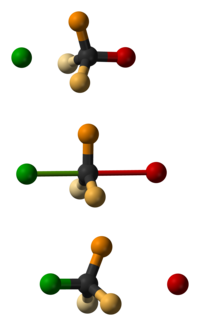
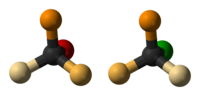
La inversión de Walden es la inversión de un centro estereogénico en una molécula quiral en una reacción química . Dado que una molécula puede formar dos enantiómeros alrededor de un centro estereogénico, la inversión de Walden convierte la configuración de la molécula de una forma enantiomérica a la otra. Por ejemplo, en una reacción S N 2 , la inversión de Walden ocurre en un átomo de carbono tetraédrico. Se puede visualizar imaginando un paraguas al revés en un vendaval . En la inversión de Walden, el ataque posterior del nucleófilo en una reacción S N 2 da lugar a un producto cuya configuración es opuesta a la del reactivo. Por lo tanto, durante la reacción S N 2 , tiene lugar el 100% de inversión del producto. Esto se conoce como inversión de Walden.
Fue observado por primera vez por el químico Paul Walden en 1896. Pudo convertir un enantiómero de un compuesto químico en otro enantiómero y viceversa en el llamado ciclo de Walden , que era así: (+) ácido clorosuccínico ( 1 en el ilustración) se convirtió en ácido (+) málico 2 por acción de óxido de plata en agua con retención de configuración. En el siguiente paso, el grupo hidroxilo se reemplazó por cloro al otro isómero del ácido clorosuccínico 3 mediante reacción con pentacloruro de fósforo . Una reacción con óxido de plata produjo ácido (-)málico 4 y finalmente una reacción con PCl 5 devolvió el ciclo a su punto inicial. [1]
En esta reacción, el óxido de plata del primer paso actúa como donante de hidróxido, mientras que el ión de plata no desempeña ningún papel en la reacción. Los intermedios son el dianión carboxilo A , que proporciona una sustitución nucleofílica intramolecular por el anión β-carboxilato para producir un anillo B de β- lactona de cuatro miembros . El grupo α-carboxilo también es reactivo, pero los datos in silico sugieren que el estado de transición para la formación de la α-lactona de tres miembros es muy alto. Un anillo de ion hidroxido abre la lactona para formar el alcohol C y el efecto neto de dos recuentos de inversión es la retención de la configuración. [2]