En ciencia nuclear , la cadena de desintegración se refiere a una serie de desintegraciones radiactivas de diferentes productos de desintegración radiactiva como una serie secuencial de transformaciones. También se la conoce como "cascada radiactiva". El radioisótopo típico no desintegra directamente a un estado estable, sino que desintegra a otro radioisótopo. Así, suele haber una serie de desintegraciones hasta que el átomo se ha convertido en un isótopo estable , es decir, que el núcleo del átomo ha alcanzado un estado estable.
Se hace referencia a las etapas de decadencia por su relación con las etapas anteriores o posteriores. Un isótopo padre es aquel que sufre desintegración para formar un isótopo hijo . Un ejemplo de esto es el uranio ( número atómico 92) que se descompone en torio (número atómico 90). El isótopo hijo puede ser estable o puede descomponerse para formar un isótopo hijo propio. La hija de un isótopo hijo a veces se denomina isótopo nieta . Tenga en cuenta que el isótopo padre se convierte en el isótopo hijo, a diferencia del caso de un padre biológico y una hija.
El tiempo que tarda un átomo de un solo padre en desintegrarse en un átomo de su isótopo hijo puede variar ampliamente, no sólo entre diferentes pares padre-hijo, sino también aleatoriamente entre pares idénticos de isótopos padre e hijo. La desintegración de cada átomo ocurre espontáneamente, y la desintegración de una población inicial de átomos idénticos a lo largo del tiempo t sigue una distribución exponencial decreciente , e −λt , donde λ se denomina constante de desintegración . Una de las propiedades de un isótopo es su vida media , el tiempo en el que se puede esperar estadísticamente que la mitad de un número inicial de radioisótopos originales idénticos se haya desintegrado en sus hijos, que está inversamente relacionado con λ. Las vidas medias se han determinado en laboratorios para muchos radioisótopos (o radionúclidos). Estos pueden variar desde casi instantáneos (menos de 10 −21 segundos) hasta más de 10 19 años.
Cada una de las etapas intermedias emite la misma cantidad de radiactividad que el radioisótopo original (es decir, existe una relación uno a uno entre el número de desintegraciones en etapas sucesivas), pero cada etapa libera una cantidad diferente de energía. Cuando se logra el equilibrio, cada isótopo hijo sucesivo está presente en proporción directa a su vida media; pero como su actividad es inversamente proporcional a su vida media, cada nucleido en la cadena de desintegración contribuye con tantas transformaciones individuales como el jefe de la cadena, aunque no con la misma energía. Por ejemplo, el uranio-238 es débilmente radiactivo, pero la pechblenda , un mineral de uranio, es 13 veces más radiactiva que el uranio metálico puro debido a la presencia de productos de desintegración de vida más corta, como el radio y el gas noble radón . Las rocas que contienen torio y/o uranio (como algunos tipos de granito) emiten gas radón, que tiende a acumularse en lugares cerrados como sótanos o minas subterráneas debido a su alta densidad. [1]

La cantidad de isótopos en las cadenas de desintegración en un momento determinado se calcula con la ecuación de Bateman .
Con las excepciones del hidrógeno-1, el hidrógeno-2 (deuterio), el helio-3, el helio-4 y quizás trazas de isótopos estables de litio y berilio que se crearon en el Big Bang , todos los elementos e isótopos encontrados en la Tierra fueron creado por el proceso s o el proceso r en estrellas o colisiones estelares , y para que sean hoy parte de la Tierra, deben haber sido creados a más tardar hace 4.500 millones de años . Todos los elementos creados hace 4.500 millones de años o antes se denominan primordiales , lo que significa que fueron generados por los procesos estelares del universo. En el momento en que fueron creados, los que eran inestables comenzaron a decaer inmediatamente. Todos los isótopos que tienen vidas medias inferiores a 100 millones de años se han reducido a2,8 × 10 −14 o menos de cualquier cantidad original creada y capturada por la acreción de la Tierra; hoy son ínfimos o han desaparecido por completo. Sólo existen otros dos métodos para crear isótopos: artificialmente , dentro de un reactor hecho por el hombre (o tal vez natural ), o mediante la desintegración de una especie isotópica original, el proceso conocido como cadena de desintegración .
Los isótopos inestables se desintegran en sus productos hijos (que a veces pueden ser incluso más inestables) a un ritmo determinado; finalmente, a menudo después de una serie de desintegraciones, se alcanza un isótopo estable: hay 251 isótopos estables en el universo. En los isótopos estables, los elementos ligeros suelen tener una proporción más baja de neutrones y protones en su núcleo que los elementos más pesados. Los elementos ligeros como el helio-4 tienen una relación neutrón:protón cercana a 1:1. Los elementos más pesados, como el plomo, tienen cerca de 1,5 neutrones por protón (por ejemplo, 1,536 en el plomo-208 ). Ningún nucleido más pesado que el plomo-208 es estable; Estos elementos más pesados tienen que perder masa para lograr estabilidad, principalmente mediante desintegración alfa . La otra forma común de desintegración de los isótopos con una alta proporción de neutrones a protones (n/p) es la desintegración beta , en la que el nucleido cambia de identidad elemental mientras mantiene el mismo número de masa y reduce su proporción n/p. Para algunos isótopos con una relación n/p relativamente baja, existe una desintegración beta inversa , mediante la cual un protón se transforma en un neutrón, avanzando así hacia un isótopo estable; sin embargo, dado que la fisión casi siempre produce productos pesados en neutrones, la emisión de positrones o la captura de electrones son raras en comparación con la emisión de electrones. Hay muchas cadenas de desintegración beta relativamente cortas, al menos dos (una pesada de desintegración beta y una ligera de desintegración de positrones ) por cada peso discreto hasta alrededor de 207 y algunas más allá, pero para los elementos de mayor masa (isótopos más pesados que el plomo) hay Sólo hay cuatro vías que abarcan todas las cadenas de descomposición. [ cita necesaria ] Esto se debe a que solo hay dos métodos de desintegración principales: radiación alfa , que reduce la masa en 4 unidades de masa atómica (uma), y beta, que no cambia el número de masa (solo el número atómico y el p/ relación n). Los cuatro caminos se denominan 4n, 4n + 1, 4n + 2 y 4n + 3; el resto de dividir la masa atómica por cuatro da la cadena que utilizará el isótopo para desintegrarse. Hay otros modos de desintegración, pero invariablemente ocurren con una probabilidad menor que la desintegración alfa o beta. (No se debe suponer que estas cadenas no tienen ramas: el siguiente diagrama muestra algunas ramas de cadenas, pero en realidad hay muchas más, porque hay muchos más isótopos posibles de los que se muestran en el diagrama). El tercer átomo de nihonio-278 sintetizado experimentó seis desintegraciones alfa hasta mendelevio-254 , [2] seguidas de una captura de electrones (una forma de desintegración beta) hasta fermio-254 , [2] y luego una séptima alfa hasta californio-250 . [2]sobre lo cual habría seguido la cadena 4n + 2 como se indica en este artículo. Sin embargo, los nucleidos superpesados más pesados sintetizados no alcanzan las cuatro cadenas de desintegración, porque alcanzan un nucleido que se fisiona espontáneamente después de algunas desintegraciones alfa y que termina la cadena: esto es lo que sucedió con los dos primeros átomos de nihonio-278 sintetizados, [3] [4] así como a todos los nucleidos más pesados producidos.
Tres de esas cadenas tienen un isótopo (o nucleido) de larga vida cerca de la parte superior; este nucleido de larga vida es un cuello de botella en el proceso a través del cual la cadena fluye muy lentamente y mantiene la cadena debajo de ellos "viva" con el flujo. Los tres nucleidos de vida media larga son el uranio-238 (vida media de 4.500 millones de años), el uranio-235 (vida media de 700 millones de años) y el torio-232 (vida media de 14.000 millones de años). La cuarta cadena no tiene un nucleido de cuello de botella tan duradero cerca de la parte superior, por lo que casi todos los nucleidos de esa cadena hace tiempo que se desintegraron hasta justo antes del final: bismuto-209. Durante mucho tiempo se pensó que este nucleido era estable, pero en 2003 se descubrió que era inestable, con una vida media muy larga de 20,1 mil millones de años; [5] es el último paso de la cadena antes del talio-205 estable. Debido a que este cuello de botella tiene una vida tan larga, se han producido cantidades muy pequeñas del producto final de desintegración y, para la mayoría de los fines prácticos, el bismuto-209 es el producto final de desintegración.
En el pasado lejano, durante los primeros millones de años de la historia del Sistema Solar, existían más tipos de nucleidos inestables de gran masa, y las cuatro cadenas eran más largas, ya que incluían nucleidos que desde entonces se han desintegrado. En particular, 244 Pu, 237 Np y 247 Cm tienen vidas medias de más de un millón de años y entonces habrían sido cuellos de botella menores en las cadenas 4n, 4n+1 y 4n+3 respectivamente. [6] (No existe ningún nucleido con una vida media superior a un millón de años por encima de 238 U en la cadena 4n+2.) Hoy en día, algunos de estos isótopos anteriormente extintos vuelven a existir tal como fueron fabricados. Así vuelven a ocupar su lugar en la cadena: el plutonio-239, utilizado en armas nucleares, es el ejemplo más importante, que se descompone en uranio-235 mediante emisión alfa con una vida media de 24.500 años. También se ha producido a gran escala neptunio-237, que ha resucitado la hasta ahora extinta cuarta cadena. [7] Por lo tanto, las tablas siguientes inician las cuatro cadenas de desintegración en isótopos de californio con números de masa de 249 a 252.
Estas cuatro cadenas se resumen en el cuadro de la siguiente sección.

Los cuatro modos más comunes de desintegración radiactiva son: desintegración alfa, desintegración beta, desintegración beta inversa (considerada tanto como emisión de positrones como captura de electrones) y transición isomérica . De estos procesos de desintegración, sólo la desintegración alfa (fisión de un núcleo de helio-4 ) cambia el número de masa atómica ( A ) del núcleo y siempre lo disminuye en cuatro. Debido a esto, casi cualquier desintegración dará como resultado un núcleo cuyo número de masa atómica tiene el mismo residuo mod 4. Esto divide la lista de nucleidos en cuatro clases. Todos los miembros de cualquier posible cadena de desintegración deben provenir en su totalidad de una de estas clases.
En la naturaleza se observan tres cadenas (o familias) principales de descomposición. Estos se denominan comúnmente serie del torio, serie del radio o uranio y serie del actinio , y representan tres de estas cuatro clases y terminan en tres isótopos de plomo diferentes y estables . El número másico de cada isótopo en estas cadenas se puede representar como A = 4 n , A = 4 n + 2 y A = 4 n + 3, respectivamente. Los isótopos iniciales de larga duración de estos tres isótopos, respectivamente torio-232 , uranio-238 y uranio-235 , han existido desde la formación de la Tierra, ignorando los isótopos artificiales y sus desintegraciones creados desde la década de 1940.
Debido a la vida media relativamente corta de su isótopo inicial neptunio-237 (2,14 millones de años), la cuarta cadena, la serie del neptunio con A = 4 n + 1, ya está extinta en la naturaleza, excepto el paso final que limita la velocidad. , desintegración del bismuto-209 . Sin embargo, en la naturaleza se encuentran trazas de 237 Np y sus productos de desintegración como resultado de la captura de neutrones en el mineral de uranio. [8] Ahora se sabe que el isótopo final de esta cadena es el talio-205 . Algunas fuentes más antiguas dan como isótopo final el bismuto-209, pero en 2003 se descubrió que es muy ligeramente radiactivo, con una vida media de2,01 × 10 19 años . [9]
También existen cadenas de desintegración no transuránicas de isótopos inestables de elementos ligeros, por ejemplo las de magnesio-28 y cloro-39 . En la Tierra, la mayoría de los isótopos iniciales de estas cadenas antes de 1945 fueron generados por radiación cósmica . Desde 1945, las pruebas y el uso de armas nucleares también han liberado numerosos productos de fisión radiactivos . Casi todos estos isótopos se desintegran mediante modos de desintegración β − o β + , cambiando de un elemento a otro sin cambiar la masa atómica. Estos productos hijos posteriores, al estar más cerca de la estabilidad, generalmente tienen vidas medias más largas hasta que finalmente decaen hasta alcanzar la estabilidad.
En las cuatro tablas siguientes, se omiten las ramas menores de descomposición (con una probabilidad de ramificación inferior al 0,0001%). La liberación de energía incluye la energía cinética total de todas las partículas emitidas ( electrones , partículas alfa , cuantos gamma , neutrinos , electrones Auger y rayos X ) y el núcleo en retroceso, suponiendo que el núcleo original estaba en reposo. La letra 'a' representa un año (del latín annus ).
En las tablas siguientes (excepto el neptunio), también se dan los nombres históricos de los nucleidos naturales. Estos nombres se utilizaron en la época en que se descubrieron e investigaron por primera vez las cadenas de desintegración. A partir de estos nombres históricos se puede localizar la cadena concreta a la que pertenece el nucleido y sustituirla por su nombre moderno.
Las tres cadenas de desintegración alfa de actínidos naturales que se indican a continuación: torio, uranio/radio (de uranio-238) y actinio (de uranio-235), cada una termina con su propio isótopo de plomo específico (plomo-208, plomo-206, y plomo-207 respectivamente). Todos estos isótopos son estables y también están presentes en la naturaleza como nucleidos primordiales , pero su exceso en comparación con el plomo-204 (que sólo tiene un origen primordial) puede utilizarse en la técnica de datación de rocas con uranio-plomo .
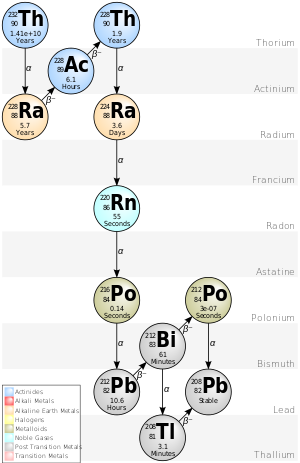
La cadena 4n del torio-232 se denomina comúnmente "serie de torio" o "cascada de torio". Comenzando con el torio-232 natural, esta serie incluye los siguientes elementos: actinio , bismuto , plomo, polonio , radio, radón y talio . Todos están presentes, al menos transitoriamente, en cualquier muestra natural que contenga torio, ya sea metálica, compuesta o mineral. La serie termina con el plomo-208.
El plutonio-244 (que aparece varios pasos por encima del torio-232 en esta cadena si se lo extiende a los transuránicos) estuvo presente en el Sistema Solar temprano, [6] y tiene una vida lo suficientemente larga como para que aún sobreviva en cantidades mínimas en la actualidad. , [15] aunque no se sabe si se ha detectado. [dieciséis]
La energía total liberada del torio-232 al plomo-208, incluida la energía perdida por los neutrinos, es de 42,6 MeV.
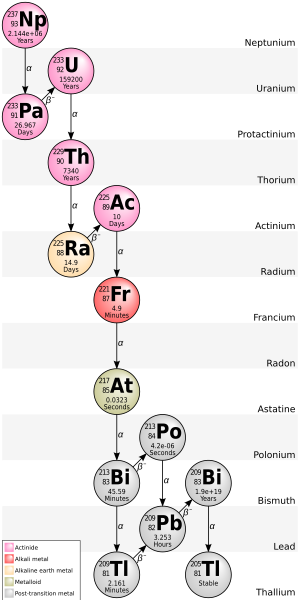
La cadena 4n+1 del neptunio-237 se denomina comúnmente "serie de neptunio" o "cascada de neptunio". En esta serie, sólo dos de los isótopos implicados se encuentran de forma natural en cantidades significativas, concretamente los dos últimos: bismuto-209 y talio-205. Algunos de los otros isótopos se han detectado en la naturaleza y se originan a partir de trazas de 237 Np producidas por la reacción de eliminación (n,2n) en el 238 U primordial . [8] Un detector de humo que contiene una cámara de ionización de americio-241 acumula una cantidad significativa de neptunio -237 a medida que su americio se desintegra. Los siguientes elementos también están presentes, al menos temporalmente, como productos de desintegración del neptunio: actinio, astato , bismuto, francio , plomo, polonio, protactinio , radio, radón, talio, torio y uranio . Dado que esta serie no fue descubierta y estudiada hasta 1947-1948, [19] sus nucleidos no tienen nombres históricos. Un rasgo único de esta cadena de desintegración es que el gas noble radón sólo se produce en una rara rama (que no se muestra en la ilustración), pero no en la secuencia de desintegración principal; por lo tanto, el radón de esta cadena de desintegración no migra a través de la roca tanto como el de las otras tres. Otro rasgo único de esta secuencia de desintegración es que termina en talio en lugar de plomo. Esta serie termina con el isótopo estable talio-205.
La energía total liberada del californio-249 al talio-205, incluida la energía perdida por los neutrinos , es de 66,8 MeV.
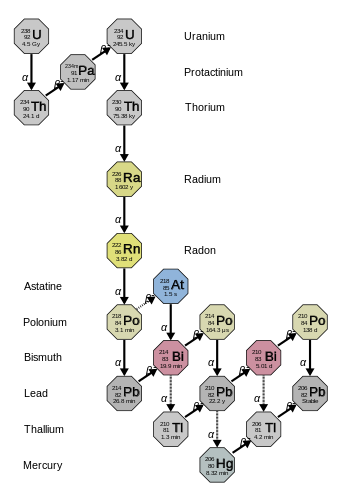
La cadena 4n+2 del uranio-238 se denomina "serie del uranio" o "serie del radio". Comenzando con el uranio-238 natural, esta serie incluye los siguientes elementos: astato, bismuto, plomo , mercurio, polonio, protactinio , radio , radón , talio y torio. Todos están presentes, al menos transitoriamente, en cualquier muestra que contenga uranio natural, ya sea metal, compuesto o mineral. La serie termina con el plomo-206.
La energía total liberada del uranio-238 al plomo-206, incluida la energía perdida por los neutrinos, es de 51,7 MeV.
La cadena 4n+3 del uranio-235 se denomina comúnmente "serie de actinio" o "cascada de actinio". Comenzando con el isótopo natural uranio-235, esta serie de desintegración incluye los siguientes elementos: actinio, astato , bismuto , francio , plomo , polonio , protactinio , radio, radón, talio y torio . Todos están presentes, al menos transitoriamente, en cualquier muestra que contenga uranio-235, ya sea metal, compuesto, mena o mineral. Esta serie termina con el isótopo estable plomo-207 .
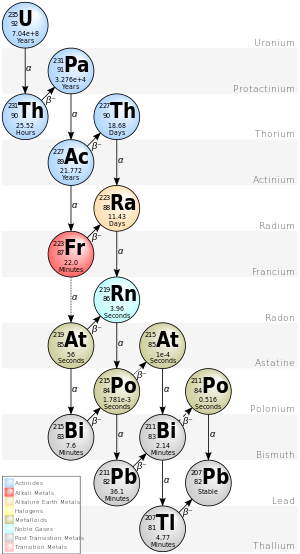
En el Sistema Solar temprano esta cadena se remontaba a 247 cm. Esto se manifiesta hoy en día como variaciones en las proporciones 235 U/ 238 U, ya que el curio y el uranio tienen químicas notablemente diferentes y se habrían separado de manera diferente. [6] [22]
La energía total liberada del uranio-235 al plomo-207, incluida la energía perdida por los neutrinos, es de 46,4 MeV.