Botrydial es un metabolito secundario secretado por el hongo Botrytis cinerea que es fitotóxico . Químicamente es un sesquiterpeno . Botrydial fue aislado y descrito por primera vez en 1974. [1] B. cinerea es el agente causal de la enfermedad del moho gris y se sabe que ataca a una amplia gama de plantas (más de 200 especies) produciendo enfermedades de manchas foliares y mildiú en lechugas y tomates, así como bayas podridas. [2] Por esta razón, el botrydial, así como otros metabolitos sesquiterpénicos originados en B. cinerea , representan una enfermedad económicamente importante para cultivos ornamentales y agrícolas importantes. [3] De todos los metabolitos producidos por este hongo, Botrydial exhibe la mayor actividad fitotóxica. [4]
Botrydial se origina a partir de la ciclización mediada por BcBOT2 ( biosíntesis de B otrytis c inerea ) del farnesil difosfato (FPP) al alcohol tricíclico intermediario clave presilphiperfolan-8β-ol. Pinedo et al. demostraron que BcBOT2 es de hecho una sesquiterpeno sintasa mediante la incubación de FPP con proteína BcBOT2 recombinante, que produjo el presilphiperfolan-8-ol esperado como producto principal.
Otros cuatro genes intervienen en la biosíntesis de botrydial: tres genes que codifican una monooxigenasa P450 (BcBOT3, BcBOT1, BcBOT4) y un gen BcBOT5 cuya secuencia de aminoácidos mostró una alta homología con las acetiltransferasas conocidas.

Esto llevó a Pinedo et al. a la conclusión de que BcBOT5 es probablemente responsable de la introducción del grupo acetilo en C-4. También concluyeron a partir del análisis de PCR de transcripción inversa cuantitativa (qRT-PCR) que los cinco genes consecutivos están co-regulados por la misma vía de transducción BCG1-calcineurim. [5]
Recientemente, en un artículo de ASAP en The Journal of the American Chemistry Society, Cane et al. confirmaron experimentalmente, mediante marcaje con deuterio y espectroscopia de RMN, el mecanismo por el cual el FPP se cicla en presilfiperfolan-8β-ol. El mecanismo consiste en la eliminación del grupo difosfato seguida de ciclizaciones y reordenamientos mediados por carbocationes. [6]
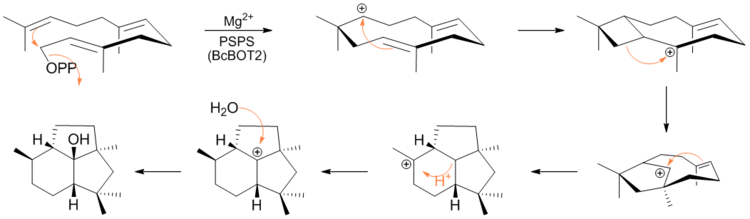
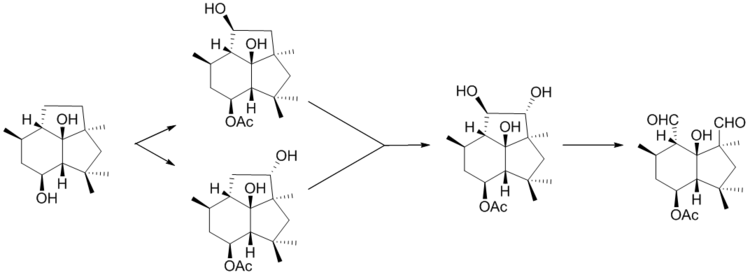
Después de la formación de presilphiperfolan-8β-ol, BcBOT5 da paso a la acetilación de la posición C-4, luego ocurre la hidroxilación del esqueleto de probotryane en un proceso de dos pasos seguido por la escisión oxidativa del nuevo diol formado para producir botrydial. [7]
Botrytis cinerea produce botrydial cuando la planta huésped está infectada. Como resultado, el botrydial induce clorosis y colapso celular. [8] Además, las cepas agresivas del hongo secretan policétidos como el ácido boctínico que exhiben actividad fitotóxica y antifúngica. [5]