El cruce entre sistemas ( ISC ) es un proceso isoenergético sin radiación que implica una transición entre dos estados electrónicos con diferente multiplicidad de espín . [1]

Cuando un electrón en una molécula con un estado fundamental singlete se excita ( mediante la absorción de radiación) a un nivel de energía más alto, se formará un estado singlete excitado o un estado triplete excitado. El estado singlete es un estado electrónico molecular tal que todos los espines de los electrones están emparejados. Es decir, el espín del electrón excitado todavía está emparejado con el electrón del estado fundamental (un par de electrones en el mismo nivel de energía debe tener espines opuestos, según el principio de exclusión de Pauli ). En un estado triplete, el electrón excitado ya no está emparejado con el electrón del estado fundamental; es decir, son paralelos (mismo espín). Dado que la excitación a un estado triplete implica una transición de espín "prohibida" adicional, es menos probable que se forme un estado triplete cuando la molécula absorbe radiación.
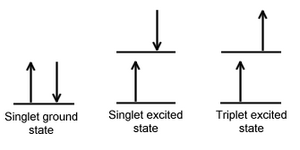
Cuando un estado singlete pasa de manera no radiactiva a un estado triplete, o por el contrario, un triplete pasa a ser singlete, ese proceso se conoce como cruce intersistemas. En esencia, el espín del electrón excitado se invierte. La probabilidad de que ocurra este proceso es más favorable cuando los niveles vibracionales de los dos estados excitados se superponen, ya que se debe ganar o perder poca o ninguna energía en la transición. Como las interacciones espín/orbital en dichas moléculas son sustanciales y un cambio en el espín es, por lo tanto, más favorable, el cruce intersistemas es más común en moléculas de átomos pesados (por ejemplo, las que contienen yodo o bromo ). Este proceso se llama " acoplamiento espín-órbita ". En pocas palabras, implica el acoplamiento del espín del electrón con el momento angular orbital de órbitas no circulares. Además, la presencia de especies paramagnéticas en solución mejora el cruce intersistemas. [2]
La desintegración radiativa desde un estado triplete excitado a un estado singlete se conoce como fosforescencia . Dado que se produce una transición en la multiplicidad de espín, la fosforescencia es una manifestación del cruce entre sistemas. La escala de tiempo del cruce entre sistemas es del orden de 10 −8 a 10 −3 s, una de las formas más lentas de relajación. [3]
Una vez que un complejo metálico experimenta una transferencia de carga de metal a ligando , el sistema puede experimentar un cruce entre sistemas, lo que, junto con la capacidad de ajuste de las energías de excitación de MLCT, produce un intermedio de larga duración cuya energía se puede ajustar alterando los ligandos utilizados en el complejo. Otra especie puede reaccionar entonces con el estado excitado de larga duración mediante oxidación o reducción, iniciando así una vía redox mediante fotoexcitación ajustable . Los complejos que contienen centros metálicos de alto número atómico d 6 , como Ru(II) e Ir(III), se utilizan comúnmente para tales aplicaciones debido a que favorecen el cruce entre sistemas como resultado de su acoplamiento espín-órbita más intenso. [4]
Los complejos que tienen acceso a orbitales d pueden acceder a multiplicidades de espín además de los estados singlete y triplete, ya que algunos complejos tienen orbitales de energías similares o degeneradas, de modo que es energéticamente favorable para los electrones estar desapareados. Es posible entonces que un solo complejo experimente múltiples cruces intersistemas, que es el caso en el atrapamiento de estado de espín excitado inducido por luz (LIESST), donde, a bajas temperaturas, un complejo de espín bajo puede ser irradiado y experimentar dos instancias de cruce intersistema. Para los complejos de Fe(II), el primer cruce intersistema ocurre desde el estado singlete al triplete, al que luego le sigue el cruce intersistema entre el triplete y el estado quinteto. A bajas temperaturas, el estado de espín bajo es el favorecido, pero el estado quinteto es incapaz de relajarse de nuevo al estado fundamental de espín bajo debido a sus diferencias en la energía del punto cero y la longitud del enlace metal-ligando. El proceso inverso también es posible para casos como [Fe( ptz ) 6 ](BF 4 ) 2 , pero el estado singlete no se regenera completamente, ya que la energía necesaria para excitar el estado fundamental del quinteto al estado excitado necesario para experimentar un cruce entre sistemas hasta el estado triplete se superpone con múltiples bandas correspondientes a excitaciones del estado singlete que conducen de nuevo al estado quinteto. [5]
La microscopía de fluorescencia se basa en compuestos fluorescentes, o fluoróforos , para obtener imágenes de sistemas biológicos. Dado que la fluorescencia y la fosforescencia son métodos competitivos de relajación, un fluoróforo que experimenta un cruce entre sistemas al estado excitado triplete ya no fluoresce y, en cambio, permanece en el estado excitado triplete, que tiene una vida útil relativamente larga, antes de fosforescer y relajarse de nuevo al estado fundamental singlete para que pueda seguir experimentando excitación y fluorescencia repetidas. Este proceso en el que los fluoróforos no fluorescen temporalmente se llama parpadeo . Mientras está en el estado excitado triplete, el fluoróforo puede sufrir fotoblanqueo , un proceso en el que el fluoróforo reacciona con otra especie en el sistema, lo que puede provocar la pérdida de la característica fluorescente del fluoróforo. [6]
Para regular estos procesos que dependen del estado triplete, la tasa de cruce intersistemas se puede ajustar para favorecer o desfavorecer la formación del estado triplete. Los biomarcadores fluorescentes, incluidos los puntos cuánticos y las proteínas fluorescentes , a menudo se optimizan para maximizar el rendimiento cuántico y la intensidad de la señal fluorescente, lo que en parte se logra disminuyendo la tasa de cruce intersistemas. Los métodos para ajustar la tasa de cruce intersistemas incluyen la adición de Mn 2+ al sistema, lo que aumenta la tasa de cruce intersistemas para los colorantes rodamina y cianina. [7] El cambio del metal que forma parte de los grupos fotosensibilizadores unidos a los puntos cuánticos de CdTe también puede afectar la tasa de cruce intersistemas, ya que el uso de un metal más pesado puede hacer que el cruce intersistemas se favorezca debido al efecto del átomo pesado. [8]
Se ha investigado la viabilidad de los polímeros organometálicos en células solares orgánicas de heterojunción en masa debido a su capacidad de donante. La eficiencia de la separación de carga en la interfaz donante-aceptor se puede mejorar mediante el uso de metales pesados, ya que su mayor acoplamiento espín-órbita promueve la formación del estado excitado triplete MLCT, lo que podría mejorar la longitud de difusión del excitón y reducir la probabilidad de recombinación debido a la vida útil prolongada del estado excitado de espín prohibido. Al mejorar la eficiencia del paso de separación de carga del mecanismo de célula solar de heterojunción en masa, también mejora la eficiencia de conversión de energía. Se ha demostrado que la eficiencia mejorada de la separación de carga es el resultado de la formación del estado excitado triplete en algunos polímeros de platino-acetiluro conjugados . Sin embargo, a medida que aumenta el tamaño del sistema conjugado, la conjugación aumentada reduce el impacto del efecto del átomo pesado y, en cambio, hace que el polímero sea más eficiente debido a que la conjugación aumentada reduce la banda prohibida . [9]
En 1933, Aleksander Jabłoński publicó su conclusión de que la prolongada vida útil de la fosforescencia se debía a un estado excitado metaestable a una energía inferior al estado alcanzado inicialmente tras la excitación. Basándose en esta investigación, Gilbert Lewis y sus colaboradores, durante su investigación de la luminiscencia de moléculas orgánicas en la década de 1940, concluyeron que este estado de energía metaestable correspondía a la configuración electrónica triplete. Lewis confirmó el estado triplete mediante la aplicación de un campo magnético al fósforo excitado, ya que solo el estado metaestable tendría una vida útil lo suficientemente larga como para ser analizado y el fósforo solo habría respondido si fuera paramagnético debido a que tiene al menos un electrón desapareado. Su vía propuesta de fosforescencia incluía la transición de espín prohibido que se produce cuando se cruzan las curvas de energía potencial del estado excitado singlete y el estado excitado triplete, de donde surgió el término cruce entre sistemas. [10]