Los antígenos menores de histocompatibilidad (también conocidos como MiHA ) son péptidos que se presentan en la superficie celular de los órganos donados y que se sabe que dan una respuesta inmunológica en algunos trasplantes de órganos. [1] Causan problemas de rechazo con menos frecuencia que los del complejo mayor de histocompatibilidad (CMH). Los antígenos menores de histocompatibilidad (MiHA) son segmentos cortos y diversos de proteínas y se denominan péptidos. Estos péptidos normalmente tienen alrededor de 9-12 aminoácidos de longitud y están unidos a las proteínas de clase I y clase II del complejo mayor de histocompatibilidad (CMH) . [2] Las secuencias de péptidos pueden diferir entre individuos y estas diferencias surgen de SNP en la región codificante de genes, deleciones de genes , mutaciones de cambio de marco o inserciones . [3] Aproximadamente un tercio de los MiHA caracterizados provienen del cromosoma Y. [4] Antes de convertirse en una secuencia de péptidos corta, las proteínas expresadas por estos genes polimórficos o diversos necesitan ser digeridas en el proteasoma en péptidos más cortos. Estos péptidos endógenos o propios son luego transportados al retículo endoplásmico con una bomba transportadora de péptidos llamada TAP , donde se encuentran y se unen a la molécula MHC de clase I. Esto contrasta con los antígenos de las moléculas MHC de clase II , que son péptidos derivados de la fagocitosis/endocitosis y la degradación molecular de proteínas de entidades no propias, generalmente por células presentadoras de antígenos. Los antígenos MiHA se expresan de forma ubicua en la mayoría de los tejidos, como la piel y los intestinos, o se expresan de forma restrictiva en las células inmunitarias. [5]
Los antígenos de histocompatibilidad menor se deben a proteínas normales que son polimórficas en sí mismas en una población determinada. Incluso cuando un donante y un receptor de trasplante son idénticos con respecto a sus genes del complejo mayor de histocompatibilidad , las diferencias de aminoácidos en las proteínas menores pueden hacer que el tejido injertado sea rechazado lentamente. Varios de los MiHA identificados codificados por cromosomas Y y autosómicos [4]
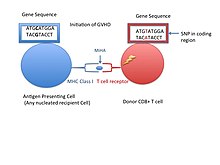
La siguiente tabla enumera los MiHA conocidos, las variantes de genes que codifican los péptidos MiHA y sus alelos HLA restringidos.
Las MiHAs unidas a un MHC presentado en una superficie celular pueden ser reconocidas como un péptido propio o no reconocidas por las células T CD8 + o CD4 +. La falta de reconocimiento de una célula T a este antígeno propio es la razón por la que el trasplante alogénico de células madre para un gen compatible con HLA o las MiHAs de un feto en desarrollo durante el embarazo pueden no ser reconocidas por las células T y marcadas como extrañas, lo que lleva a una respuesta inmunitaria. Aunque los receptores de células B también pueden reconocer MHC, las respuestas inmunitarias parecen ser provocadas solo por las células T. [6] Las consecuencias de una respuesta inmunitaria se ven en el trasplante alogénico de células madre hematopoyéticas (HCT) cuando los péptidos codificados por genes polimórficos difieren entre las células T del receptor y del donante. Como resultado, las células T del donante pueden dirigirse a las células del receptor denominadas enfermedad de injerto contra huésped ( GVHD ). [5] Aunque el rechazo del injerto o de la médula ósea puede tener efectos perjudiciales, existen beneficios de la inmunoterapia cuando los linfocitos T citotóxicos son específicos para un antígeno propio y pueden dirigirse a antígenos expresados selectivamente en células leucémicas para destruir estas células tumorales, lo que se conoce como efecto injerto contra leucemia (GVL). [3]
El reconocimiento de un linfocito T maduro por este antígeno propio no debería inducir una respuesta inmunitaria. Durante la selección tímica que se produce en el timo, solo un TCR de timocito que reconoce una molécula de MHC de clase I o de clase II más un péptido debería sobrevivir a la selección positiva . Sin embargo, se produce la muerte por apoptosis de los timocitos que no interactúan con las moléculas de MHC o que tienen receptores de alta afinidad para el MHC propio más el antígeno propio, un proceso conocido como selección negativa . Por lo tanto, el proceso de selección positiva y negativa significa que menos células T maduras autorreactivas abandonarán el timo y provocarán problemas autoinmunes.
La importancia de las MiHA en la respuesta inmunitaria se reconoció después del trasplante. La receptora desarrolló EICH a pesar de tener genes compatibles con HLA en el locus de histocompatibilidad mayor. El experimento planteó dudas sobre la posibilidad de que existieran MiHA. Más específicamente, la primera MiHA se descubrió cuando se realizó un trasplante de médula ósea entre sexos opuestos. La receptora femenina obtuvo células de médula ósea compatibles con MHC pero aún tenía células T citotóxicas activas (CD8+). [3] Las células T CD8+ estaban activas y se dirigían a las células de la médula ósea masculina. Se descubrió que las células de la médula ósea masculina presentaban un péptido en el surco MHC codificado por un gen en el cromosoma Y. El péptido era extraño para las células T femeninas y las mujeres carecen del cromosoma Y y, por lo tanto, de este MiHA. Los MiHA codificados por el cromosoma Y se conocen como antígenos HY. [3]
Los antígenos HY están codificados por genes en el cromosoma Y. Se ha descubierto que los alelos HLA de clase I y II presentan estos antígenos. Algunos de estos antígenos se expresan de forma ubicua en células masculinas nucleadas, y la presencia de estos antígenos se ha asociado con un mayor riesgo de desarrollar GVHD trasplante alogénico de células madre para un gen compatible con HLA cuando hay un receptor masculino y una donante femenina. [7] Los MiHA HY juegan un papel en el embarazo con un feto masculino porque las células fetales pueden cruzar desde la placenta al torrente sanguíneo materno, donde las células T maternas responden al antígeno extraño presentado tanto en MHC de clase I como II. Por lo tanto, las células T CD8+ específicas de HY se desarrollan en la sangre materna y pueden dirigirse a las células fetales con núcleo que expresan el antígeno en una molécula MHC de clase I. La respuesta a estos antígenos HY fetales está relacionada con las mujeres que experimentan abortos espontáneos recurrentes secundarios que anteriormente estaban embarazadas de un feto masculino. [3] Las mujeres con un embarazo masculino anterior tienen células T que estuvieron expuestas previamente a estos antígenos HY y, en consecuencia, los reconocen más rápido. Se ha descubierto que las mujeres con abortos recurrentes también contienen MHC II con capacidad de presentar estos antígenos a las células T colaboradoras (CD4+), lo que es importante para la activación de CD8+. [8]
La HA1 es el resultado de un SNP que convierte el alelo no inmunogénico (KECVL R DDLLEA) en un alelo inmunogénico (KECVL H DDLLEA). Este SNP produce una mejor capacidad de unión del péptido al surco de una molécula particular del MHC de clase I que se encuentra en las células presentadoras de antígenos. [5] La importancia del cambio del péptido a una forma inmunogénica es que ahora las células T restringidas por HLA-A 0201 específicas pueden reconocer el péptido presentado por las moléculas del MHC de clase I HLA-A0201. Este reconocimiento conduce a una respuesta inmunitaria si las células T reconocen el péptido como extraño. Este reconocimiento ocurre cuando un individuo carece de la versión inmunogénica del péptido, pero está expuesto al péptido HA-1 durante el embarazo o un trasplante alogénico de células madre. Durante el embarazo, se ha descubierto que la HA-1 fetal se origina en la placenta y se han identificado células T CD8+ maternas específicas que reconocen esta MiHA. [5]
Las células T CD8+ específicas para un MiHA pueden dirigirse a estos antígenos cuando se expresan específicamente en células tumorales, lo que permite la destrucción de células tumorales dañinas. En ratones, se ha demostrado que las células T CD8+ de donantes de trasplantes de células madre alogénicos específicos para un MiHA encontrado en el receptor inhiben la división de células leucémicas . Sin embargo, existe un riesgo de desarrollar EICH si las células T son específicas para MiHAs expresados ubicuamente en células epiteliales . Más específicamente, las MiHA HA-8, UGT2B17 y SMCY que se expresan ubicuamente presentan un mayor riesgo de desarrollar EICH. Por lo tanto, para prevenir los efectos adversos de la EICH, las MiHA restringidas a células inmunes son objetivos ideales para el injerto contra leucemia (GVL) ya que no todas las células nucleadas son el objetivo de las células T que responden. Un ejemplo de un objetivo ideal es el MiHA HB-1, que se expresa en gran medida en células B dañinas, pero tiene una baja expresión en otras células tisulares. [9]
La inmunización de las madres contra antígenos de histocompatibilidad menor (HY) específicos de los varones tiene un papel patogénico en muchos casos de aborto espontáneo recurrente secundario , es decir, aborto espontáneo recurrente en embarazos posteriores a un nacimiento vivo anterior. Un ejemplo de este efecto es que la proporción de varones:mujeres de los niños nacidos antes y después de un aborto espontáneo recurrente secundario es de 1,49 y 0,76 respectivamente. [10]