
Los anfibios son animales vertebrados ectotérmicos , anamnióticos y de cuatro extremidades que constituyen la clase Amphibia . En su sentido más amplio, es un grupo parafilético que abarca todos los tetrápodos excluyendo a los amniotas (tetrápodos con membrana amniótica , como los reptiles , aves y mamíferos modernos ). Todos los anfibios existentes (vivos) pertenecen a la subclase monofilética Lissamphibia , con tres órdenes vivos : Anura ( ranas y sapos ), Urodela ( salamandras ) y Gymnophiona ( cecilias ). Los anfibios, que evolucionaron para ser principalmente semiacuáticos , se han adaptado para habitar una amplia variedad de hábitats , y la mayoría de las especies viven en ecosistemas de agua dulce , humedales o terrestres (como bosques ribereños , hábitats fosoriales e incluso arbóreos ). Su ciclo de vida generalmente comienza como larvas acuáticas con branquias conocidas como renacuajos , pero algunas especies han desarrollado adaptaciones de comportamiento para evitar esto.
Los anfibios jóvenes generalmente experimentan una metamorfosis desde una forma larvaria acuática con branquias a una forma adulta que respira aire con pulmones . Los anfibios usan su piel como una interfaz respiratoria secundaria y algunas salamandras y ranas terrestres pequeñas carecen de pulmones y dependen completamente de su piel. Son superficialmente similares a reptiles como los lagartos , pero a diferencia de los reptiles y otros amniotas , requieren acceso a cuerpos de agua para reproducirse. Con sus complejas necesidades reproductivas y pieles permeables, los anfibios a menudo son indicadores ecológicos de las condiciones del hábitat; en las últimas décadas ha habido una disminución dramática en las poblaciones de anfibios para muchas especies en todo el mundo.
Los primeros anfibios evolucionaron en el período Devónico a partir de sarcopterigios tetrapodomorfos ( peces de aletas lobuladas con aletas articuladas similares a extremidades ) que desarrollaron pulmones primitivos, que fueron útiles para adaptarse a la tierra firme. Se diversificaron y se volvieron ecológicamente dominantes durante los períodos Carbonífero y Pérmico , pero luego fueron desplazados en entornos terrestres por los primeros reptiles y sinápsidos basales (predecesores de los mamíferos). El origen de los lisanfibios modernos, que aparecieron por primera vez durante el Triásico Temprano, hace unos 250 millones de años, ha sido polémico durante mucho tiempo. La hipótesis más popular es que probablemente se originaron a partir de los temnospóndilos , el grupo más diverso de anfibios prehistóricos, durante el período Pérmico. [4] Otra hipótesis es que surgieron de los lepospondys. [5] Un cuarto grupo de lisanfibios, los Albanerpetontidae , se extinguieron hace unos 2 millones de años.
El número de especies de anfibios conocidas es de aproximadamente 8.000, de las cuales casi el 90% son ranas. El anfibio (y vertebrado) más pequeño del mundo es una rana de Nueva Guinea ( Paedophryne amauensis ) con una longitud de solo 7,7 mm (0,30 pulgadas). El anfibio vivo más grande es la salamandra gigante del sur de China ( Andrias sligoi ) de 1,8 m (5 pies 11 pulgadas), pero este se ve eclipsado por temnospóndilos prehistóricos como Mastodonsaurus que podría alcanzar hasta 6 m (20 pies) de longitud. [6] El estudio de los anfibios se llama batracología , mientras que el estudio tanto de los reptiles como de los anfibios se llama herpetología .

La palabra anfibio se deriva del término griego antiguo ἀμφίβιος ( amphíbios ), que significa 'ambos tipos de vida', ἀμφί significa 'de ambos tipos' y βίος significa 'vida'. El término se utilizó inicialmente como un adjetivo general para los animales que podían vivir en la tierra o en el agua, incluidas las focas y las nutrias. [7] Tradicionalmente, la clase Amphibia incluye a todos los vertebrados tetrápodos que no son amniotas. Amphibia en su sentido más amplio ( sensu lato ) se dividió en tres subclases , dos de las cuales están extintas: [8]
Estas tres subclases no incluyen a todos los anfibios extintos. Otros grupos de anfibios extintos incluyen a los Embolomeri (grandes depredadores acuáticos del Paleozoico tardío), Seymouriamorpha (formas semiacuáticas a terrestres del Pérmico relacionadas con los amniotas), entre otros. Nombres como Tetrapoda y Stegocephalia abarcan la totalidad de los tetrápodos de grado anfibio, mientras que Reptiliomorpha o Anthracosauria se utilizan de forma variable para describir a los anfibios extintos más estrechamente relacionados con los amniotas que con los lisanfibios.

El número real de especies en cada grupo depende de la clasificación taxonómica seguida. Los dos sistemas más comunes son la clasificación adoptada por el sitio web AmphibiaWeb, de la Universidad de California, Berkeley , y la clasificación del herpetólogo Darrel Frost y el Museo Americano de Historia Natural , disponible como base de datos de referencia en línea "Amphibian Species of the World". [10] El número de especies citado anteriormente sigue a Frost y el número total de especies de anfibios conocidas (vivas) al 31 de marzo de 2019 es exactamente 8000, [11] de las cuales casi el 90% son ranas. [12]
Con la clasificación filogenética , el taxón Labyrinthodontia ha sido descartado por ser un grupo poliparafilético sin rasgos definitorios únicos aparte de características primitivas compartidas . La clasificación varía según la filogenia preferida del autor y si utilizan una clasificación basada en tallos o en nodos . Tradicionalmente, los anfibios como clase se definen como todos los tetrápodos con un estadio larvario, mientras que el grupo que incluye a los ancestros comunes de todos los anfibios vivos (ranas, salamandras y cecilias) y todos sus descendientes se llama Lissamphibia. La filogenia de los anfibios paleozoicos es incierta, y es posible que Lissamphibia se encuentre dentro de grupos extintos, como los Temnospondyli (tradicionalmente ubicados en la subclase Labyrinthodontia) o los Lepospondyli, y en algunos análisis incluso en los amniotas. Esto significa que los defensores de la nomenclatura filogenética han eliminado una gran cantidad de grupos tetrápodos de tipo anfibio del Devónico y Carbonífero basal que anteriormente se ubicaban en Amphibia en la taxonomía de Linneo , y los incluyeron en otro lugar bajo la taxonomía cladística . [2] Si el ancestro común de anfibios y amniotas se incluye en Amphibia, se convierte en un grupo parafilético. [13]
Todos los anfibios modernos están incluidos en la subclase Lissamphibia, que suele considerarse un clado , un grupo de especies que han evolucionado a partir de un ancestro común. Los tres órdenes modernos son Anura (las ranas), Caudata (o Urodela, las salamandras) y Gymnophiona (o Apoda, las cecilias). [14] Se ha sugerido que las salamandras surgieron por separado de un ancestro parecido al temnospóndilo, e incluso que las cecilias son el grupo hermano de los anfibios reptiliomorfos avanzados, y por tanto de los amniotas. [15] Aunque se conocen los fósiles de varias protoranas más antiguas con características primitivas, la "rana verdadera" más antigua, con adaptaciones para saltar, es Prosalirus bitis , de la Formación Kayenta del Jurásico Temprano de Arizona. Es anatómicamente muy similar a las ranas modernas. [16] Las cecilias más antiguas conocidas son Funcusvermis gilmorei (del Triásico tardío) y Eocaecilia micropodia (del Jurásico temprano), ambas de Arizona. [17] La salamandra más antigua es Beiyanerpeton jianpingensis del Jurásico tardío del noreste de China. [18]
Las autoridades no están de acuerdo en si Salientia es un superorden que incluye al orden Anura, o si Anura es un suborden del orden Salientia. Los Lissamphibia se dividen tradicionalmente en tres órdenes , pero una familia extinta parecida a las salamandras, los Albanerpetontidae, ahora se considera parte de Lissamphibia junto con el superorden Salientia. Además, Salientia incluye los tres órdenes recientes más la protorana del Triásico, Triadobatrachus . [19]
Los primeros grupos importantes de anfibios se desarrollaron en el período Devónico , hace unos 370 millones de años, a partir de peces de aletas lobuladas que eran similares a los celacantos y peces pulmonados modernos . [20] Estos antiguos peces de aletas lobuladas habían desarrollado aletas con múltiples articulaciones similares a patas con dedos que les permitían arrastrarse por el fondo del mar. Algunos peces habían desarrollado pulmones primitivos que los ayudaban a respirar aire cuando los charcos estancados de los pantanos devónicos tenían poco oxígeno. También podían usar sus fuertes aletas para salir del agua y llegar a tierra firme si las circunstancias así lo requerían. Con el tiempo, sus aletas óseas evolucionarían hasta convertirse en extremidades y se convertirían en los antepasados de todos los tetrápodos , incluidos los anfibios, reptiles, aves y mamíferos modernos . A pesar de poder arrastrarse por la tierra, muchos de estos peces tetrapodomorfos prehistóricos todavía pasaban la mayor parte del tiempo en el agua. Habían comenzado a desarrollar pulmones, pero todavía respiraban predominantemente con branquias. [21]
Se han descubierto muchos ejemplos de especies que muestran características de transición . Ichthyostega fue uno de los primeros anfibios primitivos, con fosas nasales y pulmones más eficientes. Tenía cuatro extremidades robustas, un cuello, una cola con aletas y un cráneo muy similar al del pez de aletas lobuladas, Eusthenopteron . [20] Los anfibios desarrollaron adaptaciones que les permitieron permanecer fuera del agua durante períodos más largos. Sus pulmones mejoraron y sus esqueletos se volvieron más pesados y fuertes, más capaces de soportar el peso de sus cuerpos en tierra. Desarrollaron "manos" y "pies" con cinco o más dedos; [22] la piel se volvió más capaz de retener fluidos corporales y resistir la desecación. [21] El hueso hiomandibulario del pez en la región hioides detrás de las branquias disminuyó de tamaño y se convirtió en el estribo del oído anfibio, una adaptación necesaria para escuchar en tierra firme. [23] Una afinidad entre los anfibios y los peces teleósteos es la estructura multiplegada de los dientes y los huesos supraoccipitales pareados en la parte posterior de la cabeza, ninguna de estas características se encuentra en otras partes del reino animal. [24]

A finales del periodo Devónico (hace 360 millones de años), los mares, ríos y lagos rebosaban de vida mientras que la tierra era el reino de las plantas primitivas y carecía de vertebrados, [24] aunque algunos, como Ichthyostega , pueden haber salido a veces del agua. Se cree que pueden haberse impulsado con sus extremidades anteriores, arrastrando sus cuartos traseros de una manera similar a la utilizada por el elefante marino . [22] A principios del Carbonífero (hace 360 a 323 millones de años), el clima era relativamente húmedo y cálido. Se desarrollaron extensos pantanos con musgos , helechos , colas de caballo y calamitas . Los artrópodos que respiran aire evolucionaron e invadieron la tierra donde proporcionaron alimento a los anfibios carnívoros que comenzaron a adaptarse al entorno terrestre. No había otros tetrápodos en la tierra y los anfibios estaban en la cima de la cadena alimentaria, y algunos ocupaban posiciones ecológicas que hoy ocupan los cocodrilos. Aunque estaban equipados con extremidades y la capacidad de respirar aire, la mayoría todavía tenían un cuerpo largo y afilado y una cola fuerte. [24] Otros eran los principales depredadores terrestres, que a veces alcanzaban varios metros de longitud y se alimentaban de los grandes insectos de la época y de los numerosos tipos de peces del agua. Todavía necesitaban volver al agua para poner sus huevos sin cáscara, e incluso la mayoría de los anfibios modernos tienen una etapa larvaria completamente acuática con branquias como sus ancestros los peces. Fue el desarrollo del huevo amniótico , que evita que el embrión en desarrollo se seque, lo que permitió a los reptiles reproducirse en la tierra y lo que condujo a su dominio en el período siguiente. [20]
Después del colapso de la selva tropical del Carbonífero, el dominio de los anfibios dio paso a los reptiles, [25] y los anfibios fueron devastados aún más por el evento de extinción del Pérmico-Triásico . [26] Durante el Período Triásico (hace 252 a 201 millones de años), los reptiles continuaron superando a los anfibios, lo que llevó a una reducción tanto en el tamaño de los anfibios como en su importancia en la biosfera . Según el registro fósil, Lissamphibia , que incluye a todos los anfibios modernos y es el único linaje sobreviviente, puede haberse separado de los grupos extintos Temnospondyli y Lepospondyli en algún período entre el Carbonífero Tardío y el Triásico Temprano. La relativa escasez de evidencia fósil impide una datación precisa, [21] pero el estudio molecular más reciente, basado en la tipificación de secuencias de loci múltiples , sugiere un origen del Carbonífero Tardío/ Pérmico Temprano para los anfibios actuales. [27]

Los orígenes y las relaciones evolutivas entre los tres grupos principales de anfibios son un tema de debate. Una filogenia molecular de 2005, basada en el análisis de ADNr , sugiere que las salamandras y las cecilias están más estrechamente relacionadas entre sí que con las ranas. También parece que la divergencia de los tres grupos tuvo lugar en el Paleozoico o el Mesozoico temprano (hace unos 250 millones de años), antes de la ruptura del supercontinente Pangea y poco después de su divergencia de los peces de aletas lobuladas. La brevedad de este período y la rapidez con la que se produjo la radiación ayudarían a explicar la relativa escasez de fósiles de anfibios primitivos. [28] Hay grandes lagunas en el registro fósil ; el descubrimiento del temnospóndilo dissorofoide Gerobatrachus del Pérmico temprano en Texas en 2008 proporcionó un eslabón perdido con muchas de las características de las ranas modernas. [15] El análisis molecular sugiere que la divergencia rana-salamandra tuvo lugar considerablemente antes de lo que indica la evidencia paleontológica . [15] Un estudio sugirió que el último ancestro común de todos los anfibios modernos vivió hace unos 315 millones de años, y que los temnospóndilos estereospóndilos son los parientes más cercanos a las cecilias. [29] Sin embargo, la mayoría de los estudios apoyan un único origen monofilético de todos los anfibios modernos dentro de los temnospóndilos dissorofoideos. [4]
Los anfibios, que evolucionaron a partir de peces pulmonados, tuvieron que realizar ciertas adaptaciones para vivir en la tierra, incluida la necesidad de desarrollar nuevos medios de locomoción. En el agua, los impulsos laterales de sus colas los habían impulsado hacia adelante, pero en la tierra, se requerían mecanismos bastante diferentes. Sus columnas vertebrales, extremidades, cinturas pélvicas y musculatura debían ser lo suficientemente fuertes como para levantarlos del suelo para moverse y alimentarse. Los adultos terrestres descartaron sus sistemas de línea lateral y adaptaron sus sistemas sensoriales para recibir estímulos a través del aire. Necesitaron desarrollar nuevos métodos para regular su calor corporal para hacer frente a las fluctuaciones de la temperatura ambiente. Desarrollaron comportamientos adecuados para la reproducción en un entorno terrestre. Su piel estuvo expuesta a los dañinos rayos ultravioleta que anteriormente habían sido absorbidos por el agua. La piel cambió para volverse más protectora y evitar la pérdida excesiva de agua. [30]
La superclase Tetrapoda se divide en cuatro clases de animales vertebrados con cuatro extremidades. [31] Los reptiles, las aves y los mamíferos son amniotas, cuyos huevos son puestos o transportados por la hembra y están rodeados por varias membranas, algunas de las cuales son impermeables. [32] Al carecer de estas membranas, los anfibios necesitan cuerpos de agua para reproducirse, aunque algunas especies han desarrollado varias estrategias para proteger o eludir la vulnerable etapa larvaria acuática. [30] No se encuentran en el mar con la excepción de una o dos ranas que viven en agua salobre en manglares ; [33] mientras tanto, la salamandra de Anderson se encuentra en lagos de agua salobre o salada. [34] En la tierra, los anfibios están restringidos a hábitats húmedos debido a la necesidad de mantener su piel húmeda. [30]
Los anfibios modernos tienen una anatomía simplificada en comparación con sus ancestros debido a la pedomorfosis , causada por dos tendencias evolutivas: la miniaturización y un genoma inusualmente grande, que resultan en una tasa de crecimiento y desarrollo más lenta en comparación con otros vertebrados. [35] [36] Otra razón para su tamaño está asociada con su rápida metamorfosis, que parece haber evolucionado solo en los ancestros de los lisanfibios; en todas las demás líneas conocidas el desarrollo fue mucho más gradual. Debido a que una remodelación del aparato de alimentación significa que no comen durante la metamorfosis, la metamorfosis tiene que ir más rápido cuanto más pequeño es el individuo, por lo que ocurre en una etapa temprana cuando las larvas aún son pequeñas. (Las especies más grandes de salamandras no pasan por una metamorfosis). [37] Los anfibios que ponen huevos en la tierra a menudo pasan por toda la metamorfosis dentro del huevo. Un huevo terrestre anamniótico tiene menos de 1 cm de diámetro debido a problemas de difusión, un tamaño que limita la cantidad de crecimiento posterior a la eclosión. [38]
El anfibio (y vertebrado) más pequeño del mundo es una rana microhílida de Nueva Guinea ( Paedophryne amauensis ) descubierta por primera vez en 2012. Tiene una longitud media de 7,7 mm (0,30 pulgadas) y es parte de un género que contiene cuatro de las diez especies de ranas más pequeñas del mundo. [39] El anfibio vivo más grande es la salamandra gigante china de 1,8 m (5 pies 11 pulgadas) ( Andrias davidianus ) [40] pero es mucho más pequeño que el anfibio más grande que jamás haya existido: el extinto Prionosuchus de 9 m (30 pies) , un temnospóndilo parecido a un cocodrilo que data de hace 270 millones de años del Pérmico medio de Brasil. [41] La rana más grande es la rana Goliat africana ( Conraua goliath ), que puede alcanzar los 32 cm (13 pulgadas) y pesar 3 kg (6,6 libras). [40]
Los anfibios son vertebrados ectotérmicos (de sangre fría) que no mantienen su temperatura corporal mediante procesos fisiológicos internos. Su tasa metabólica es baja y, como resultado, sus requerimientos de alimento y energía son limitados. En el estado adulto, tienen conductos lagrimales y párpados móviles, y la mayoría de las especies tienen oídos que pueden detectar vibraciones aéreas o del suelo. Tienen lenguas musculosas, que en muchas especies pueden ser protuberantes. Los anfibios modernos tienen vértebras completamente osificadas con procesos articulares . Sus costillas suelen ser cortas y pueden estar fusionadas a las vértebras. Sus cráneos son en su mayoría anchos y cortos, y a menudo están osificados de forma incompleta. Su piel contiene poca queratina y carece de escamas, aparte de unas pocas escamas parecidas a las de los peces en ciertas cecilias. La piel contiene muchas glándulas mucosas y, en algunas especies, glándulas venenosas (un tipo de glándula granulosa). Los corazones de los anfibios tienen tres cámaras, dos aurículas y un ventrículo . Tienen vejiga urinaria y excretan principalmente productos de desecho nitrogenados en forma de urea . La mayoría de los anfibios ponen sus huevos en el agua y tienen larvas acuáticas que sufren una metamorfosis para convertirse en adultos terrestres. Los anfibios respiran mediante un mecanismo de bombeo en el que el aire es aspirado primero hacia la región bucofaríngea a través de las fosas nasales. Estas se cierran luego y el aire es forzado hacia los pulmones mediante la contracción de la garganta. [42] Complementan esto con el intercambio de gases a través de la piel. [30]

El orden Anura (del griego antiguo a(n)- que significa "sin" y oura que significa "cola") comprende las ranas y los sapos. Por lo general, tienen extremidades traseras largas que se pliegan debajo de ellas, extremidades delanteras más cortas, dedos palmeados sin garras, sin cola, ojos grandes y piel glandular húmeda. [14] Los miembros de este orden con pieles lisas se conocen comúnmente como ranas, mientras que aquellos con pieles verrugosas se conocen como sapos. La diferencia no es formal taxonómicamente y hay numerosas excepciones a esta regla. Los miembros de la familia Bufonidae son conocidos como los "verdaderos sapos". [43] Las ranas varían en tamaño desde la rana Goliat de 30 centímetros (12 pulgadas) ( Conraua goliath ) de África Occidental [44] hasta la Paedophryne amauensis de 7,7 milímetros (0,30 pulgadas) , descrita por primera vez en Papúa Nueva Guinea en 2012, que también es el vertebrado más pequeño conocido. [45] Aunque la mayoría de las especies se asocian con hábitats acuáticos y húmedos, algunas están especializadas para vivir en árboles o en desiertos. Se encuentran en todo el mundo, excepto en las zonas polares. [46]
Anura se divide en tres subórdenes que son ampliamente aceptados por la comunidad científica, pero las relaciones entre algunas familias siguen sin estar claras. Los estudios moleculares futuros deberían proporcionar más conocimientos sobre sus relaciones evolutivas. [47] El suborden Archaeobatrachia contiene cuatro familias de ranas primitivas. Estas son Ascaphidae , Bombinatoridae , Discoglossidae y Leiopelmatidae que tienen pocas características derivadas y probablemente son parafiléticas con respecto a otros linajes de ranas. [48] Las seis familias en el suborden Mesobatrachia más avanzado evolutivamente son las fosoriales Megophryidae , Pelobatidae , Pelodytidae , Scaphiopodidae y Rhinophrynidae y las obligatoriamente acuáticas Pipidae . Estas tienen ciertas características que son intermedias entre los otros dos subórdenes. [48] Neobatrachia es por lejos el suborden más grande e incluye las familias restantes de ranas modernas, incluidas las especies más comunes. Aproximadamente el 96% de las más de 5.000 especies de ranas existentes son neobatracios. [49]

El orden Caudata (del latín cauda que significa "cola") está formado por las salamandras, animales alargados y de baja estatura que se parecen en su mayoría a los lagartos en forma. Este es un rasgo simplesiomórfico y no están más estrechamente relacionados con los lagartos que con los mamíferos. [50] Las salamandras carecen de garras, tienen piel sin escamas, lisa o cubierta de tubérculos , y colas que suelen estar aplanadas de lado a lado y a menudo con aletas. Varían en tamaño desde la salamandra gigante china ( Andrias davidianus ), que se ha informado que crece hasta una longitud de 1,8 metros (5 pies 11 pulgadas), [51] hasta el diminuto Thorius pennatulus de México que rara vez supera los 20 mm (0,8 pulgadas) de longitud. [52] Las salamandras tienen una distribución principalmente laurasiática , estando presentes en gran parte de la región holártica del hemisferio norte. La familia Plethodontidae también se encuentra en América Central y América del Sur al norte de la cuenca del Amazonas ; [46] América del Sur aparentemente fue invadida desde América Central aproximadamente al comienzo del Mioceno , hace 23 millones de años. [53] Urodela es un nombre que a veces se usa para todas las especies existentes de salamandras. [54] Los miembros de varias familias de salamandras se han vuelto pedomórficos y no logran completar su metamorfosis o conservan algunas características larvarias como adultos. [55] La mayoría de las salamandras miden menos de 15 cm (5,9 pulgadas) de largo. Pueden ser terrestres o acuáticas y muchas pasan parte del año en cada hábitat. Cuando están en la tierra, pasan la mayor parte del día escondidas debajo de piedras o troncos o en vegetación densa, emergiendo por la tarde y la noche para buscar gusanos, insectos y otros invertebrados. [46]

El suborden Cryptobranchoidea contiene las salamandras primitivas. Se han encontrado varios criptobránquidos fósiles, pero solo hay tres especies vivas, la salamandra gigante china ( Andrias davidianus ), la salamandra gigante japonesa ( Andrias japonicus ) y la salamandra gigante gigante ( Cryptobranchus alleganiensis ) de América del Norte. Estos grandes anfibios conservan varias características larvarias en su estado adulto; tienen hendiduras branquiales y los ojos no tienen párpados. Una característica única es su capacidad de alimentarse por succión, deprimiendo el lado izquierdo de su mandíbula inferior o el derecho. [56] Los machos excavan nidos, persuaden a las hembras para que depositen sus hilos de huevos dentro de ellos y los protegen. Además de respirar con pulmones, respiran a través de los numerosos pliegues de su fina piel, que tiene capilares cerca de la superficie. [57]
El suborden Salamandroidea contiene las salamandras avanzadas. Se diferencian de los criptobránquidos por tener huesos prearticulares fusionados en la mandíbula inferior y por utilizar la fertilización interna. En las salamandridas, el macho deposita un haz de esperma, el espermatóforo , y la hembra lo recoge y lo inserta en su cloaca donde el esperma se almacena hasta que se ponen los huevos. [58] La familia más grande de este grupo es Plethodontidae, las salamandras sin pulmones, que incluye el 60% de todas las especies de salamandras. La familia Salamandridae incluye las verdaderas salamandras y el nombre " tritón " se da a los miembros de su subfamilia Pleurodelinae . [14]
El tercer suborden, Sirenoidea , contiene las cuatro especies de sirenas, que pertenecen a una sola familia, Sirenidae . Los miembros de este orden son salamandras acuáticas parecidas a las anguilas con extremidades anteriores muy reducidas y sin extremidades posteriores. Algunas de sus características son primitivas, mientras que otras son derivadas. [59] Es probable que la fertilización sea externa, ya que los sirénidos carecen de las glándulas cloacales que utilizan los salamandridos machos para producir espermatóforos y las hembras carecen de espermatecas para almacenar el esperma. A pesar de esto, los huevos se ponen individualmente, un comportamiento que no favorece la fertilización externa. [58]

El orden Gymnophiona (del griego gymnos que significa "desnudo" y ophis que significa "serpiente") o Apoda comprende a las cecilias. Se trata de animales largos, cilíndricos y sin extremidades con forma de serpiente o gusano . Los adultos varían en longitud de 8 a 75 centímetros (3 a 30 pulgadas) con la excepción de la cecilia de Thomson ( Caecilia thompsoni ), que puede alcanzar los 150 cm (59 pulgadas). La piel de una cecilia tiene una gran cantidad de pliegues transversales y en algunas especies contiene diminutas escamas dérmicas incrustadas. Tiene ojos rudimentarios cubiertos de piel, que probablemente se limitan a discernir diferencias en la intensidad de la luz. También tiene un par de tentáculos cortos cerca del ojo que se pueden extender y que tienen funciones táctiles y olfativas . La mayoría de las cecilias viven bajo tierra en madrigueras en suelo húmedo, en madera podrida y debajo de restos vegetales, pero algunas son acuáticas. [60] La mayoría de las especies ponen sus huevos bajo tierra y cuando las larvas eclosionan, se dirigen a cuerpos de agua adyacentes. Otras incuban sus huevos y las larvas sufren una metamorfosis antes de que los huevos eclosionen. Unas pocas especies dan a luz crías vivas, a las que alimentan con secreciones glandulares mientras están en el oviducto. [61] Las cecilias tienen una distribución principalmente gondwánica , y se las encuentra en regiones tropicales de África, Asia y América Central y del Sur. [62]

La estructura tegumentaria contiene algunas características típicas comunes a los vertebrados terrestres, como la presencia de capas externas altamente cornificadas , renovadas periódicamente a través de un proceso de muda controlado por las glándulas pituitaria y tiroides . Los engrosamientos locales (a menudo llamados verrugas) son comunes, como los que se encuentran en los sapos. La parte exterior de la piel se muda periódicamente en su mayor parte en una sola pieza, en contraste con los mamíferos y las aves donde se muda en escamas. Los anfibios a menudo comen la piel desprendida. [46] Las cecilias son únicas entre los anfibios en tener escamas dérmicas mineralizadas incrustadas en la dermis entre los surcos de la piel. La similitud de estas con las escamas de los peces óseos es en gran parte superficial. Los lagartos y algunas ranas tienen osteodermos algo similares que forman depósitos óseos en la dermis, pero este es un ejemplo de evolución convergente con estructuras similares que han surgido de forma independiente en diversos linajes de vertebrados. [63]
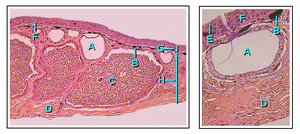
La piel de los anfibios es permeable al agua. El intercambio de gases puede tener lugar a través de la piel ( respiración cutánea ) y esto permite a los anfibios adultos respirar sin subir a la superficie del agua e hibernar en el fondo de los estanques. [46] Para compensar su piel fina y delicada, los anfibios han desarrollado glándulas mucosas, principalmente en la cabeza, la espalda y la cola. Las secreciones producidas por estas ayudan a mantener la piel húmeda. Además, la mayoría de las especies de anfibios tienen glándulas granulares que secretan sustancias desagradables o venenosas. Algunas toxinas de los anfibios pueden ser letales para los humanos, mientras que otras tienen poco efecto. [64] Las principales glándulas productoras de veneno, las parotoides , producen la neurotoxina bufotoxina y están ubicadas detrás de las orejas de los sapos, a lo largo de la espalda de las ranas, detrás de los ojos de las salamandras y en la superficie superior de las cecilias. [65]
El color de la piel de los anfibios se produce por tres capas de células pigmentarias llamadas cromatóforos . Estas tres capas celulares consisten en los melanóforos (que ocupan la capa más profunda), los guanóforos (que forman una capa intermedia y contienen muchos gránulos, produciendo un color azul verdoso) y los lipóforos (amarillos, la capa más superficial). El cambio de color que muestran muchas especies es iniciado por hormonas secretadas por la glándula pituitaria. A diferencia de los peces óseos, no existe un control directo de las células pigmentarias por parte del sistema nervioso, y esto da como resultado que el cambio de color se produzca más lentamente que en los peces. Una piel de colores vivos generalmente indica que la especie es tóxica y es una señal de advertencia para los depredadores. [66]
Los anfibios tienen un sistema esquelético que es estructuralmente homólogo al de otros tetrápodos, aunque con algunas variaciones. Todos tienen cuatro extremidades, excepto las cecilias sin patas y unas pocas especies de salamandras con extremidades reducidas o nulas. Los huesos son huecos y ligeros. El sistema musculoesquelético es fuerte para permitirle sostener la cabeza y el cuerpo. Los huesos están completamente osificados y las vértebras se entrelazan entre sí por medio de procesos superpuestos. La cintura escapular está sostenida por músculos, y la cintura pélvica bien desarrollada está unida a la columna vertebral por un par de costillas sacras. El íleon se inclina hacia adelante y el cuerpo se mantiene más cerca del suelo que en el caso de los mamíferos. [67]

En la mayoría de los anfibios, hay cuatro dedos en la pata delantera y cinco en la trasera, pero ninguna de las dos tiene garras. Algunas salamandras tienen menos dedos y las anfibias tienen un aspecto parecido al de una anguila, con patas pequeñas y rechonchas. Las sirenas son salamandras acuáticas con extremidades delanteras rechonchas y sin extremidades traseras. Las cecilias no tienen extremidades. Excavan como lombrices de tierra, con zonas de contracciones musculares que se desplazan a lo largo del cuerpo. En la superficie del suelo o en el agua, se mueven ondulando su cuerpo de un lado a otro. [68]
En las ranas, las patas traseras son más grandes que las delanteras, especialmente en aquellas especies que se desplazan principalmente saltando o nadando. En las ranas caminantes y corredoras, las patas traseras no son tan grandes, y las excavadoras tienen en su mayoría extremidades cortas y cuerpos anchos. Los pies tienen adaptaciones para su forma de vida, con membranas entre los dedos para nadar, almohadillas adhesivas anchas para trepar y tubérculos queratinizados en las patas traseras para cavar (las ranas suelen cavar hacia atrás en el suelo). En la mayoría de las salamandras, las extremidades son cortas y más o menos de la misma longitud y se proyectan en ángulo recto desde el cuerpo. La locomoción en tierra es caminando y la cola a menudo se balancea de un lado a otro o se utiliza como apoyo, en particular al trepar. En su andar normal, solo avanza una pata a la vez, de la manera adoptada por sus antepasados, los peces de aletas lobuladas. [67] Algunas salamandras del género Aneides y ciertos pletodóntidos trepan a los árboles y tienen extremidades largas, almohadillas grandes para los dedos y colas prensiles. [58] En las salamandras acuáticas y en los renacuajos de rana, la cola tiene aletas dorsales y ventrales y se mueve de lado a lado como medio de propulsión. Las ranas adultas no tienen cola y las cecilias solo la tienen muy corta. [68]

Las salamandras utilizan sus colas para defenderse y algunas están preparadas para deshacerse de ellas para salvar sus vidas en un proceso conocido como autotomía . Algunas especies de Plethodontidae tienen una zona débil en la base de la cola y utilizan esta estrategia con facilidad. La cola a menudo continúa moviéndose después de la separación, lo que puede distraer al atacante y permitir que la salamandra escape. Tanto la cola como las extremidades se pueden regenerar. [69] Las ranas adultas no pueden regenerar las extremidades, pero los renacuajos sí pueden hacerlo. [68]

Los anfibios tienen una etapa juvenil y una etapa adulta, y los sistemas circulatorios de ambas son distintos. En la etapa juvenil (o renacuajo), la circulación es similar a la de un pez; el corazón de dos cámaras bombea la sangre a través de las branquias, donde se oxigena, y se distribuye por todo el cuerpo y de regreso al corazón en un solo circuito. En la etapa adulta, los anfibios (especialmente las ranas) pierden sus branquias y desarrollan pulmones. Tienen un corazón que consta de un solo ventrículo y dos aurículas. Cuando el ventrículo comienza a contraerse, la sangre desoxigenada se bombea a través de la arteria pulmonar hacia los pulmones. La contracción continua luego bombea sangre oxigenada por el resto del cuerpo. La mezcla de los dos torrentes sanguíneos se minimiza por la anatomía de las cámaras. [70]
El sistema nervioso es básicamente el mismo que en otros vertebrados, con un cerebro central, una médula espinal y nervios por todo el cuerpo. El cerebro de los anfibios es relativamente simple pero en líneas generales es estructuralmente igual al de los reptiles, aves y mamíferos. Sus cerebros son alargados, excepto en las cecilias, y contienen las áreas motoras y sensoriales habituales de los tetrápodos. [71] Se cree que el cuerpo pineal , conocido por regular los patrones de sueño en los humanos, produce las hormonas involucradas en la hibernación y la estivación en los anfibios. [72]
Los renacuajos conservan el sistema de línea lateral de sus peces ancestrales, pero este se pierde en los anfibios terrestres adultos. Muchas salamandras acuáticas y algunas cecilias poseen electrorreceptores llamados órganos ampulares (completamente ausentes en los anuros), que les permiten localizar objetos a su alrededor cuando están sumergidos en el agua. [73] Los oídos están bien desarrollados en las ranas. No hay oído externo, pero el gran tímpano circular se encuentra en la superficie de la cabeza justo detrás del ojo. Este vibra y el sonido se transmite a través de un solo hueso, el estribo , al oído interno. Solo los sonidos de alta frecuencia como los llamados de apareamiento se escuchan de esta manera, pero los ruidos de baja frecuencia se pueden detectar a través de otro mecanismo. [67] Hay un parche de células ciliadas especializadas, llamadas papila amphibiorum , en el oído interno capaces de detectar sonidos más profundos. Otra característica exclusiva de las ranas y las salamandras es el complejo columela-opérculo adyacente a la cápsula auditiva, que participa en la transmisión de señales aéreas y sísmicas. [74] Los oídos de las salamandras y las cecilias están menos desarrollados que los de las ranas, ya que normalmente no se comunican entre sí a través del medio del sonido. [75]
Los ojos de los renacuajos carecen de párpados, pero en la metamorfosis, la córnea adquiere una forma más abovedada, el cristalino se vuelve más plano y se desarrollan los párpados y las glándulas y conductos asociados. [67] Los ojos de los adultos son una mejora de los ojos de los invertebrados y fueron un primer paso en el desarrollo de los ojos de los vertebrados más avanzados. Permiten la visión en color y la profundidad de foco. En las retinas hay bastones verdes, que son receptivos a una amplia gama de longitudes de onda. [75]
Muchos anfibios atrapan a sus presas sacando una lengua alargada con una punta pegajosa y llevándola hacia la boca antes de agarrar el objeto con sus mandíbulas. Algunos utilizan la alimentación inercial para ayudarlos a tragar la presa, empujando repetidamente su cabeza hacia adelante con fuerza, lo que hace que la comida se mueva hacia atrás en su boca por inercia . La mayoría de los anfibios tragan a sus presas enteras sin masticar mucho, por lo que poseen estómagos voluminosos. El esófago corto está revestido de cilios que ayudan a mover la comida hasta el estómago y el moco producido por las glándulas en la boca y la faringe facilita su paso. La enzima quitinasa producida en el estómago ayuda a digerir la cutícula quitinosa de las presas de los artrópodos. [76]
Los anfibios poseen páncreas , hígado y vesícula biliar . El hígado suele ser grande y tener dos lóbulos. Su tamaño está determinado por su función como unidad de almacenamiento de glucógeno y grasa, y puede cambiar con las estaciones a medida que se acumulan o se agotan estas reservas. El tejido adiposo es otro medio importante de almacenamiento de energía y esto ocurre en el abdomen (en estructuras internas llamadas cuerpos grasos), debajo de la piel y, en algunas salamandras, en la cola. [77]
En la parte dorsal, cerca del techo de la cavidad corporal, hay dos riñones . Su función es filtrar los desechos metabólicos de la sangre y transportar la orina a través de los uréteres hasta la vejiga urinaria, donde se almacena antes de ser expulsada periódicamente a través de la cloaca. Las larvas y la mayoría de los anfibios adultos acuáticos excretan el nitrógeno en forma de amoníaco en grandes cantidades de orina diluida, mientras que las especies terrestres, con una mayor necesidad de conservar agua, excretan el producto menos tóxico, la urea. Algunas ranas arbóreas con acceso limitado al agua excretan la mayor parte de sus desechos metabólicos en forma de ácido úrico. [78]
La mayoría de los anfibios acuáticos y semiacuáticos tienen una piel membranosa que les permite absorber agua directamente a través de ella. Algunos animales semiacuáticos también tienen una membrana vesical permeable de manera similar. [79] Como resultado, tienden a tener altas tasas de producción de orina para compensar esta alta ingesta de agua, y tienen orina con bajo contenido de sales disueltas. La vejiga urinaria ayuda a estos animales a retener sales. Algunos anfibios acuáticos como Xenopus no reabsorben agua, para evitar la entrada excesiva de agua. [80] Para los anfibios terrestres, la deshidratación da como resultado una reducción de la producción de orina. [81]
La vejiga de los anfibios suele ser muy distensible y, entre algunas especies terrestres de ranas y salamandras, puede representar entre el 20% y el 50% de su peso corporal total. [81] La orina fluye desde los riñones a través de los uréteres hacia la vejiga y se libera periódicamente desde la vejiga hacia la cloaca. [82]

Los pulmones de los anfibios son primitivos en comparación con los de los amniotas, ya que poseen pocos septos internos y grandes alvéolos y, en consecuencia, tienen una tasa de difusión comparativamente lenta para el oxígeno que ingresa a la sangre. La ventilación se logra mediante bombeo bucal . [83] Sin embargo, la mayoría de los anfibios pueden intercambiar gases con el agua o el aire a través de su piel. Para permitir una respiración cutánea suficiente , la superficie de su piel altamente vascularizada debe permanecer húmeda para permitir que el oxígeno se difunda a una velocidad suficientemente alta. [76] Debido a que la concentración de oxígeno en el agua aumenta tanto a bajas temperaturas como a altas velocidades de flujo, los anfibios acuáticos en estas situaciones pueden confiar principalmente en la respiración cutánea, como en la rana acuática del Titicaca y la salamandra gigante . En el aire, donde el oxígeno está más concentrado, algunas especies pequeñas pueden depender únicamente del intercambio de gases cutáneos, la más famosa de las cuales son las salamandras pletodóntidas , que no tienen pulmones ni branquias. Muchas salamandras acuáticas y todos los renacuajos tienen branquias en su etapa larvaria, y algunos (como el ajolote ) conservan branquias cuando son adultos acuáticos. [76]

Para reproducirse , la mayoría de los anfibios necesitan agua dulce , aunque algunos ponen sus huevos en la tierra y han desarrollado diversos medios para mantenerlos húmedos. Unos pocos (por ejemplo, Fejervarya raja ) pueden habitar en aguas salobres, pero no hay verdaderos anfibios marinos . [84] Sin embargo, hay informes de poblaciones particulares de anfibios que invaden inesperadamente las aguas marinas. Tal fue el caso de la invasión del Mar Negro del híbrido natural Pelophylax esculentus reportada en 2010. [85]
Sin embargo, varios cientos de especies de ranas en radiaciones adaptativas (por ejemplo, Eleutherodactylus , la Platymantis del Pacífico , los microhílidos australo-papúes y muchas otras ranas tropicales) no necesitan agua para reproducirse en la naturaleza . Se reproducen mediante desarrollo directo, una adaptación ecológica y evolutiva que les ha permitido ser completamente independientes del agua estancada. Casi todas estas ranas viven en selvas tropicales húmedas y sus huevos eclosionan directamente en versiones en miniatura del adulto, pasando por la etapa de renacuajo dentro del huevo. El éxito reproductivo de muchos anfibios depende no solo de la cantidad de lluvia, sino también de la sincronización estacional. [86]
En los trópicos, muchos anfibios se reproducen de forma continua o en cualquier época del año. En las regiones templadas, la reproducción es mayoritariamente estacional, normalmente en primavera, y se desencadena por el aumento de la duración del día, el aumento de las temperaturas o las precipitaciones. Los experimentos han demostrado la importancia de la temperatura, pero el evento desencadenante, especialmente en las regiones áridas, suele ser una tormenta. En los anuros, los machos suelen llegar a los lugares de reproducción antes que las hembras y el coro vocal que producen puede estimular la ovulación en las hembras y la actividad endocrina de los machos que aún no son reproductivamente activos. [87]
En las cecilias, la fecundación es interna, el macho extruye un órgano intromitente , elfalodeo y su inserción en la cloaca femenina. Las glándulas de Müller, situadas en el interior de la cloaca masculina, secretan un líquido similar al que producen las glándulas prostáticas de los mamíferos y que puede transportar y nutrir el esperma. La fertilización probablemente se produce en el oviducto. [88]
La mayoría de las salamandras también realizan la fecundación interna . En la mayoría de ellas, el macho deposita un espermatóforo, un pequeño paquete de esperma sobre un cono gelatinoso, sobre el sustrato , ya sea en tierra o en el agua. La hembra recoge el paquete de esperma sujetándolo con los labios de la cloaca y empujándolo hacia el respiradero. Los espermatozoides se mueven hacia la espermateca en el techo de la cloaca, donde permanecen hasta la ovulación, que puede ocurrir muchos meses después. Los rituales de cortejo y los métodos de transferencia del espermatóforo varían entre especies. En algunas, el espermatóforo puede colocarse directamente en la cloaca de la hembra, mientras que en otras, la hembra puede ser guiada hasta el espermatóforo o retenida con un abrazo llamado amplexus . Ciertas salamandras primitivas de las familias Sirenidae, Hynobiidae y Cryptobranchidae practican la fecundación externa de manera similar a las ranas, con la hembra poniendo los huevos en el agua y el macho liberando el esperma sobre la masa de huevos. [88]
Con algunas excepciones, las ranas utilizan la fertilización externa. El macho agarra a la hembra con fuerza con sus extremidades anteriores, ya sea detrás de los brazos o delante de las patas traseras, o en el caso de Epipedobates tricolor , alrededor del cuello. Permanecen en amplexo con sus cloacas posicionadas juntas mientras la hembra pone los huevos y el macho los cubre con esperma. Las almohadillas nupciales ásperas en las manos del macho ayudan a retener el agarre. A menudo, el macho recoge y retiene la masa de huevos, formando una especie de canasta con las patas traseras. Una excepción es la rana venenosa granular ( Oophaga granulifera ), donde el macho y la hembra colocan sus cloacas muy cerca mientras miran en direcciones opuestas y luego liberan los huevos y el esperma simultáneamente. La rana con cola ( Ascaphus truei ) exhibe fertilización interna. La "cola" solo la posee el macho y es una extensión de la cloaca y se usa para inseminar a la hembra. Esta rana vive en arroyos de corriente rápida y la fertilización interna evita que el esperma sea arrastrado antes de que se produzca la fertilización. [89] El esperma puede retenerse en tubos de almacenamiento unidos al oviducto hasta la primavera siguiente. [90]
La mayoría de las ranas pueden clasificarse como reproductoras prolongadas o explosivas. Por lo general, las reproductoras prolongadas se congregan en un sitio de reproducción, y los machos suelen llegar primero, llaman y establecen territorios. Otros machos satélites permanecen tranquilos cerca, esperando su oportunidad de apoderarse de un territorio. Las hembras llegan esporádicamente, se lleva a cabo la selección de pareja y se ponen huevos. Las hembras se van y los territorios pueden cambiar de manos. Aparecen más hembras y, a su debido tiempo, la temporada de reproducción llega a su fin. Las reproductoras explosivas, por otro lado, se encuentran donde aparecen charcas temporales en regiones secas después de las lluvias. Estas ranas son típicamente especies fosoriales que emergen después de fuertes lluvias y se congregan en un sitio de reproducción. Son atraídas allí por el llamado del primer macho que encuentra un lugar adecuado, tal vez una charca que se forma en el mismo lugar cada temporada de lluvias. Las ranas reunidas pueden llamar al unísono y se produce una actividad frenética, y los machos se apresuran a aparearse con el número generalmente menor de hembras. [89]

Existe una competencia directa entre los machos para ganar la atención de las hembras en las salamandras y los tritones, con elaboradas exhibiciones de cortejo para mantener la atención de la hembra el tiempo suficiente para que se interese en elegirlo para aparearse . [91] Algunas especies almacenan esperma durante largas temporadas de reproducción, ya que el tiempo adicional puede permitir interacciones con espermatozoides rivales. [92]
Las salamandras topo unisexuales hembras (género Ambystoma) son comunes en la región de los Grandes Lagos de América del Norte. [93] Estas salamandras son el linaje de vertebrados unisexuales más antiguo conocido, habiendo surgido hace unos 5 millones de años. [94] A veces puede ocurrir un intercambio de genoma entre la hembra unisexual Ambystoma y los machos de especies sexuales simpátricas. [94]
La mayoría de los anfibios pasan por una metamorfosis , un proceso de cambio morfológico significativo después del nacimiento. En el desarrollo típico de los anfibios, los huevos se ponen en el agua y las larvas se adaptan a un estilo de vida acuático. Las ranas, sapos y salamandras salen del huevo como larvas con branquias externas. La metamorfosis en los anfibios está regulada por la concentración de tiroxina en la sangre, que estimula la metamorfosis, y la prolactina , que contrarresta el efecto de la tiroxina. Los eventos específicos dependen de los valores umbral para diferentes tejidos. [95] Debido a que la mayor parte del desarrollo embrionario está fuera del cuerpo parental, está sujeto a muchas adaptaciones debido a circunstancias ambientales específicas. Por esta razón, los renacuajos pueden tener crestas córneas en lugar de dientes , extensiones de piel similares a bigotes o aletas. También hacen uso de un órgano sensorial de la línea lateral similar al de los peces. Después de la metamorfosis, estos órganos se vuelven redundantes y serán reabsorbidos por muerte celular controlada, llamada apoptosis . La variedad de adaptaciones a circunstancias ambientales específicas entre los anfibios es amplia y todavía se están realizando muchos descubrimientos. [96]

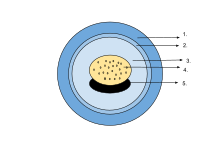
En el huevo, el embrión está suspendido en un líquido perivitelino y rodeado de cápsulas gelatinosas semipermeables, y la masa vitelina proporciona nutrientes. A medida que las larvas eclosionan, las cápsulas se disuelven mediante enzimas secretadas por una glándula en la punta del hocico. [75] Los huevos de algunas salamandras y ranas contienen algas verdes unicelulares. Estas penetran la envoltura gelatinosa después de la puesta de los huevos y pueden aumentar el suministro de oxígeno al embrión a través de la fotosíntesis. Parecen acelerar el desarrollo de las larvas y reducir la mortalidad. [97] En la rana de bosque ( Rana sylvatica ), se ha descubierto que el interior del grupo de huevos globulares es hasta 6 °C (11 °F) más cálido que sus alrededores, lo que es una ventaja en su hábitat frío del norte. [98]
Los huevos pueden depositarse individualmente, en grupos o en largas hileras. Los sitios para poner huevos incluyen agua, barro, madrigueras, escombros y en plantas o debajo de troncos o piedras. [99] La rana de invernadero ( Eleutherodactylus planirostris ) pone huevos en pequeños grupos en el suelo donde se desarrollan en aproximadamente dos semanas directamente en ranas juveniles sin una etapa larvaria intermedia. [100] La rana túngara ( Physalaemus pustulosus ) construye un nido flotante de espuma para proteger sus huevos. Primero construye una balsa, luego pone los huevos en el centro y finalmente se superpone una capa de espuma. La espuma tiene propiedades antimicrobianas. No contiene detergentes , pero se crea batiendo las proteínas y lectinas secretadas por la hembra. [101] [102]

Los huevos de los anfibios se ponen típicamente en el agua y eclosionan en larvas de vida libre que completan su desarrollo en el agua y luego se transforman en adultos acuáticos o terrestres. En muchas especies de ranas y en la mayoría de las salamandras sin pulmones (Plethodontidae), se produce un desarrollo directo, las larvas crecen dentro de los huevos y emergen como adultos en miniatura. Muchas cecilias y algunos otros anfibios ponen sus huevos en la tierra, y las larvas recién nacidas se retuercen o son transportadas a cuerpos de agua. Algunas cecilias, la salamandra alpina ( Salamandra atra ) y algunos de los sapos vivíparos africanos ( Nectophrynoides spp. ) son vivíparos . Sus larvas se alimentan de secreciones glandulares y se desarrollan dentro del oviducto de la hembra, a menudo durante largos períodos. Otros anfibios, pero no las cecilias, son ovovivíparos . Los huevos se mantienen dentro o sobre el cuerpo del progenitor, pero las larvas subsisten con las yemas de sus huevos y no reciben alimento del adulto. Las larvas emergen en distintas etapas de su crecimiento, ya sea antes o después de la metamorfosis, según su especie. [103] El género de sapos Nectophrynoides exhibe todos estos patrones de desarrollo entre su docena de miembros. [12] Las larvas de anfibios se conocen como renacuajos . Tienen cuerpos gruesos y redondeados con colas musculosas poderosas. [78]
A diferencia de otros anfibios, los renacuajos de rana no se parecen a los adultos. [104] Las larvas de vida libre normalmente son completamente acuáticas, pero los renacuajos de algunas especies (como Nannophrys ceylonensis ) son semiterrestres y viven entre rocas húmedas. [105] Los renacuajos tienen esqueletos cartilaginosos, branquias para la respiración (branquias externas al principio, branquias internas más tarde), sistemas de línea lateral y colas grandes que usan para nadar. [106] Los renacuajos recién nacidos pronto desarrollan bolsas branquiales que cubren las branquias. Estas branquias internas y opérculo no son homólogos a los de los peces, [107] y solo se encuentran en renacuajos, ya que tanto las salamandras como las cecilias solo tienen branquias externas. [108] Combinado con el bombeo bucal, las branquias internas han permitido a los renacuajos adoptar un estilo de vida de alimentación por filtración , incluso si varias especies han desarrollado desde entonces otros tipos de estrategias de alimentación. [109] Los pulmones se desarrollan temprano y se utilizan como órganos respiratorios auxiliares, los renacuajos suben a la superficie del agua para tragar aire. Algunas especies completan su desarrollo dentro del huevo y eclosionan directamente en pequeñas ranas. Estas larvas no tienen branquias, sino que tienen áreas especializadas de piel a través de las cuales se lleva a cabo la respiración. Si bien los renacuajos no tienen dientes verdaderos, en la mayoría de las especies, las mandíbulas tienen filas largas y paralelas de pequeñas estructuras queratinizadas llamadas queradontes rodeadas por un pico córneo. [110] Las patas delanteras se forman debajo del saco branquial y las patas traseras se vuelven visibles unos días después.
El yodo y la T4 (que sobreestimulan la espectacular apoptosis [muerte celular programada] de las células de las branquias, cola y aletas de las larvas) también estimulan la evolución de los sistemas nerviosos transformando al renacuajo acuático y vegetariano en la rana terrestre y carnívora con mejores capacidades neurológicas, visoespaciales, olfativas y cognitivas para la caza. [111] [112]
De hecho, los renacuajos que se desarrollan en estanques y arroyos son típicamente herbívoros . Los renacuajos de estanque tienden a tener cuerpos profundos, grandes aletas caudales y bocas pequeñas; nadan en aguas tranquilas alimentándose de fragmentos de vegetación en crecimiento o sueltos. Los habitantes de arroyos en su mayoría tienen bocas más grandes, cuerpos poco profundos y aletas caudales; se adhieren a plantas y piedras y se alimentan de las películas superficiales de algas y bacterias. [113] También se alimentan de diatomeas , filtradas del agua a través de las branquias , y revuelven el sedimento en el fondo del estanque, ingiriendo fragmentos comestibles. Tienen un intestino relativamente largo y en forma de espiral que les permite digerir esta dieta. [113] Algunas especies son carnívoras en la etapa de renacuajo, comiendo insectos, renacuajos más pequeños y peces. Las crías de la rana arbórea cubana ( Osteopilus septentrionalis ) ocasionalmente pueden ser caníbales , los renacuajos más jóvenes atacan a un renacuajo más grande y desarrollado cuando está en metamorfosis. [114]
Durante la metamorfosis, se producen cambios rápidos en el cuerpo, ya que el estilo de vida de la rana cambia por completo. La boca en forma de espiral con crestas dentaria córneas se reabsorbe junto con el intestino espiral. El animal desarrolla una mandíbula grande y sus branquias desaparecen junto con su saco branquial. Los ojos y las patas crecen rápidamente y se forma una lengua. Hay cambios asociados en las redes neuronales, como el desarrollo de la visión estereoscópica y la pérdida del sistema de la línea lateral. Todo esto puede suceder en aproximadamente un día. Unos días más tarde, la cola se reabsorbe, debido a la mayor concentración de tiroxina necesaria para que esto tenga lugar. [113]



Al momento de la eclosión, una larva típica de salamandra tiene ojos sin párpados, dientes en las mandíbulas superior e inferior, tres pares de branquias externas plumosas y una cola larga con aletas dorsales y ventrales . Las extremidades anteriores pueden estar parcialmente desarrolladas y las extremidades traseras son rudimentarias en las especies que viven en estanques, pero pueden estar bastante más desarrolladas en las especies que se reproducen en agua en movimiento. Las larvas de tipo estanque a menudo tienen un par de equilibradores, estructuras similares a varillas a cada lado de la cabeza que pueden evitar que las branquias se obstruyan con sedimentos. [115] [116] Ambos son capaces de reproducirse. [117] Algunas tienen larvas que nunca se desarrollan completamente en la forma adulta, una condición conocida como neotenia . [118] La neotenia ocurre cuando la tasa de crecimiento del animal es muy baja y generalmente está relacionada con condiciones adversas como bajas temperaturas del agua que pueden cambiar la respuesta de los tejidos a la hormona tiroxina. [119] así como la falta de alimento. Hay quince especies de salamandras neoténicas obligadas, incluidas especies de Necturus , Proteus y Amphiuma , y muchos ejemplos de salamandras facultativas, como la salamandra del noroeste ( Ambystoma gracile ) y la salamandra tigre ( A. tigrinum ) que adoptan esta estrategia en circunstancias ambientales apropiadas. [118]
Las salamandras sin pulmones de la familia Plethodontidae son terrestres y ponen una pequeña cantidad de huevos no pigmentados en un grupo entre la hojarasca húmeda. Cada huevo tiene un gran saco vitelino y la larva se alimenta de él mientras se desarrolla dentro del huevo, emergiendo completamente formada como una salamandra juvenil. La salamandra hembra a menudo incuba los huevos. En el género Ensatinas , se ha observado que la hembra se enrolla alrededor de ellos y presiona su área de la garganta contra ellos, masajeándolos efectivamente con una secreción mucosa. [120]
En los tritones y las salamandras, la metamorfosis es menos dramática que en las ranas. Esto se debe a que las larvas ya son carnívoras y continúan alimentándose como depredadores cuando son adultas, por lo que se necesitan pocos cambios en sus sistemas digestivos. Sus pulmones son funcionales desde el principio, pero las larvas no los utilizan tanto como los renacuajos. Sus branquias nunca están cubiertas por sacos branquiales y se reabsorben justo antes de que los animales abandonen el agua. Otros cambios incluyen la reducción del tamaño o la pérdida de las aletas caudales, el cierre de las hendiduras branquiales, el engrosamiento de la piel, el desarrollo de los párpados y ciertos cambios en la dentición y la estructura de la lengua. Las salamandras son más vulnerables en la metamorfosis, ya que la velocidad de natación se reduce y las colas en transformación son un estorbo en la tierra. [121] Las salamandras adultas a menudo tienen una fase acuática en primavera y verano, y una fase terrestre en invierno. Para la adaptación a una fase acuática, la prolactina es la hormona necesaria, y para la adaptación a la fase terrestre, la tiroxina. Las branquias externas no regresan en fases acuáticas posteriores porque éstas son absorbidas completamente al salir del agua por primera vez. [115]

La mayoría de las cecilias terrestres que ponen huevos lo hacen en madrigueras o lugares húmedos en la tierra cerca de cuerpos de agua. El desarrollo de las crías de Ichthyophis glutinosus , una especie de Sri Lanka, ha sido muy estudiado. Las larvas parecidas a las anguilas salen de los huevos y se dirigen al agua. Tienen tres pares de branquias externas rojas y plumosas, una cabeza roma con dos ojos rudimentarios, un sistema de línea lateral y una cola corta con aletas. Nadan ondulando su cuerpo de lado a lado. Son principalmente activos durante la noche, pronto pierden sus branquias y hacen incursiones en la tierra. La metamorfosis es gradual. A la edad de unos diez meses han desarrollado una cabeza puntiaguda con tentáculos sensoriales cerca de la boca y han perdido sus ojos, sistemas de línea lateral y cola. La piel se engrosa, se desarrollan escamas incrustadas y el cuerpo se divide en segmentos. En este momento, la cecilia ha construido una madriguera y está viviendo en la tierra. [122]

En la mayoría de las especies de cecilias, las crías se producen por viviparidad. Typhlonectes compressicauda , una especie de América del Sur, es un ejemplo típico de ellas. En el oviducto pueden desarrollarse hasta nueve larvas a la vez. Son alargadas y tienen branquias pares en forma de saco, ojos pequeños y dientes raspadores especializados. Al principio, se alimentan de las yemas de los huevos, pero a medida que esta fuente de alimento disminuye, comienzan a raspar las células epiteliales ciliadas que recubren el oviducto. Esto estimula la secreción de líquidos ricos en lípidos y mucoproteínas de los que se alimentan junto con raspaduras de la pared del oviducto. Pueden aumentar su longitud seis veces y tener dos quintas partes de la longitud de su madre antes de nacer. En ese momento han sufrido una metamorfosis, han perdido los ojos y las branquias, han desarrollado una piel más gruesa y tentáculos bucales y han reabsorbido los dientes. Un juego de dientes permanentes crece poco después del nacimiento. [123] [124]
Las branquias sólo aparecen necesariamente durante el desarrollo embrionario y, en las especies que dan a luz, la descendencia nace después de la degeneración branquial. En las cecilias que ponen huevos, las branquias se reabsorben antes de la eclosión o, en las especies que eclosionan con restos branquiales aún presentes, duran poco y sólo dejan una hendidura branquial. En las especies con escamas bajo la piel, las escamas no se forman antes, durante la metamorfosis. [125]
La cecilia anillada ( Siphonops annulatus ) ha desarrollado una adaptación única para fines reproductivos. La progenie se alimenta de una capa de piel que es especialmente desarrollada por el adulto en un fenómeno conocido como dermatofagia materna. La cría se alimenta en grupo durante unos siete minutos a intervalos de aproximadamente tres días, lo que le da a la piel la oportunidad de regenerarse. Mientras tanto, se ha observado que ingieren líquido exudado de la cloaca materna. [126]

El cuidado de las crías entre los anfibios ha sido poco estudiado, pero, en general, cuanto mayor es el número de huevos en una tanda, menos probable es que se produzca algún grado de cuidado parental. No obstante, se estima que en hasta un 20% de las especies de anfibios, uno o ambos adultos desempeñan algún papel en el cuidado de las crías. [127] Las especies que se reproducen en cuerpos de agua más pequeños u otros hábitats especializados tienden a tener patrones complejos de comportamiento en el cuidado de sus crías. [128]
Muchas salamandras de bosque ponen huevos bajo troncos muertos o piedras en la tierra. La salamandra negra de montaña ( Desmognathus welteri ) hace esto, la madre empolla los huevos y los protege de la depredación mientras los embriones se alimentan de las yemas de sus huevos. Cuando están completamente desarrollados, salen de las cápsulas de huevos y se dispersan como salamandras juveniles. [129] El macho de la salamandra gigante, una salamandra primitiva, excava un nido submarino y anima a las hembras a poner allí. Luego, el macho protege el lugar durante los dos o tres meses antes de que los huevos eclosionen, utilizando ondulaciones corporales para abanicar los huevos y aumentar su suministro de oxígeno. [57]

El macho Colostethus subpunctatus , una rana diminuta, protege el racimo de huevos que está oculto bajo una piedra o un tronco. Cuando los huevos eclosionan, el macho transporta los renacuajos en su espalda, pegados allí por una secreción mucosa, a un estanque temporal donde se sumerge en el agua y los renacuajos caen. [130] El sapo partero macho ( Alytes obstetricans ) enrolla cuerdas de huevos alrededor de sus muslos y lleva los huevos por hasta ocho semanas. Los mantiene húmedos y cuando están listos para eclosionar, visita un estanque o zanja y libera los renacuajos. [131] La rana incubadora gástrica hembra ( Rheobatrachus spp. ) criaba larvas en su estómago después de tragar los huevos o las crías; sin embargo, esta etapa nunca se observó antes de que la especie se extinguiera. Los renacuajos secretan una hormona que inhibe la digestión en la madre mientras se desarrollan al consumir su gran suministro de yema. [132] La rana darlingtoni pone huevos en el suelo. Cuando eclosionan, el macho lleva a los renacuajos en bolsas de cría en sus patas traseras. [133] El sapo acuático de Surinam ( Pipa pipa ) cría a sus crías en poros en su espalda donde permanecen hasta la metamorfosis. [134] La rana venenosa granular ( Oophaga granulifera ) es típica de una serie de ranas arbóreas en la familia de las ranas venenosas dardo Dendrobatidae . Sus huevos se ponen en el suelo del bosque y cuando eclosionan, los renacuajos son llevados uno por uno en la espalda de un adulto a una grieta adecuada llena de agua, como la axila de una hoja o la roseta de una bromelia . La hembra visita los sitios de cría regularmente y deposita huevos no fertilizados en el agua que son consumidos por los renacuajos. [135]
Los anfibios son notables entre los vertebrados por su diversidad de cromosomas y genomas. Los cariotipos ( cromosomas ) se han determinado para al menos 1.193 (14,5%) de las ≈8.200 especies conocidas ( diploides ), incluyendo 963 anuros , 209 salamandras y 21 cecilias . Generalmente, los cariotipos de los anfibios diploides se caracterizan por 20-26 cromosomas bi-armados. Los anfibios también tienen genomas muy grandes en comparación con otros taxones de vertebrados y una variación correspondiente en el tamaño del genoma ( valor C : picogramos de ADN en núcleos haploides ). Los tamaños del genoma varían de 0,95 a 11,5 pg en ranas, de 13,89 a 120,56 pg en salamandras y de 2,94 a 11,78 pg en cecilias. [136]
El gran tamaño de los genomas ha impedido la secuenciación completa de los anfibios, aunque recientemente se han publicado varios genomas. El borrador del genoma de Xenopus tropicalis, de 1,7 GB , fue el primero en ser publicado para anfibios en 2010. [136] En comparación con algunas salamandras, el genoma de esta rana es diminuto. Por ejemplo, el genoma del ajolote mexicano resultó ser de 32 GB, que es más de 10 veces más grande que el genoma humano (3 GB). [137]

Con algunas excepciones, los anfibios adultos son depredadores y se alimentan de prácticamente cualquier cosa que se mueva y que puedan tragar. La dieta consiste principalmente en presas pequeñas que no se mueven demasiado rápido, como escarabajos, orugas, lombrices de tierra y arañas. Las sirenas ( Siren spp. ) a menudo ingieren material vegetal acuático junto con los invertebrados de los que se alimentan [138] y una rana arbórea brasileña ( Xenohyla truncata ) incluye una gran cantidad de fruta en su dieta. [139] El sapo excavador mexicano ( Rhinophrynus dorsalis ) tiene una lengua especialmente adaptada para recoger hormigas y termitas. La proyecta con la punta hacia adelante, mientras que otras ranas sacan primero la parte trasera, con la lengua articulada en la parte delantera. [140]
La comida se selecciona principalmente por la vista, incluso en condiciones de poca luz. El movimiento de la presa desencadena una respuesta de alimentación. Se han atrapado ranas en anzuelos cebados con franela roja y se han encontrado ranas verdes ( Rana clamitans ) con el estómago lleno de semillas de olmo que habían visto flotar cerca. [141] Los sapos, las salamandras y las cecilias también utilizan el olfato para detectar presas. Esta respuesta es principalmente secundaria porque se ha observado que las salamandras permanecen estacionarias cerca de presas olorosas, pero solo se alimentan si se mueven. Los anfibios que viven en cuevas normalmente cazan por el olfato. Algunas salamandras parecen haber aprendido a reconocer presas inmóviles cuando no tienen olor, incluso en completa oscuridad. [142]
Los anfibios suelen tragar la comida entera, pero pueden masticarla ligeramente primero para dominarla. [46] Por lo general, tienen pequeños dientes pedicelados con bisagras , una característica única de los anfibios. La base y la corona de estos están compuestas de dentina separada por una capa no calcificada y se reemplazan a intervalos. Las salamandras, las cecilias y algunas ranas tienen una o dos filas de dientes en ambas mandíbulas, pero algunas ranas ( Rana spp. ) carecen de dientes en la mandíbula inferior y los sapos ( Bufo spp. ) no tienen dientes. En muchos anfibios también hay dientes vomerinos unidos a un hueso facial en el techo de la boca. [143]

La salamandra tigre ( Ambystoma tigrinum ) es típica de las ranas y salamandras que se esconden bajo cubierta listas para emboscar a invertebrados desprevenidos. Otros anfibios, como los sapos Bufo spp. , buscan activamente presas, mientras que la rana cornuda argentina ( Ceratophrys ornata ) atrae a las presas curiosas más cerca levantando sus patas traseras sobre su espalda y vibrando sus dedos amarillos. [144] Entre las ranas de hojarasca en Panamá, las ranas que cazan presas activamente tienen bocas estrechas y son delgadas, a menudo de colores brillantes y tóxicas, mientras que las emboscadoras tienen bocas anchas y son anchas y bien camufladas. [145] Las cecilias no chasquean la lengua, sino que atrapan a su presa agarrándola con sus dientes ligeramente apuntando hacia atrás. Las luchas de la presa y los movimientos posteriores de la mandíbula la empujan hacia adentro y la cecilia generalmente se retira a su madriguera. La presa sometida es engullida entera. [146]
Cuando son recién nacidas, las larvas de rana se alimentan de la yema del huevo. Cuando esta se agota, algunas pasan a alimentarse de bacterias, costras de algas, detritos y raspaduras de plantas sumergidas. El agua es absorbida por sus bocas, que generalmente están en la parte inferior de sus cabezas, y pasa a través de trampas de alimento branquiales entre sus bocas y sus branquias, donde las partículas finas quedan atrapadas en la mucosidad y son filtradas. Otras tienen piezas bucales especializadas que consisten en un pico córneo bordeado por varias filas de dientes labiales. Raspan y muerden alimentos de muchos tipos, además de remover el sedimento del fondo, filtrando partículas más grandes con las papilas alrededor de sus bocas. Algunas, como los sapos de espuelas, tienen mandíbulas mordedoras fuertes y son carnívoras o incluso caníbales. [147]
.jpg/440px-Dendropsophus_microcephalus_-_calling_male_(Cope,_1886).jpg)
Los llamados que emiten las cecilias y las salamandras se limitan a suaves chillidos ocasionales, gruñidos o silbidos y no han sido muy estudiados. Un sonido de chasquido que a veces producen las cecilias puede ser un medio de orientación, como en los murciélagos, o una forma de comunicación. La mayoría de las salamandras se consideran sordas , pero la salamandra gigante de California ( Dicamptodon ensatus ) tiene cuerdas vocales y puede producir un sonido de traqueteo o ladrido. Algunas especies de salamandras emiten un chillido o aullido silencioso si son atacadas. [148]

Las ranas son mucho más vocales, especialmente durante la época de cría, cuando utilizan sus voces para atraer a sus parejas. La presencia de una especie en particular en una zona puede discernirse más fácilmente por su llamado característico que por un vistazo fugaz del animal en sí. En la mayoría de las especies, el sonido se produce expulsando aire de los pulmones a través de las cuerdas vocales hacia un saco o sacos de aire en la garganta o en la comisura de la boca. Este puede distenderse como un globo y actúa como un resonador, ayudando a transferir el sonido a la atmósfera o al agua en momentos en que el animal está sumergido. [148] La vocalización principal es el fuerte llamado de anuncio del macho que busca tanto alentar a una hembra a acercarse como disuadir a otros machos de invadir su territorio. Este llamado se modifica a un llamado de cortejo más suave cuando se acerca una hembra o a una versión más agresiva si un intruso macho se acerca. El llamado conlleva el riesgo de atraer depredadores e implica el gasto de mucha energía. [149] Otros llamados incluyen aquellos emitidos por una hembra en respuesta al llamado de anuncio y un llamado de liberación emitido por un macho o una hembra durante intentos no deseados de amplexo. Cuando una rana es atacada, se emite un llamado de angustia o miedo, a menudo parecido a un grito. [150] La rana arbórea cubana, generalmente nocturna ( Osteopilus septentrionalis ), produce un llamado de lluvia cuando llueve durante las horas del día. [151]
Se sabe poco sobre el comportamiento territorial de las cecilias, pero algunas ranas y salamandras defienden sus áreas de distribución, que suelen ser zonas de alimentación, cría o refugio. Los machos suelen mostrar este comportamiento, aunque en algunas especies también participan las hembras e incluso los ejemplares jóvenes. Aunque en muchas especies de ranas las hembras son más grandes que los machos, no es el caso de la mayoría de las especies en las que los machos participan activamente en la defensa territorial. Algunas de estas ranas tienen adaptaciones específicas, como dientes agrandados para morder o espinas en el pecho, los brazos o los pulgares. [152]

En las salamandras, la defensa de un territorio implica adoptar una postura agresiva y, si es necesario, atacar al intruso. Esto puede implicar morder, perseguir y, a veces, morder, lo que en ocasiones provoca la pérdida de la cola. El comportamiento de las salamandras de espalda roja ( Plethodon cinereus ) ha sido muy estudiado. El 91% de los individuos marcados que fueron recapturados más tarde estaban a un metro (yarda) de su refugio diurno original debajo de un tronco o una roca. [153] Una proporción similar, cuando se movió experimentalmente una distancia de 30 metros (98 pies), encontró el camino de regreso a su base de origen. [153] Las salamandras dejaron marcas de olor alrededor de sus territorios que tenían un promedio de 0,16 a 0,33 metros cuadrados (1,7 a 3,6 pies cuadrados) de tamaño y, a veces, estaban habitadas por una pareja de macho y hembra. [154] Estas disuadieron la intrusión de otros y delinearon los límites entre áreas vecinas. Gran parte de su comportamiento parecía estereotipado y no implicaba ningún contacto real entre individuos. Una postura agresiva implicaba levantar el cuerpo del suelo y mirar fijamente al oponente, que a menudo se daba la vuelta sumisamente. Si el intruso persistía, normalmente se lanzaba una embestida mordedora en la región de la cola o en los surcos nasolabiales. Los daños en cualquiera de estas áreas pueden reducir la aptitud física del rival, ya sea por la necesidad de regenerar tejido o porque perjudica su capacidad para detectar comida. [153]
En las ranas, el comportamiento territorial de los machos se observa a menudo en los lugares de cría; el llamado es tanto un anuncio de la propiedad de parte de este recurso como un llamado de anuncio a posibles parejas. En general, una voz más grave representa a un individuo más pesado y poderoso, y esto puede ser suficiente para evitar la intrusión de machos más pequeños. Se utiliza mucha energía en la vocalización y esto pasa factura al dueño del territorio, que puede ser desplazado por un rival más en forma si se cansa. Existe una tendencia entre los machos a tolerar a los dueños de territorios vecinos mientras atacan vigorosamente a los intrusos desconocidos. Los dueños de territorios tienen una "ventaja local" y generalmente salen mejor parados en un encuentro entre dos ranas de tamaño similar. Si las amenazas son insuficientes, pueden producirse peleas pecho contra pecho. Los métodos de lucha incluyen empujones, desinflar el saco vocal del oponente, agarrarlo por la cabeza, saltar sobre su espalda, morderlo, perseguirlo, salpicarlo y sumergirlo bajo el agua. [155]

Los anfibios tienen cuerpos blandos con pieles finas y carecen de garras, armadura defensiva o espinas. Sin embargo, han desarrollado varios mecanismos de defensa para mantenerse vivos. La primera línea de defensa en las salamandras y las ranas es la secreción mucosa que producen. Esto mantiene su piel húmeda y las hace resbaladizas y difíciles de agarrar. La secreción es a menudo pegajosa y desagradable o tóxica. [156] Se ha observado que las serpientes bostezan y abren la boca cuando intentan tragarse ranas africanas con garras ( Xenopus laevis ), lo que les da a las ranas la oportunidad de escapar. [156] [157] Las cecilias han sido poco estudiadas a este respecto, pero la cecilia de Cayena ( Typhlonectes compressicauda ) produce un moco tóxico que ha matado a peces depredadores en un experimento de alimentación en Brasil. [158] En algunas salamandras, la piel es venenosa. El tritón de piel áspera ( Taricha granulosa ) de América del Norte y otros miembros de su género contienen la neurotoxina tetrodotoxina (TTX), la sustancia no proteica más tóxica conocida y casi idéntica a la producida por el pez globo . La manipulación de los tritones no causa daño, pero la ingestión de incluso las cantidades más pequeñas de la piel es mortal. En los ensayos de alimentación, se encontró que los peces, las ranas, los reptiles, las aves y los mamíferos eran susceptibles. [159] [160] Los únicos depredadores con cierta tolerancia al veneno son ciertas poblaciones de culebra de liga común ( Thamnophis sirtalis ). En los lugares donde coexisten tanto la serpiente como la salamandra, las serpientes han desarrollado inmunidad a través de cambios genéticos y se alimentan de los anfibios con impunidad. [161] La coevolución ocurre con el tritón aumentando sus capacidades tóxicas al mismo ritmo que la serpiente desarrolla aún más su inmunidad. [160] Algunas ranas y sapos son tóxicos; las principales glándulas venenosas se encuentran a los lados del cuello y debajo de las verrugas de la espalda. Estas regiones están expuestas al animal atacante y sus secreciones pueden tener un sabor desagradable o causar diversos síntomas físicos o neurológicos. En total, se han aislado más de 200 toxinas de la cantidad limitada de especies de anfibios que se han investigado. [162]


Las especies venenosas suelen utilizar colores brillantes para advertir a los depredadores potenciales de su toxicidad. Estos colores de advertencia tienden a ser rojo o amarillo combinado con negro, siendo la salamandra común ( Salamandra salamandra ) un ejemplo. Una vez que un depredador ha probado una de estas, es probable que recuerde la coloración la próxima vez que se encuentre con un animal similar. En algunas especies, como el sapo de vientre de fuego ( Bombina spp. ), la coloración de advertencia está en el vientre y estos animales adoptan una pose defensiva cuando son atacados, exhibiendo sus colores brillantes al depredador. La rana Allobates zaparo no es venenosa, pero imita la apariencia de otras especies tóxicas en su localidad, una estrategia que puede engañar a los depredadores. [164]
Muchos anfibios son nocturnos y se esconden durante el día, evitando así a los depredadores diurnos que cazan por la vista. Otros anfibios utilizan el camuflaje para evitar ser detectados. Tienen varios colores, como marrones moteados, grises y olivas, para mimetizarse con el fondo. Algunas salamandras adoptan poses defensivas cuando se enfrentan a un depredador potencial, como la musaraña de cola corta del norte de América del Norte ( Blarina brevicauda ). Sus cuerpos se retuercen y levantan y agitan sus colas, lo que dificulta que el depredador evite el contacto con sus glándulas granulares productoras de veneno. [165] Algunas salamandras autotomizan sus colas cuando son atacadas, sacrificando esta parte de su anatomía para poder escapar. La cola puede tener una constricción en su base para permitir que se desprenda fácilmente. La cola se regenera más tarde, pero el costo energético para el animal de reemplazarla es significativo. [69] Algunas ranas y sapos se inflan para parecer grandes y feroces, y algunos sapos de espuelas ( Pelobates spp ) gritan y saltan hacia el atacante. [46] Las salamandras gigantes del género Andrias , así como las ranas Ceratophrine y Pyxicephalus poseen dientes afilados y son capaces de extraer sangre con una mordedura defensiva. La salamandra de vientre negro ( Desmognathus quadramaculatus ) puede morder a una serpiente de liga común ( Thamnophis sirtalis ) atacante dos o tres veces su tamaño en la cabeza y a menudo logra escapar. [166]
In amphibians, there is evidence of habituation, associative learning through both classical and instrumental learning, and discrimination abilities.[167] Amphibians are widely considered to be sentient, able to feel emotions such as anxiety and fear.[168]
In one experiment, when offered live fruit flies (Drosophila virilis), salamanders chose the larger of 1 vs 2 and 2 vs 3. Frogs can distinguish between low numbers (1 vs 2, 2 vs 3, but not 3 vs 4) and large numbers (3 vs 6, 4 vs 8, but not 4 vs 6) of prey. This is irrespective of other characteristics, i.e. surface area, volume, weight and movement, although discrimination among large numbers may be based on surface area.[169]

Dramatic declines in amphibian populations, including population crashes and mass localized extinction, have been noted since the late 1980s from locations all over the world, and amphibian declines are thus perceived to be one of the most critical threats to global biodiversity.[170] In 2004, the International Union for Conservation of Nature (IUCN) reported stating that currently birds,[171] mammals, and amphibians extinction rates were at minimum 48 times greater than natural extinction rates—possibly 1,024 times higher. In 2006, there were believed to be 4,035 species of amphibians that depended on water at some stage during their life cycle. Of these, 1,356 (33.6%) were considered to be threatened and this figure is likely to be an underestimate because it excludes 1,427 species for which there was insufficient data to assess their status.[172] A number of causes are believed to be involved, including habitat destruction and modification, over-exploitation, pollution, introduced species, global warming, endocrine-disrupting pollutants, destruction of the ozone layer (ultraviolet radiation has shown to be especially damaging to the skin, eyes, and eggs of amphibians), and diseases like chytridiomycosis. However, many of the causes of amphibian declines are still poorly understood, and are a topic of ongoing discussion.[173]

Any decline in amphibian numbers will affect the patterns of predation. The loss of carnivorous species near the top of the food chain will upset the delicate ecosystem balance and may cause dramatic increases in opportunistic species.
Predators that feed on amphibians are affected by their decline. The western terrestrial garter snake (Thamnophis elegans) in California is largely aquatic and depends heavily on two species of frog that are decreasing in numbers, the Yosemite toad (Bufo canorus) and the mountain yellow-legged frog (Rana muscosa), putting the snake's future at risk. If the snake were to become scarce, this would affect birds of prey and other predators that feed on it.[174] Meanwhile, in the ponds and lakes, fewer frogs means fewer tadpoles. These normally play an important role in controlling the growth of algae and also forage on detritus that accumulates as sediment on the bottom. A reduction in the number of tadpoles may lead to an overgrowth of algae, resulting in depletion of oxygen in the water when the algae later die and decompose. Aquatic invertebrates and fish might then die and there would be unpredictable ecological consequences.[175]
The decline in amphibian and reptile populations has led to an awareness of the effects of pesticides on reptiles and amphibians.[176] In the past, the argument that amphibians or reptiles were more susceptible to any chemical contamination than any land aquatic vertebrate was not supported by research until recently.[176] Amphibians and reptiles have complex life cycles, live in different climate and ecological zones, and are more vulnerable to chemical exposure. Certain pesticides, such as organophosphates, neonicotinoids, and carbamates, react via cholinesterase inhibition. Cholinesterase is an enzyme that causes the hydrolysis of acetylcholine, an excitatory neurotransmitter that is abundant in the nervous system. AChE inhibitors are either reversible or irreversible, and carbamates are safer than organophosphorus insecticides, which are more likely to cause cholinergic poisoning. Reptile exposure to an AChE inhibitory pesticide may result in disruption of neural function in reptiles. The buildup of these inhibitory effects on motor performance, such as food consumption and other activities.
The Amphibian Specialist Group of the IUCN is spearheading efforts to implement a comprehensive global strategy for amphibian conservation.[177] Amphibian Ark is an organization that was formed to implement the ex-situ conservation recommendations of this plan, and they have been working with zoos and aquaria around the world, encouraging them to create assurance colonies of threatened amphibians.[177] One such project is the Panama Amphibian Rescue and Conservation Project that built on existing conservation efforts in Panama to create a country-wide response to the threat of chytridiomycosis.[178]
Another measure would be to stop exploitation of frogs for human consumption. In the Middle East, a growing appetite for eating frog legs and the consequent gathering of them for food was already linked to an increase in mosquitoes and thus has direct consequences for human health.[179]
...there has been a growing consensus that lissamphibians are a monophyletic assemblage derived from within Temnospondyli, and more specifically from within the amphibamid dissorophoids.
Amphibian skin colour.
{{cite book}}: CS1 maint: multiple names: authors list (link)