El amoníaco es un compuesto químico inorgánico de nitrógeno e hidrógeno con la fórmula N H 3 . Un hidruro binario estable y el hidruro pictógeno más simple, el amoníaco es un gas incoloro con un olor penetrante distintivo. Biológicamente, es un desecho nitrogenado común y contribuye significativamente a las necesidades nutricionales de los organismos terrestres al servir como precursor de fertilizantes . [13] Alrededor del 70% del amoníaco producido industrialmente se utiliza para fabricar fertilizantes [14] en varias formas y composiciones, como la urea y el fosfato diamónico . El amoníaco en forma pura también se aplica directamente al suelo.
El amoniaco, ya sea directa o indirectamente, también es un componente básico para la síntesis de muchas sustancias químicas.
El amoniaco se encuentra en la naturaleza y se ha detectado en el medio interestelar. En muchos países está clasificado como una sustancia extremadamente peligrosa . [15]
El amoníaco se produce biológicamente en un proceso llamado fijación de nitrógeno , pero se genera aún más industrialmente mediante el proceso Haber . El proceso ayudó a revolucionar la agricultura al proporcionar fertilizantes baratos. La producción industrial mundial de amoníaco en 2021 fue de 235 millones de toneladas. [16] [17] El amoníaco industrial se transporta en vagones cisterna o cilindros. [18]
El NH3 hierve a -33,34 °C (-28,012 °F) a una presión de una atmósfera , pero el líquido a menudo se puede manipular en el laboratorio sin refrigeración externa. El amoníaco doméstico o hidróxido de amonio es una solución de NH3 en agua.
Plinio , en el Libro XXXI de su Historia Natural , se refiere a una sal llamada hammoniacum , llamada así por la proximidad de su fuente al Templo de Júpiter Amón ( griego Ἄμμων Ammon ) en la provincia romana de Cirenaica . [19] Sin embargo, la descripción que Plinio da de la sal no se ajusta a las propiedades del cloruro de amonio . Según el comentario de Herbert Hoover en su traducción al inglés de De re metallica de Georgius Agricola , es probable que haya sido sal marina común. [20] En cualquier caso, esa sal en última instancia dio al amoníaco y a los compuestos de amonio su nombre.
En el agua de lluvia se encuentran trazas de amoníaco/amonio. El cloruro de amonio ( sal amoniacal ) y el sulfato de amonio se encuentran en las zonas volcánicas. En guano patagónico se han encontrado cristales de bicarbonato de amonio . [21]
El amoníaco se encuentra en todo el Sistema Solar en Marte , Júpiter , Saturno , Urano , Neptuno y Plutón , entre otros lugares: en cuerpos más pequeños y helados como Plutón, el amoníaco puede actuar como un anticongelante geológicamente importante, ya que una mezcla de agua y amoníaco puede tener un punto de fusión tan bajo como -100 °C (-148 °F; 173 K) si la concentración de amoníaco es lo suficientemente alta y, por lo tanto, permitir que dichos cuerpos retengan océanos internos y geología activa a una temperatura mucho más baja de lo que sería posible con agua sola. [22] [23] Las sustancias que contienen amoníaco, o aquellas que son similares a él, se denominan amoniacales . [24]
El amoníaco es un gas incoloro con un olor característico acre . Es más ligero que el aire , su densidad es 0,589 veces la del aire . Se licúa fácilmente debido a los fuertes enlaces de hidrógeno entre las moléculas. El amoníaco gaseoso se convierte en un líquido incoloro , que hierve a -33,1 °C (-27,58 °F) y se congela en cristales incoloros [21] a -77,7 °C (-107,86 °F). Hay pocos datos disponibles a temperaturas y presiones muy altas, pero el punto crítico líquido-vapor se produce a 405 K y 11,35 MPa. [25]
La simetría del cristal es cúbica, símbolo de Pearson cP16, grupo espacial P2 1 3 No.198, constante reticular 0,5125 nm . [26]
El amoníaco líquido posee fuertes poderes ionizantes que reflejan su alto ε de 22 a -35 °C (-31 °F). [27] El amoníaco líquido tiene un cambio de entalpía estándar de vaporización muy alto (23,5 kJ/mol ; [28] a modo de comparación, el del agua es de 40,65 kJ/mol, el del metano de 8,19 kJ/mol y el de la fosfina de 14,6 kJ/mol) y se puede transportar en recipientes presurizados o refrigerados; sin embargo, a temperatura y presión estándar, el amoníaco anhidro líquido se vaporizará. [29]
El amoniaco se disuelve fácilmente en agua. En una solución acuosa, se puede expulsar por ebullición. La solución acuosa de amoniaco es básica y puede describirse como amoniaco acuoso o hidróxido de amonio . [30] La concentración máxima de amoniaco en agua (una solución saturada ) tiene una gravedad específica de 0,880 y a menudo se la conoce como "amoniaco .880". [31]
El amoníaco líquido es un disolvente ionizante no acuoso ampliamente estudiado. Su propiedad más destacada es su capacidad para disolver metales alcalinos para formar soluciones altamente coloreadas y eléctricamente conductoras que contienen electrones solvatados . Aparte de estas notables soluciones, gran parte de la química del amoníaco líquido se puede clasificar por analogía con reacciones relacionadas en soluciones acuosas . La comparación de las propiedades físicas del NH 3 con las del agua muestra que el NH 3 tiene el punto de fusión, el punto de ebullición, la densidad, la viscosidad , la constante dieléctrica y la conductividad eléctrica más bajos . Estas diferencias se atribuyen al menos en parte al enlace de hidrógeno más débil en el NH 3. La constante de autodisociación iónica del NH 3 líquido a −50 °C es de aproximadamente 10 −33 .

El amoníaco líquido es un disolvente ionizante, aunque menos que el agua, y disuelve una variedad de compuestos iónicos, incluidos muchos nitratos , nitritos , cianuros , tiocianatos , complejos de ciclopentadienilo metálico y bis(trimetilsilil)amidas metálicas . [32] La mayoría de las sales de amonio son solubles y actúan como ácidos en soluciones de amoníaco líquido. La solubilidad de las sales de haluro aumenta de fluoruro a yoduro . Una solución saturada de nitrato de amonio ( solución de Divers , llamada así por Edward Divers ) contiene 0,83 moles de soluto por mol de amoníaco y tiene una presión de vapor de menos de 1 bar incluso a 25 °C (77 °F). Sin embargo, pocas sales de oxianiones con otros cationes se disuelven. [34]
El amoníaco líquido disolverá todos los metales alcalinos y otros metales electropositivos como Ca , [35] Sr , Ba , Eu e Yb (también Mg mediante un proceso electrolítico [33] ). En concentraciones bajas (<0,06 mol/L), se forman soluciones de color azul intenso: estas contienen cationes metálicos y electrones solvatados , electrones libres que están rodeados por una jaula de moléculas de amoníaco.
Estas soluciones son agentes reductores fuertes. En concentraciones más altas, las soluciones tienen un aspecto metálico y una conductividad eléctrica mejor. A bajas temperaturas, los dos tipos de soluciones pueden coexistir como fases inmiscibles.

El rango de estabilidad termodinámica de las soluciones de amoníaco líquido es muy estrecho, ya que el potencial de oxidación a dinitrógeno, E ° ( N 2 + 6NH 4 + + 6 e − ⇌ 8NH 3 ), es solo +0,04 V. En la práctica, tanto la oxidación a dinitrógeno como la reducción a dihidrógeno son lentas. Esto es particularmente cierto en el caso de las soluciones reductoras: las soluciones de los metales alcalinos mencionados anteriormente son estables durante varios días y se descomponen lentamente en la amida metálica y el dihidrógeno. La mayoría de los estudios que involucran soluciones de amoníaco líquido se realizan en condiciones reductoras; aunque la oxidación del amoníaco líquido suele ser lenta, todavía existe el riesgo de explosión, particularmente si hay iones de metales de transición como posibles catalizadores.
[[Archivo:NH 3 -Dipole-Moment.png|thumb|Estructura molecular del amoniaco y su forma tridimensional. Tiene un momento dipolar neto de 1,484 D. ]]

La molécula de amoníaco tiene una forma piramidal trigonal , como lo predice la teoría de repulsión de pares electrónicos de la capa de valencia (teoría VSEPR) con un ángulo de enlace determinado experimentalmente de 106,7°. [36] El átomo de nitrógeno central tiene cinco electrones externos con un electrón adicional de cada átomo de hidrógeno. Esto da un total de ocho electrones, o cuatro pares de electrones que están dispuestos tetraédricamente . Tres de estos pares de electrones se utilizan como pares de enlace, lo que deja un par solitario de electrones. El par solitario se repele con más fuerza que los pares de enlace; por lo tanto, el ángulo de enlace no es 109,5°, como se esperaba para una disposición tetraédrica regular, sino 106,8°. [36] Esta forma le da a la molécula un momento dipolar y la hace polar . La polaridad de la molécula, y especialmente su capacidad para formar enlaces de hidrógeno , hace que el amoníaco sea altamente miscible con agua. El par solitario hace que el amoníaco sea una base , un aceptor de protones. El amoníaco es moderadamente básico; Una solución acuosa de 1,0 M tiene un pH de 11,6 y si a dicha solución se le añade un ácido fuerte hasta que la solución se vuelve neutra ( pH = 7 ), el 99,4% de las moléculas de amoniaco están protonadas . La temperatura y la salinidad también afectan a la proporción de amonio [NH 4 ] + . Este último tiene la forma de un tetraedro regular y es isoelectrónico con el metano .
La molécula de amoniaco sufre fácilmente una inversión de nitrógeno a temperatura ambiente; una analogía útil es la de un paraguas que se da vuelta con un fuerte viento. La barrera energética para esta inversión es de 24,7 kJ/mol y la frecuencia de resonancia es de 23,79 GHz , que corresponde a una radiación de microondas de una longitud de onda de 1,260 cm. La absorción a esta frecuencia fue el primer espectro de microondas que se observó [37] y se utilizó en el primer máser .
Una de las propiedades más características del amoniaco es su basicidad . Se considera que el amoniaco es una base débil. Se combina con ácidos para formar sales de amonio ; así, con ácido clorhídrico forma cloruro de amonio (sal amoniacal); con ácido nítrico , nitrato de amonio , etc. El gas amoniaco perfectamente seco no se combinará con el gas cloruro de hidrógeno perfectamente seco ; la humedad es necesaria para que se produzca la reacción. [38] [39]
Como experimento de demostración bajo aire con humedad ambiental, se abren botellas de soluciones concentradas de amoníaco y ácido clorhídrico y se produce una nube de cloruro de amonio que parece surgir "de la nada" a medida que se forma el aerosol de sal donde las dos nubes de reactivos que se difunden se encuentran entre las dos botellas.
Las sales producidas por la acción del amoniaco sobre los ácidos se conocen como sales de amonio y todas contienen el ion amonio ( [NH 4 ] + ). [38]
Aunque el amoniaco es bien conocido como una base débil, también puede actuar como un ácido extremadamente débil. Es una sustancia prótica y es capaz de formar amidas (que contienen el ion NH − 2 ). Por ejemplo, el litio se disuelve en amoniaco líquido para dar una solución azul ( electrón solvatado ) de amida de litio :
Al igual que el agua, el amoníaco líquido sufre autoionización molecular para formar sus conjugados ácidos y básicos :
El amoniaco suele funcionar como una base débil , por lo que tiene cierta capacidad amortiguadora . Los cambios en el pH harán que haya más o menos cationes amonio ( NH 4 + ) y aniones amida ( NH 2 − ) presentes en la solución . A presión y temperatura estándar,
El amoníaco no arde fácilmente ni mantiene la combustión , excepto en mezclas estrechas de combustible y aire de 15 a 28 % de amoníaco por volumen en el aire. [40] Cuando se mezcla con oxígeno , arde con una llama de color verde amarillento pálido. La ignición ocurre cuando el cloro pasa al amoníaco, formando nitrógeno y cloruro de hidrógeno ; si el cloro está presente en exceso, también se forma el altamente explosivo tricloruro de nitrógeno ( NCl 3 ).
La combustión del amoniaco para formar nitrógeno y agua es exotérmica :
El cambio de entalpía estándar de la combustión , Δ H ° c , expresado por mol de amoniaco y con condensación del agua formada, es de −382,81 kJ/mol. El dinitrógeno es el producto termodinámico de la combustión : todos los óxidos de nitrógeno son inestables con respecto al N 2 y al O 2 , lo que constituye el principio que subyace al convertidor catalítico . Los óxidos de nitrógeno se pueden formar como productos cinéticos en presencia de catalizadores apropiados , una reacción de gran importancia industrial en la producción de ácido nítrico :
Una reacción posterior conduce al NO 2 :
La combustión de amoníaco en el aire es muy difícil en ausencia de un catalizador (como una gasa de platino o un óxido de cromo (III) caliente ), debido al calor de combustión relativamente bajo, una velocidad de combustión laminar más baja, una temperatura de autoignición alta , un calor de vaporización alto y un rango de inflamabilidad estrecho . Sin embargo, estudios recientes han demostrado que se puede lograr una combustión eficiente y estable de amoníaco utilizando cámaras de combustión de remolino, reavivando así el interés de la investigación en el amoníaco como combustible para la producción de energía térmica. [41] El rango de inflamabilidad del amoníaco en aire seco es de 15,15 a 27,35% y en aire con una humedad relativa del 100% es de 15,95 a 26,55%. [42] [ aclaración necesaria ] Para estudiar la cinética de la combustión del amoníaco, se requiere el conocimiento de un mecanismo de reacción confiable y detallado, pero esto ha sido un desafío para obtener. [43]
El amoníaco es un precursor directo o indirecto de la mayoría de los compuestos nitrogenados manufacturados. Es el precursor del ácido nítrico, que es la fuente de la mayoría de los compuestos aromáticos N-sustituidos.
Las aminas se pueden formar mediante la reacción del amoníaco con haluros de alquilo o, más comúnmente, con alcoholes :
Su reacción de apertura de anillo con óxido de etileno produce etanolamina , dietanolamina y trietanolamina .
Las amidas se pueden preparar mediante la reacción del amoniaco con el ácido carboxílico y sus derivados. Por ejemplo, el amoniaco reacciona con el ácido fórmico (HCOOH) para producir formamida ( HCONH 2 ) cuando se calienta. Los cloruros de acilo son los más reactivos, pero el amoniaco debe estar presente en al menos un exceso del doble para neutralizar el cloruro de hidrógeno formado. Los ésteres y anhídridos también reaccionan con el amoniaco para formar amidas. Las sales de amonio de los ácidos carboxílicos se pueden deshidratar para formar amidas calentándolas a 150–200 °C, siempre que no haya grupos sensibles al calor.
Otros compuestos organonitrógenos incluyen alprazolam , etanolamina , carbamato de etilo y hexametilentetramina .
El ácido nítrico se genera mediante el proceso de Ostwald por oxidación del amoníaco con aire sobre un catalizador de platino a 700–850 °C (1292–1562 °F), ≈9 atm. El óxido nítrico y el dióxido de nitrógeno son intermediarios en esta conversión: [44]
El ácido nítrico se utiliza para la producción de fertilizantes , explosivos y muchos compuestos organonitrógenos.
El hidrógeno del amoniaco es susceptible de ser reemplazado por una gran cantidad de sustituyentes. El gas amoniaco reacciona con el sodio metálico para formar sodamida , NaNH 2 . [38]
Con el cloro se forma monocloramina .
El amoníaco pentavalente se conoce como λ 5 -amina; el pentahidruro de nitrógeno se descompone espontáneamente en amoníaco trivalente (λ 3 -amina) y gas hidrógeno en condiciones normales. Esta sustancia se investigó como posible combustible sólido para cohetes en 1966. [45]
El amoniaco también se utiliza para fabricar los siguientes compuestos:
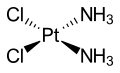
El amoníaco es un ligando que forma complejos de amina metálica . Por razones históricas, el amoníaco se denomina amina en la nomenclatura de compuestos de coordinación . Un complejo de amina notable es el cisplatino ( Pt(NH 3 ) 2 Cl 2 , un fármaco anticancerígeno ampliamente utilizado. Los complejos de amina de cromo (III) formaron la base de la teoría revolucionaria de Alfred Werner sobre la estructura de los compuestos de coordinación. Werner observó que solo se podían formar dos isómeros ( fac - y mer -) del complejo [CrCl 3 (NH 3 ) 3 ] , y concluyó que los ligandos deben estar dispuestos alrededor del ion metálico en los vértices de un octaedro .
El amoníaco forma aductos 1:1 con una variedad de ácidos de Lewis, como I 2 , fenol y Al(CH 3 ) 3 . El amoníaco es una base dura (teoría HSAB) y sus parámetros E y C son E B = 2,31 y C B = 2,04. Su fuerza donante relativa hacia una serie de ácidos, en comparación con otras bases de Lewis, se puede ilustrar mediante gráficos CB .
El amoníaco y las sales de amonio se pueden detectar fácilmente, en trazas muy pequeñas, mediante la adición de la solución de Nessler , que da una coloración amarilla distintiva en presencia de la más mínima traza de amoníaco o sales de amonio. La cantidad de amoníaco en las sales de amonio se puede estimar cuantitativamente mediante la destilación de las sales con sodio (NaOH) o hidróxido de potasio (KOH), absorbiendo el amoníaco desprendido en un volumen conocido de ácido sulfúrico estándar y determinando luego volumétricamente el exceso de ácido ; o el amoníaco se puede absorber en ácido clorhídrico y el cloruro de amonio así formado precipitar como hexacloroplatinato de amonio , [NH 4 ] 2 [PtCl 6 ] . [46]
Las barras de azufre se queman para detectar pequeñas fugas en los sistemas de refrigeración industriales de amoníaco. Se pueden detectar cantidades mayores calentando las sales con un álcali cáustico o con cal viva , cuando el olor característico del amoníaco será inmediatamente evidente. [46] El amoníaco es un irritante y la irritación aumenta con la concentración; el límite de exposición permisible es de 25 ppm y letal por encima de 500 ppm en volumen. [47] Los detectores convencionales apenas detectan concentraciones más altas, el tipo de detector se elige de acuerdo con la sensibilidad requerida (por ejemplo, semiconductor, catalítico, electroquímico). Se han propuesto sensores holográficos para detectar concentraciones de hasta 12,5% en volumen. [48]
En un laboratorio, el amoníaco gaseoso se puede detectar utilizando ácido clorhídrico concentrado o cloruro de hidrógeno gaseoso. De la reacción entre el amoníaco y el HCl(g) surge un humo blanco denso (que es vapor de cloruro de amonio ). [49]
El nitrógeno amoniacal (NH3 - N) es una medida que se utiliza habitualmente para medir la cantidad de iones de amonio , derivados de forma natural del amoniaco y que se devuelven al amoniaco a través de procesos orgánicos, en el agua o en líquidos residuales. Es una medida que se utiliza principalmente para cuantificar valores en sistemas de tratamiento de residuos y de purificación de agua , así como para medir la salud de las reservas de agua naturales y artificiales. Se mide en unidades de mg/L ( miligramo por litro ).


El historiador griego Heródoto mencionó que había afloramientos de sal en una zona de Libia que estaba habitada por un pueblo llamado los 'ammonios' (ahora el oasis de Siwa en el noroeste de Egipto, donde todavía existen lagos salados). [50] [51] El geógrafo griego Estrabón también mencionó la sal de esta región. Sin embargo, los autores antiguos Dioscórides , Apicio , Arriano , Sinesio y Aecio de Amida describieron esta sal como formando cristales transparentes que podían usarse para cocinar y que eran esencialmente sal de roca . [52] Hammoniacus sal aparece en los escritos de Plinio , [53] aunque no se sabe si el término es equivalente al más moderno sal ammoniac (cloruro de amonio). [21] [54] [55]
La fermentación de la orina por las bacterias produce una solución de amoníaco ; por lo tanto, la orina fermentada se utilizaba en la Antigüedad clásica para lavar telas y ropa, para quitar el pelo de las pieles en preparación para el curtido, para servir como mordiente para teñir telas y para eliminar el óxido del hierro. [56] También la utilizaban los dentistas antiguos para lavar los dientes. [57] [58] [59]
En forma de sal amoniacal (نشادر, nushadir ), el amoníaco era importante para los alquimistas musulmanes . Fue mencionado en el Libro de las Piedras , probablemente escrito en el siglo IX y atribuido a Jābir ibn Hayyān . [60] También fue importante para los alquimistas europeos del siglo XIII, siendo mencionado por Alberto Magno . [21] También fue utilizado por los tintoreros en la Edad Media en forma de orina fermentada para alterar el color de los tintes vegetales. En el siglo XV, Basilio Valentín demostró que el amoníaco podía obtenerse mediante la acción de álcalis sobre la sal amoniacal. [61] En un período posterior, cuando la sal amoniacal se obtenía destilando las pezuñas y los cuernos de los bueyes y neutralizando el carbonato resultante con ácido clorhídrico , el nombre de "espíritu de cuerno de ciervo" se aplicó al amoníaco. [21] [62]
El amoníaco gaseoso fue aislado por primera vez por Joseph Black en 1756 al hacer reaccionar sal amónica ( cloruro de amonio ) con magnesia calcinada ( óxido de magnesio ). [63] [64] Fue aislado nuevamente por Peter Woulfe en 1767, [65] [66] por Carl Wilhelm Scheele en 1770 [67] y por Joseph Priestley en 1773 y fue denominado por él "aire alcalino". [21] [68] Once años después, en 1785, Claude Louis Berthollet determinó su composición. [69] [21]
La producción de amoniaco a partir del nitrógeno del aire (y del hidrógeno) fue inventada por Fritz Haber y Robert LeRossignol. La patente fue enviada en 1909 (USPTO Nr 1,202,995) y otorgada en 1916. Más tarde, Carl Bosch desarrolló el método industrial para la producción de amoniaco ( proceso Haber-Bosch ). Se utilizó por primera vez a escala industrial en Alemania durante la Primera Guerra Mundial , [70] tras el bloqueo aliado que cortó el suministro de nitratos desde Chile . El amoniaco se utilizó para producir explosivos para sostener los esfuerzos de guerra. [71] El Premio Nobel de Química de 1918 fue otorgado a Fritz Haber "por la síntesis de amoniaco a partir de sus elementos".
Antes de la disponibilidad del gas natural, el hidrógeno como precursor de la producción de amoníaco se producía mediante la electrólisis del agua o utilizando el proceso cloro-álcali .
Con la llegada de la industria del acero en el siglo XX, el amoníaco se convirtió en un subproducto de la producción de carbón de coque .
En los EE. UU., en 2019 [actualizar], aproximadamente el 88% del amoníaco se utilizó como fertilizante, ya sea como sales, soluciones o anhidro. [72] Cuando se aplica al suelo, ayuda a aumentar el rendimiento de cultivos como el maíz y el trigo . [73] El 30% del nitrógeno agrícola aplicado en los EE. UU. está en forma de amoníaco anhidro y, en todo el mundo, se aplican 110 millones de toneladas cada año. [74] Las soluciones de amoníaco que varían del 16% al 25% se utilizan en la industria de la fermentación como fuente de nitrógeno para microorganismos y para ajustar el pH durante la fermentación. [75]
Debido a las propiedades de vaporización del amoníaco, es un refrigerante útil . [70] Se usaba comúnmente antes de la popularización de los clorofluorocarbonos (freones). El amoníaco anhidro se usa ampliamente en aplicaciones de refrigeración industrial y pistas de hockey debido a su alta eficiencia energética y bajo costo. Sufre la desventaja de la toxicidad y requiere componentes resistentes a la corrosión, lo que restringe su uso doméstico y a pequeña escala. Junto con su uso en la refrigeración moderna por compresión de vapor, se usa en una mezcla junto con hidrógeno y agua en refrigeradores de absorción . El ciclo Kalina , que es de creciente importancia para las plantas de energía geotérmica, depende del amplio rango de ebullición de la mezcla de amoníaco y agua.
El refrigerante de amoníaco también se utiliza en los radiadores a bordo de la Estación Espacial Internacional en circuitos que se utilizan para regular la temperatura interna y permitir experimentos que dependen de la temperatura. [76] [77] El amoníaco está bajo suficiente presión para permanecer líquido durante todo el proceso. Los sistemas de refrigeración de amoníaco monofásicos también sirven a la electrónica de potencia en cada par de paneles solares.
La importancia potencial del amoníaco como refrigerante ha aumentado con el descubrimiento de que los CFC y HFC liberados son gases de efecto invernadero potentes y estables. [78]
Ya en 1895, se sabía que el amoníaco era "fuertemente antiséptico ... se requieren 1,4 gramos por litro para conservar el té de carne (caldo)". [79] En un estudio, el amoníaco anhidro destruyó el 99,999% de las bacterias zoonóticas en tres tipos de alimento para animales , pero no en el ensilado . [80] [81] El amoníaco anhidro se utiliza actualmente comercialmente para reducir o eliminar la contaminación microbiana de la carne de vacuno . [82] [83] La carne de vacuno magra de textura fina (conocida popularmente como " baba rosa ") en la industria de la carne de vacuno se elabora a partir de recortes grasos de carne de vacuno (c. 50-70% de grasa) eliminando la grasa mediante calor y centrifugación , y luego tratándola con amoníaco para matar E. coli . El proceso fue considerado eficaz y seguro por el Departamento de Agricultura de los EE. UU. basándose en un estudio que encontró que el tratamiento reduce E. coli a niveles indetectables. [84] Ha habido preocupaciones sobre la seguridad del proceso, así como quejas de los consumidores sobre el sabor y el olor de la carne tratada con amoníaco. [85]

El amoníaco se ha utilizado como combustible y se ha propuesto como alternativa a los combustibles fósiles y al hidrógeno. Al ser líquido a temperatura ambiente bajo su propia presión de vapor y tener una alta densidad de energía volumétrica y gravimétrica, se considera un transportador adecuado para el hidrógeno [86] y puede ser más económico que el transporte directo de hidrógeno líquido [87] .
En comparación con el hidrógeno, el amoníaco es más fácil de almacenar. En comparación con el hidrógeno como combustible , el amoníaco es mucho más eficiente energéticamente y podría producirse, almacenarse y distribuirse a un costo mucho menor que el hidrógeno, que debe mantenerse comprimido o como líquido criogénico. [88] [89] La densidad energética bruta del amoníaco líquido es de 11,5 MJ/L, [88] que es aproximadamente un tercio de la del diésel .
El amoníaco se puede convertir nuevamente en hidrógeno para ser utilizado en el suministro de energía a las celdas de combustible de hidrógeno, o se puede utilizar directamente en celdas de combustible de amoníaco directo de óxido sólido de alta temperatura para proporcionar fuentes de energía eficientes que no emitan gases de efecto invernadero . [90] [91] La conversión de amoníaco en hidrógeno se puede lograr a través del proceso de amida de sodio [92] o la descomposición catalítica del amoníaco utilizando catalizadores sólidos. [93]

Se han propuesto y utilizado ocasionalmente motores de amoníaco o motores de amoníaco, que utilizan amoníaco como fluido de trabajo . [94] El principio es similar al utilizado en una locomotora sin fuego , pero con amoníaco como fluido de trabajo, en lugar de vapor o aire comprimido. Los motores de amoníaco se utilizaron experimentalmente en el siglo XIX por Goldsworthy Gurney en el Reino Unido y la línea de tranvías de St. Charles Avenue en Nueva Orleans en las décadas de 1870 y 1880, [95] y durante la Segunda Guerra Mundial se utilizó amoníaco para impulsar autobuses en Bélgica . [96]
El amoníaco se propone a veces como una alternativa práctica al combustible fósil para motores de combustión interna . [96] [97] [98] [99] Sin embargo, el amoníaco no se puede utilizar fácilmente en los motores de ciclo Otto existentes debido a su rango de inflamabilidad muy estrecho. A pesar de esto, se han realizado varias pruebas. [100] [101] [102] Su alto índice de octano de 120 [103] y baja temperatura de llama [104] permiten el uso de altas relaciones de compresión sin una penalización de alta producción de NO x . Dado que el amoníaco no contiene carbono, su combustión no puede producir dióxido de carbono , monóxido de carbono , hidrocarburos u hollín .
La producción de amoniaco genera actualmente el 1,8% de las emisiones globales de CO2 . El "amoniaco verde" es el amoniaco producido utilizando hidrógeno verde (hidrógeno producido por electrólisis con electricidad procedente de energía renovable ), mientras que el "amoniaco azul" es el amoniaco producido utilizando hidrógeno azul (hidrógeno producido por reformado de metano con vapor (= SMR) donde el dióxido de carbono ha sido capturado y almacenado (cfr. captura y almacenamiento de carbono = CCS). [105]
Los motores de cohetes también han sido alimentados con amoníaco. El motor de cohete Reaction Motors XLR99 que propulsó el avión de investigación hipersónico X-15 utilizó amoníaco líquido. Aunque no es tan potente como otros combustibles, no deja hollín en el motor de cohete reutilizable y su densidad coincide aproximadamente con la densidad del oxidante, el oxígeno líquido , lo que simplificó el diseño del avión.
En 2020, Arabia Saudita envió 40 toneladas métricas de "amoniaco azul" líquido a Japón para su uso como combustible. [106] Se produjo como subproducto de las industrias petroquímicas y se puede quemar sin emitir gases de efecto invernadero . Su densidad energética por volumen es casi el doble de la del hidrógeno líquido. Si el proceso de creación se puede ampliar a través de recursos puramente renovables, produciendo amoniaco verde, podría marcar una gran diferencia para evitar el cambio climático . [107] La empresa ACWA Power y la ciudad de Neom han anunciado la construcción de una planta de hidrógeno y amoniaco verde en 2020. [108]
El amoniaco verde se considera un combustible potencial para los futuros buques portacontenedores. En 2020, las empresas DSME y MAN Energy Solutions anunciaron la construcción de un buque a base de amoniaco; DSME planea comercializarlo en 2025. [109] También se está explorando el uso del amoniaco como posible combustible alternativo para los motores a reacción de los aviones . [110]
Japón tiene la intención de implementar un plan para desarrollar una tecnología de co-combustión de amoníaco que pueda aumentar el uso de amoníaco en la generación de energía, como parte de los esfuerzos para ayudar a las empresas de servicios públicos nacionales y de otros países asiáticos a acelerar su transición a la neutralidad de carbono . [111] En octubre de 2021, se celebró la primera Conferencia Internacional sobre Amoníaco Combustible (ICFA2021). [112] [113]
En junio de 2022, IHI Corporation logró reducir los gases de efecto invernadero en más del 99% durante la combustión de amoníaco líquido en una turbina de gas de 2000 kilovatios, logrando una generación de energía verdaderamente libre de CO2 . [ 114] En julio de 2022, las naciones del Quad (Japón, EE . UU., Australia e India) acordaron promover el desarrollo tecnológico para el hidrógeno y el amoníaco de combustión limpia como combustibles en la primera reunión de energía del grupo de seguridad. [115] Sin embargo, a partir de 2022 [actualizar], se producen cantidades significativas de NOx. [ 116] El óxido nitroso también puede ser un problema, ya que es un " gas de efecto invernadero que se sabe que posee hasta 300 veces el potencial de calentamiento global (GWP) del dióxido de carbono ". [117]
La AIE prevé que el amoníaco cubrirá aproximadamente el 45% de la demanda de combustible para el transporte marítimo en 2050. [118]
A alta temperatura y en presencia de un catalizador adecuado , el amoníaco se descompone en sus elementos constituyentes. [119] La descomposición del amoníaco es un proceso ligeramente endotérmico que requiere 23 kJ/mol (5,5 kcal/mol ) de amoníaco y produce hidrógeno y nitrógeno gaseoso.
El amoníaco se utiliza para depurar el SO2 de la quema de combustibles fósiles, y el producto resultante se convierte en sulfato de amonio para su uso como fertilizante. El amoníaco neutraliza los contaminantes de óxido de nitrógeno ( NOx ) emitidos por los motores diésel. Esta tecnología, llamada SCR ( reducción catalítica selectiva ), se basa en un catalizador basado en vanadio . [120]
Se puede utilizar amoníaco para mitigar los derrames gaseosos de fosgeno . [121]

El amoníaco, en forma de vapor liberado por las sales aromáticas , ha encontrado un uso significativo como estimulante respiratorio. El amoníaco se utiliza comúnmente en la fabricación ilegal de metanfetamina mediante una reducción de Birch . [123] El método Birch para fabricar metanfetamina es peligroso porque el metal alcalino y el amoníaco líquido son extremadamente reactivos, y la temperatura del amoníaco líquido lo hace susceptible a una ebullición explosiva cuando se agregan reactivos. [124]
El amoníaco líquido se utiliza para el tratamiento de tejidos de algodón, confiriéndoles propiedades como la mercerización , mediante el uso de álcalis. En particular, se utiliza para el prelavado de la lana. [125]
A temperatura y presión estándar, el amoníaco es menos denso que la atmósfera y tiene aproximadamente entre el 45 y el 48 % del poder de sustentación del hidrógeno o el helio . El amoníaco se ha utilizado a veces para llenar globos como gas de sustentación . Debido a su punto de ebullición relativamente alto (en comparación con el helio y el hidrógeno), el amoníaco podría refrigerarse y licuarse a bordo de un dirigible para reducir la sustentación y agregar lastre (y volver a convertirse en gas para agregar sustentación y reducir el lastre). [126]
Se ha utilizado amoníaco para oscurecer el roble blanco aserrado en cuartos en muebles de estilo Arts & Crafts y Mission. Los vapores de amoníaco reaccionan con los taninos naturales de la madera y hacen que cambie de color. [127]

La Administración de Seguridad y Salud Ocupacional de los Estados Unidos (OSHA) ha establecido un límite de exposición de 15 minutos para el amoníaco gaseoso de 35 ppm por volumen en el aire ambiental y un límite de exposición de 8 horas de 25 ppm por volumen. [129] El Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH) redujo recientemente el IDLH (Inmediatamente Peligroso para la Salud o la Vida, el nivel al que un trabajador sano puede estar expuesto durante 30 minutos sin sufrir efectos irreversibles para la salud) de 500 ppm a 300 ppm basándose en interpretaciones recientes más conservadoras de la investigación original de 1943. El límite IDLH de 1 hora sigue siendo de 500 ppm. Otras organizaciones tienen niveles de exposición variables. Las concentraciones máximas permitidas (MAC) de las Normas de la Armada de los Estados Unidos [US Bureau of Ships 1962]: para la exposición continua (60 días) es de 25 ppm; para la exposición de 1 hora es de 400 ppm. [130]
El vapor de amoníaco tiene un olor penetrante, irritante y penetrante que actúa como advertencia de una exposición potencialmente peligrosa. El umbral de olor promedio es de 5 ppm, muy por debajo de cualquier peligro o daño. La exposición a concentraciones muy altas de amoníaco gaseoso puede provocar daño pulmonar y muerte. [129] El amoníaco está regulado en los EE. UU. como un gas no inflamable, pero cumple con la definición de material tóxico por inhalación y requiere un permiso de seguridad peligroso cuando se transporta en cantidades superiores a 3500 galones estadounidenses (13 000 L; 2900 galones imperiales). [131]
El amoníaco líquido es peligroso porque es higroscópico y puede provocar quemaduras cáusticas . Para obtener más información, consulte el apartado Gasero § Efectos sobre la salud de cargas específicas transportadas en gaseros .
La toxicidad de las soluciones de amoníaco no suele causar problemas a los seres humanos ni a otros mamíferos, ya que existe un mecanismo específico para evitar su acumulación en el torrente sanguíneo. El amoníaco se convierte en carbamoil fosfato por la enzima carbamoil fosfato sintetasa , y luego entra en el ciclo de la urea para incorporarse a los aminoácidos o excretarse en la orina. [132] Los peces y los anfibios carecen de este mecanismo, ya que normalmente pueden eliminar el amoníaco de sus cuerpos por excreción directa. El amoníaco incluso en concentraciones diluidas es altamente tóxico para los animales acuáticos, y por esta razón se clasifica como "peligroso para el medio ambiente" . El amoníaco atmosférico desempeña un papel clave en la formación de partículas finas . [133]
El amoniaco es un componente del humo del tabaco . [134]
El amoníaco está presente en las corrientes de aguas residuales de la coquización, como un subproducto líquido de la producción de coque a partir de carbón . [135] En algunos casos, el amoníaco se descarga al medio marino donde actúa como contaminante. La acería Whyalla en Australia del Sur es un ejemplo de una instalación de producción de coque que descarga amoníaco en aguas marinas. [136]
Se cree que la toxicidad del amoníaco es una causa de pérdidas inexplicables en los criaderos de peces . El exceso de amoníaco puede acumularse y provocar alteraciones del metabolismo o aumentos del pH corporal del organismo expuesto. La tolerancia varía entre las especies de peces. [137] En concentraciones más bajas, alrededor de 0,05 mg/L, el amoníaco no ionizado es perjudicial para las especies de peces y puede provocar un crecimiento deficiente y tasas de conversión alimenticia, una fecundidad y fertilidad reducidas y un aumento del estrés y la susceptibilidad a infecciones y enfermedades bacterianas. [138] Expuestos al exceso de amoníaco, los peces pueden sufrir pérdida de equilibrio, hiperexcitabilidad, aumento de la actividad respiratoria y la absorción de oxígeno y aumento de la frecuencia cardíaca. [137] En concentraciones superiores a 2,0 mg/L, el amoníaco provoca daños en las branquias y los tejidos, letargo extremo, convulsiones, coma y muerte. [137] [139] Los experimentos han demostrado que la concentración letal para una variedad de especies de peces varía de 0,2 a 2,0 mg/L. [139]
Durante el invierno, cuando se administran menos alimentos a los peces de acuicultura, los niveles de amoníaco pueden ser más altos. Las temperaturas ambientales más bajas reducen la tasa de fotosíntesis de las algas, por lo que las algas presentes eliminan menos amoníaco. En un entorno de acuicultura, especialmente a gran escala, no existe un remedio de acción rápida para los niveles elevados de amoníaco. Se recomienda la prevención en lugar de la corrección para reducir el daño a los peces de cultivo [139] y, en sistemas de agua abierta, al medio ambiente circundante.
Similar al propano , el amoníaco anhidro hierve por debajo de la temperatura ambiente cuando está a presión atmosférica. Un recipiente de almacenamiento capaz de 250 psi (1,7 MPa ) es adecuado para contener el líquido. [140] El amoníaco se utiliza en numerosas aplicaciones industriales diferentes que requieren recipientes de almacenamiento de acero inoxidable o de carbono. El amoníaco con al menos un 0,2% en peso de contenido de agua no es corrosivo para el acero al carbono. Los tanques de almacenamiento de construcción de acero al carbono NH3 con 0,2% en peso o más de agua podrían durar más de 50 años en servicio. [141] Los expertos advierten que no se debe permitir que los compuestos de amonio entren en contacto con bases (a menos que sea en una reacción intencionada y contenida), ya que podrían liberarse cantidades peligrosas de gas amoníaco.
.jpg/440px-Ammonia_solution_(25-28%).jpg)
Los peligros de las soluciones de amoníaco dependen de la concentración: las soluciones de amoníaco "diluidas" suelen tener una concentración del 5 al 10 % en peso (< 5,62 mol/L); las soluciones "concentradas" suelen prepararse con una concentración >25 % en peso. Una solución al 25 % (en peso) tiene una densidad de 0,907 g/cm 3 , y una solución con una densidad menor estará más concentrada. La clasificación de la Unión Europea de las soluciones de amoníaco se muestra en la tabla.
El vapor de amoniaco de las soluciones concentradas de amoniaco es muy irritante para los ojos y el tracto respiratorio , y los expertos advierten que estas soluciones solo se deben manipular en una campana extractora de humos . Las soluciones saturadas ('0,880' – ver § Propiedades ) pueden desarrollar una presión significativa dentro de una botella cerrada en climas cálidos, y los expertos también advierten que la botella se debe abrir con cuidado. Esto no suele ser un problema para las soluciones al 25% ('0,900').
Los expertos advierten que las soluciones de amoniaco no deben mezclarse con halógenos , ya que se forman productos tóxicos y/o explosivos. Los expertos también advierten que el contacto prolongado de las soluciones de amoniaco con sales de plata , mercurio o yoduro también puede dar lugar a productos explosivos: este tipo de mezclas se forman a menudo en el análisis inorgánico cualitativo y que es necesario acidificarlas ligeramente, pero no concentrarlas (<6% p/v) antes de desecharlas una vez finalizado el ensayo.
El amoníaco anhidro está clasificado como tóxico ( T ) y peligroso para el medio ambiente ( N ). El gas es inflamable ( temperatura de autoignición : 651 °C) y puede formar mezclas explosivas con el aire (16–25%). El límite de exposición permisible (PEL) en los Estados Unidos es de 50 ppm (35 mg/m 3 ), mientras que la concentración IDLH se estima en 300 ppm. La exposición repetida al amoníaco reduce la sensibilidad al olor del gas: normalmente, el olor es detectable en concentraciones inferiores a 50 ppm, pero las personas desensibilizadas pueden no detectarlo incluso en concentraciones de 100 ppm. El amoníaco anhidro corroe las aleaciones que contienen cobre y zinc , lo que hace que los accesorios de latón no sean apropiados para manipular el gas. El amoníaco líquido también puede atacar el caucho y ciertos plásticos.
El amoniaco reacciona violentamente con los halógenos . El triyoduro de nitrógeno , un explosivo primario de alto poder , se forma cuando el amoniaco entra en contacto con el yodo . El amoniaco provoca la polimerización explosiva del óxido de etileno . También forma compuestos explosivos fulminantes con compuestos de oro , plata , mercurio , germanio o telurio , y con estibina . También se han descrito reacciones violentas con acetaldehído , soluciones de hipoclorito , ferricianuro de potasio y peróxidos .
El amoniaco tiene una de las tasas de producción más altas de cualquier sustancia química inorgánica. La producción a veces se expresa en términos de "nitrógeno fijado". Se estimó que la producción mundial fue de 160 millones de toneladas en 2020 (147 toneladas de nitrógeno fijado). [143] China representó el 26,5% de esa cantidad, seguida de Rusia con el 11,0%, Estados Unidos con el 9,5% y la India con el 8,3%. [143]
Antes del inicio de la Primera Guerra Mundial , la mayor parte del amoníaco se obtenía mediante la destilación en seco [144] de desechos vegetales y animales nitrogenados, incluido el estiércol de camello , donde se destilaba mediante la reducción de ácido nitroso y nitritos con hidrógeno; además, se producía mediante la destilación de carbón , y también mediante la descomposición de sales de amonio mediante hidróxidos alcalinos [145] como la cal viva : [21]
Para la síntesis de laboratorio a pequeña escala, se puede calentar urea e hidróxido de calcio o hidróxido de sodio :

El proceso Haber , [146] también llamado proceso Haber-Bosch, es el principal procedimiento industrial para la producción de amoniaco . [147] [148] Convierte el nitrógeno atmosférico (N 2 ) en amoniaco (NH 3 ) mediante una reacción con hidrógeno (H 2 ) utilizando hierro metálico finamente dividido como catalizador:
Esta reacción es ligeramente favorable en términos de entalpía , pero desfavorable en términos de entropía porque cuatro equivalentes de gases reactivos se convierten en dos equivalentes de gas producto. Como resultado, se necesitan altas presiones y temperaturas moderadamente altas para impulsar la reacción .
Los químicos alemanes Fritz Haber y Carl Bosch desarrollaron el proceso en la primera década del siglo XX, y su eficiencia mejorada sobre los métodos existentes como los procesos Birkeland-Eyde y Frank-Caro fue un avance importante en la producción industrial de amoníaco. [149] [150] [151] El proceso Haber se puede combinar con el reformado con vapor para producir amoníaco con solo tres insumos químicos: agua, gas natural y nitrógeno atmosférico. Tanto Haber como Bosch finalmente recibieron el Premio Nobel de Química : Haber en 1918 por la síntesis de amoníaco específicamente, y Bosch en 1931 por contribuciones relacionadas con la química de alta presión .El amoniaco se puede sintetizar electroquímicamente. Los únicos insumos necesarios son fuentes de nitrógeno (potencialmente atmosférico) e hidrógeno (agua), lo que permite su generación en el punto de uso. La disponibilidad de energía renovable crea la posibilidad de una producción con cero emisiones. [152] [153]
El amoniaco verde es el nombre que recibe el amoniaco producido a partir de hidrógeno, que a su vez se produce a partir de fuentes libres de carbono, como la electrólisis del agua. El amoniaco de esta fuente se puede utilizar como combustible líquido sin contribuir en nada al cambio climático global .
Otro modo de síntesis electroquímica implica la formación reductora de nitruro de litio , que puede ser protonado a amoníaco, dada una fuente de protones , que puede ser hidrógeno. En los primeros años del desarrollo de este proceso, se ha utilizado etanol como tal fuente. El primer uso de esta química se informó en 1930, donde se utilizaron soluciones de litio en etanol para producir amoníaco a presiones de hasta 1000 bar. [154] En 1994, Tsuneto et al. utilizaron electrodeposición de litio en tetrahidrofurano para sintetizar amoníaco a presiones más moderadas con una eficiencia faradaica razonable . [155] Estudios posteriores han explorado más a fondo el sistema etanol-tetrahidrofurano para la síntesis electroquímica de amoníaco. [156] [157] Más allá de simplemente mediar la transferencia de protones a la reacción de reducción de nitrógeno, se ha descubierto que el etanol desempeña un papel multifacético, influyendo en las transformaciones de electrolitos y contribuyendo a la formación de la interfase de electrolito sólido, lo que mejora la eficiencia general de la reacción [158] [156]
En 2020, se demostró que un electrodo de difusión de gas independiente del solvente mejora el transporte de nitrógeno al litio reactivo. Se lograron tasas de producción de NH3 de hasta 30 ± 5 nmol/s/cm2 y eficiencias faradaicas de hasta 47,5 ± 4 % a temperatura ambiente y 1 bar de presión. [159]
El etanol se puede reemplazar con una sal de tetraalquilfosfonio . [160] El estudio observó tasas de producción de NH3 de 53 ± 1 nmol/s/ cm2 a 69 ± 1% en experimentos de eficiencia faradaica bajo una presión parcial de hidrógeno de 0,5 bar y nitrógeno de 19,5 bar a temperatura ambiente. [160]
En 2022, se produjo amoníaco mediante un proceso mediado por litio en un electrolizador de flujo continuo, demostrando también que el gas hidrógeno es una fuente de protones. El estudio sintetizó amoníaco con una eficiencia faradaica del 61 ± 1 % a una densidad de corriente de −6 mA/cm 2 a 1 bar y temperatura ambiente. [161]

El amoniaco es esencial para la vida. [163] Por ejemplo, es necesario para la formación de aminoácidos y ácidos nucleicos , componentes básicos de la vida. Sin embargo, el amoniaco es bastante tóxico. Por ello, la naturaleza utiliza transportadores para el amoniaco. Dentro de la célula, el glutamato cumple esta función. En el torrente sanguíneo, la glutamina es una fuente de amoniaco. [164]
La etanolamina, necesaria para las membranas celulares, es el sustrato de la etanolamina amoniaco-liasa , que produce amoniaco: [165]
El amoníaco es tanto un residuo metabólico como un insumo metabólico en toda la biosfera . Es una fuente importante de nitrógeno para los sistemas vivos. Aunque el nitrógeno atmosférico abunda (más del 75%), pocas criaturas vivientes son capaces de utilizar el nitrógeno atmosférico en su forma diatómica , el gas N2 . Por lo tanto, la fijación de nitrógeno es necesaria para la síntesis de aminoácidos, que son los componentes básicos de las proteínas . Algunas plantas dependen del amoníaco y otros desechos nitrogenados incorporados al suelo por la materia en descomposición. Otras, como las legumbres fijadoras de nitrógeno , se benefician de las relaciones simbióticas con las bacterias rizobias que crean amoníaco a partir del nitrógeno atmosférico. [166]
En los seres humanos, la inhalación de amoníaco en altas concentraciones puede ser mortal. La exposición al amoníaco puede causar dolores de cabeza , edemas , deterioro de la memoria, convulsiones y coma , ya que es neurotóxico por naturaleza. [167]
En ciertos organismos, el amoniaco se produce a partir del nitrógeno atmosférico mediante enzimas llamadas nitrogenasas . El proceso global se denomina fijación de nitrógeno . Se han hecho grandes esfuerzos para comprender el mecanismo de la fijación biológica del nitrógeno . El interés científico en este problema está motivado por la estructura inusual del sitio activo de la enzima, que consiste en un conjunto Fe7MoS9 . [168]
El amoníaco también es un producto metabólico de la desaminación de aminoácidos catalizada por enzimas como la glutamato deshidrogenasa 1. La excreción de amoníaco es común en animales acuáticos. En los humanos, se convierte rápidamente en urea (por el hígado ), que es mucho menos tóxica, particularmente menos básica. Esta urea es un componente principal del peso seco de la orina . La mayoría de los reptiles, aves, insectos y caracoles excretan ácido úrico únicamente como desecho nitrogenado.
El amoníaco desempeña un papel en la fisiología animal normal y anormal . Se biosintetiza a través del metabolismo normal de aminoácidos y es tóxico en altas concentraciones. El hígado convierte el amoníaco en urea a través de una serie de reacciones conocidas como el ciclo de la urea . La disfunción hepática, como la que se observa en la cirrosis , puede provocar cantidades elevadas de amoníaco en la sangre ( hiperamonemia ). Del mismo modo, los defectos en las enzimas responsables del ciclo de la urea, como la ornitina transcarbamilasa , provocan hiperamonemia . La hiperamonemia contribuye a la confusión y al coma de la encefalopatía hepática , así como a la enfermedad neurológica común en personas con defectos del ciclo de la urea y acidurias orgánicas . [169]
El amoníaco es importante para el equilibrio ácido/base normal de los animales. Después de la formación de amonio a partir de glutamina , el α-cetoglutarato puede degradarse para producir dos iones de bicarbonato , que luego están disponibles como amortiguadores para los ácidos de la dieta. El amonio se excreta en la orina, lo que da como resultado una pérdida neta de ácido. El amoníaco puede difundirse a través de los túbulos renales , combinarse con un ion de hidrógeno y, de este modo, permitir una mayor excreción de ácido . [170]
Los iones de amonio son un producto de desecho tóxico del metabolismo de los animales . En los peces y los invertebrados acuáticos, se excreta directamente en el agua. En los mamíferos, tiburones y anfibios, se convierte en el ciclo de la urea en urea , que es menos tóxica y se puede almacenar de forma más eficiente. En las aves, los reptiles y los caracoles terrestres, el amonio metabólico se convierte en ácido úrico , que es sólido y, por lo tanto, se puede excretar con una pérdida mínima de agua. [171]

Se ha detectado amoníaco en las atmósferas de los planetas gigantes Júpiter , Saturno , Urano y Neptuno , junto con otros gases como metano , hidrógeno y helio . El interior de Saturno puede incluir cristales de amoníaco congelados. [172] Se encuentra en Deimos y Fobos , las dos lunas de Marte . [ cita requerida ]
El amoníaco se detectó por primera vez en el espacio interestelar en 1968, basándose en emisiones de microondas procedentes de la dirección del núcleo galáctico . [173] Esta fue la primera molécula poliatómica en ser detectada de esta manera. La sensibilidad de la molécula a una amplia gama de excitaciones y la facilidad con la que se puede observar en varias regiones han hecho del amoníaco una de las moléculas más importantes para los estudios de nubes moleculares . [174] La intensidad relativa de las líneas de amoníaco se puede utilizar para medir la temperatura del medio emisor.
Se han detectado las siguientes especies isotópicas de amoniaco: NH 3 , 15 NH 3 , NH 2 D , NHD 2 y ND 3 . La detección de amoniaco triplemente deuterado se consideró una sorpresa ya que el deuterio es relativamente escaso. Se cree que las condiciones de baja temperatura permiten que esta molécula sobreviva y se acumule. [175]
Desde su descubrimiento interestelar, el NH3 ha demostrado ser una herramienta espectroscópica inestimable en el estudio del medio interestelar. Con una gran cantidad de transiciones sensibles a una amplia gama de condiciones de excitación, el NH3 ha sido ampliamente detectado astronómicamente; su detección ha sido reportada en cientos de artículos de revistas. A continuación, se incluye una muestra de artículos de revistas que destacan la variedad de detectores que se han utilizado para identificar el amoníaco.
El estudio del amoníaco interestelar ha sido importante para diversas áreas de investigación en las últimas décadas. Algunas de ellas se describen a continuación y se basan principalmente en el uso del amoníaco como termómetro interestelar.
Se ha medido la abundancia interestelar de amoníaco en diversos entornos. Se ha estimado que la relación [ NH 3 ]/[ H 2 ] varía entre 10 −7 en pequeñas nubes oscuras [176] y 10 −5 en el núcleo denso del complejo de nubes moleculares de Orión . [177] Aunque se han propuesto un total de 18 rutas de producción totales, [178] el principal mecanismo de formación del NH 3 interestelar es la reacción:
La constante de velocidad, k , de esta reacción depende de la temperatura del entorno, con un valor de a 10 K. [179] La constante de velocidad se calculó a partir de la fórmula . Para la reacción de formación primaria, a = 1,05 × 10 −6 y B = −0,47 . Suponiendo unaabundancia de NH + 4 y una abundancia de electrones de 10 −7 típica de las nubes moleculares, la formación se realizará a una velocidad de1,6 × 10 −9 cm −3 s −1 en una nube molecular de densidad total10 5 cm −3 . [180]
Todas las demás reacciones de formación propuestas tienen constantes de velocidad de entre dos y 13 órdenes de magnitud menores, lo que hace que su contribución a la abundancia de amoníaco sea relativamente insignificante. [181] Como ejemplo de la pequeña contribución de otras reacciones de formación, la reacción:
tiene una constante de velocidad de 2,2 × 10 −15 . Suponiendo densidades de H 2 de 10 5 y una relación [ NH 2 ]/[ H 2 ] de 10 −7 , esta reacción avanza a una velocidad de 2,2 × 10 −12 , más de tres órdenes de magnitud más lenta que la reacción primaria anterior.
Algunas de las otras posibles reacciones de formación son:
Se han propuesto 113 reacciones en total que conducen a la destrucción del NH 3 . De ellas, 39 se tabularon en extensas tablas de la química entre compuestos de C, N y O. [182] Una revisión del amoníaco interestelar cita las siguientes reacciones como los principales mecanismos de disociación: [174]
con constantes de velocidad de 4,39×10 −9 [183] y 2,2×10 −9 , [184] respectivamente. Las ecuaciones anteriores ( 1 , 2 ) se ejecutan a una velocidad de 8,8×10 −9 y 4,4×10 −13 , respectivamente. Estos cálculos asumieron las constantes de velocidad y abundancias dadas de [ NH 3 ]/[ H 2 ] = 10 −5 , [ [H 3 ] + ]/[ H 2 ] = 2×10 −5 , [ HCO + ]/[ H 2 ] = 2×10 −9 , y densidades totales de n = 10 5 , típicas de nubes moleculares densas y frías. [185] Claramente, entre estas dos reacciones primarias, la ecuación ( 1 ) es la reacción de destrucción dominante, con una velocidad ≈10.000 veces más rápida que la ecuación ( 2 ). Esto se debe a la abundancia relativamente alta de [H 3 ] + .
Las observaciones de radio de NH3 realizadas con el radiotelescopio Effelsberg de 100 m revelan que la línea de amoníaco está separada en dos componentes: una cresta de fondo y un núcleo no resuelto. El fondo se corresponde bien con las ubicaciones en las que se había detectado CO anteriormente. [186] El telescopio Chilbolton de 25 m en Inglaterra detectó firmas de radio de amoníaco en regiones H II , máseres HNH2O , objetos H–H y otros objetos asociados con la formación de estrellas. Una comparación de los anchos de las líneas de emisión indica que las velocidades turbulentas o sistemáticas no aumentan en los núcleos centrales de las nubes moleculares. [187]
Se observó radiación de microondas del amoníaco en varios objetos galácticos, entre ellos W3(OH), Orión A , W43 , W51 y cinco fuentes en el centro galáctico. La alta tasa de detección indica que se trata de una molécula común en el medio interestelar y que las regiones de alta densidad son comunes en la galaxia. [188]
Las observaciones del VLA de NH 3 en siete regiones con efluentes gaseosos de alta velocidad revelaron condensaciones de menos de 0,1 pc en L1551, S140 y Cepheus A. Se detectaron tres condensaciones individuales en Cepheus A, una de ellas con una forma muy alargada. Pueden desempeñar un papel importante en la creación del efluente bipolar en la región. [189]
El amoníaco extragaláctico se fotografió utilizando el VLA en IC 342. El gas caliente tiene temperaturas superiores a 70 K, lo que se dedujo a partir de las proporciones de las líneas de amoníaco y parece estar estrechamente asociado con las porciones más internas de la barra nuclear observada en CO. [190] El NH3 también fue monitoreado por el VLA hacia una muestra de cuatro regiones HII ultracompactas galácticas: G9.62+0.19, G10.47+0.03, G29.96-0.02 y G31.41+0.31. Con base en los diagnósticos de temperatura y densidad, se concluye que, en general, dichos cúmulos son probablemente los sitios de formación de estrellas masivas en una fase evolutiva temprana antes del desarrollo de una región HII ultracompacta. [191]
Se registró una absorción a 2,97 micrómetros debida al amoníaco sólido en los granos interestelares del objeto Becklin-Neugebauer y probablemente también en NGC 2264-IR. Esta detección ayudó a explicar la forma física de las líneas de absorción de hielo relacionadas con ellas, que hasta entonces no se entendían bien. [192]
Se obtuvo un espectro del disco de Júpiter del Observatorio Aerotransportado Kuiper , que cubre el rango espectral de 100 a 300 cm −1 . El análisis del espectro proporciona información sobre las propiedades medias globales del gas amoniaco y de una neblina de hielo de amoniaco. [193]
Se estudiaron un total de 149 posiciones de nubes oscuras en busca de evidencia de "núcleos densos" utilizando la línea de inversión rotatoria (J,K) = (1,1) de NH 3 . En general, los núcleos no tienen forma esférica, con relaciones de aspecto que varían de 1,1 a 4,4. También se encontró que los núcleos con estrellas tienen líneas más anchas que los núcleos sin estrellas. [194]
Se ha detectado amoníaco en la Nebulosa Draco y en una o posiblemente dos nubes moleculares, que están asociadas con los cirros infrarrojos galácticos de alta latitud . El hallazgo es significativo porque pueden representar los lugares de nacimiento de las estrellas de tipo B de metalicidad de Población I en el halo galáctico que podrían haber surgido en el disco galáctico. [195]
Al equilibrar la emisión estimulada con la emisión espontánea, es posible construir una relación entre la temperatura de excitación y la densidad. Además, dado que los niveles de transición de amoníaco pueden aproximarse mediante un sistema de 2 niveles a bajas temperaturas, este cálculo es bastante simple. Esta premisa se puede aplicar a las nubes oscuras, regiones sospechosas de tener temperaturas extremadamente bajas y posibles sitios para la futura formación de estrellas. Las detecciones de amoníaco en nubes oscuras muestran líneas muy estrechas, lo que indica no solo bajas temperaturas, sino también un bajo nivel de turbulencia en el interior de las nubes. Los cálculos de la relación de líneas proporcionan una medición de la temperatura de las nubes que es independiente de las observaciones previas de CO. Las observaciones de amoníaco fueron consistentes con las mediciones de CO de temperaturas de rotación de ≈10 K. Con esto, se pueden determinar las densidades, y se han calculado que oscilan entre 10 4 y 10 5 cm −3 en las nubes oscuras. El mapeo de NH 3 da tamaños de nubes típicos de 0,1 pc y masas cercanas a 1 masa solar. Estos núcleos fríos y densos son los sitios de la futura formación de estrellas.
Las regiones HII ultracompactas se encuentran entre los mejores indicadores de la formación de estrellas de alta masa. El material denso que rodea las regiones UCHII es probablemente principalmente molecular. Dado que un estudio completo de la formación de estrellas masivas implica necesariamente la nube a partir de la cual se formó la estrella, el amoníaco es una herramienta invaluable para comprender este material molecular circundante. Dado que este material molecular se puede resolver espacialmente, es posible restringir las fuentes de calor/ionización, las temperaturas, las masas y los tamaños de las regiones. Los componentes de velocidad desplazados por Doppler permiten la separación de regiones distintas de gas molecular que pueden rastrear los flujos de salida y los núcleos calientes que se originan a partir de estrellas en formación.
Se ha detectado amoniaco en galaxias externas [196] [197] y, midiendo simultáneamente varias líneas, es posible medir directamente la temperatura del gas en estas galaxias. Las relaciones de las líneas implican que las temperaturas del gas son cálidas (≈50 K) y se originan en nubes densas con tamaños de decenas de pársecs. Esta imagen es consistente con la imagen dentro de nuestra galaxia, la Vía Láctea : núcleos moleculares densos y calientes se forman alrededor de estrellas recién formadas incrustadas en nubes más grandes de material molecular en la escala de varios cientos de pársecs (nubes moleculares gigantes; GMC).