El amoníaco es un compuesto químico inorgánico de nitrógeno e hidrógeno con la fórmula N H 3 . Un hidruro binario estable y el hidruro de nitrato más simple, el amoníaco es un gas incoloro con un olor penetrante distintivo. Biológicamente, es un desecho nitrogenado común y contribuye significativamente a las necesidades nutricionales de los organismos terrestres al servir como precursor de fertilizantes . [13] Alrededor del 70% del amoníaco producido industrialmente se utiliza para fabricar fertilizantes [14] en varias formas y composiciones, como la urea y el fosfato diamónico . El amoníaco en forma pura también se aplica directamente al suelo.
El amoniaco, ya sea directa o indirectamente, también es un componente básico para la síntesis de muchas sustancias químicas.
El amoniaco se encuentra en la naturaleza y se ha detectado en el medio interestelar. En muchos países está clasificado como una sustancia extremadamente peligrosa . [15]
El amoníaco se produce biológicamente en un proceso llamado fijación de nitrógeno , pero se genera aún más industrialmente mediante el proceso Haber . El proceso ayudó a revolucionar la agricultura al proporcionar fertilizantes baratos. La producción industrial mundial de amoníaco en 2021 fue de 235 millones de toneladas. [16] [17] El amoníaco industrial se transporta en vagones cisterna o cilindros. [18]
El NH3 hierve a -33,34 °C (-28,012 °F) a una presión de una atmósfera , pero el líquido a menudo se puede manipular en el laboratorio sin refrigeración externa. El amoníaco doméstico o hidróxido de amonio es una solución de NH3 en agua.
Plinio , en el Libro XXXI de su Historia Natural , se refiere a una sal llamada hammoniacum , llamada así por la proximidad de su fuente al Templo de Júpiter Amón ( griego Ἄμμων Ammon ) en la provincia romana de Cirenaica . [19] Sin embargo, la descripción que Plinio da de la sal no se ajusta a las propiedades del cloruro de amonio . Según el comentario de Herbert Hoover en su traducción al inglés de De re metallica de Georgius Agricola , es probable que haya sido sal marina común. [20] En cualquier caso, esa sal en última instancia dio al amoníaco y a los compuestos de amonio su nombre.
Se han encontrado trazas de amoniaco/amonio en el agua de lluvia. Se han encontrado cloruro de amonio ( sal amoniacal ) y sulfato de amonio en zonas volcánicas. Se han encontrado cristales de bicarbonato de amonio en el guano de la Patagonia . [21]
El amoníaco se encuentra en todo el Sistema Solar en Marte , Júpiter , Saturno , Urano , Neptuno y Plutón , entre otros lugares: en cuerpos más pequeños y helados como Plutón, el amoníaco puede actuar como un anticongelante geológicamente importante, ya que una mezcla de agua y amoníaco puede tener un punto de fusión tan bajo como -100 °C (-148 °F; 173 K) si la concentración de amoníaco es lo suficientemente alta y, por lo tanto, permitir que dichos cuerpos retengan océanos internos y geología activa a una temperatura mucho más baja de lo que sería posible con agua sola. [22] [23] Las sustancias que contienen amoníaco, o aquellas que son similares a él, se denominan amoniacales . [24]
El amoníaco es un gas incoloro con un olor característico acre . Es más ligero que el aire , su densidad es 0,589 veces la del aire . Se licúa fácilmente debido a los fuertes enlaces de hidrógeno entre las moléculas. El amoníaco gaseoso se convierte en un líquido incoloro , que hierve a -33,1 °C (-27,58 °F) y se congela en cristales incoloros [21] a -77,7 °C (-107,86 °F). Hay pocos datos disponibles a temperaturas y presiones muy altas, pero el punto crítico líquido-vapor se produce a 405 K y 11,35 MPa. [25]
La simetría del cristal es cúbica, símbolo de Pearson cP16, grupo espacial P2 1 3 No.198, constante reticular 0,5125 nm . [26]
El amoníaco líquido posee fuertes poderes ionizantes que reflejan su alto ε de 22 a -35 °C (-31 °F). [27] El amoníaco líquido tiene un cambio de entalpía de vaporización estándar muy alto (23,5 kJ/mol ; [28] a modo de comparación, el del agua es de 40,65 kJ/mol, el del metano de 8,19 kJ/mol y el de la fosfina de 14,6 kJ/mol) y se puede transportar en recipientes presurizados o refrigerados; sin embargo, a temperatura y presión estándar, el amoníaco anhidro líquido se vaporizará. [29]
El amoniaco se disuelve fácilmente en agua. En una solución acuosa, se puede expulsar por ebullición. La solución acuosa de amoniaco es básica y puede describirse como amoniaco acuoso o hidróxido de amonio . [30] La concentración máxima de amoniaco en agua (una solución saturada ) tiene una gravedad específica de 0,880 y a menudo se la conoce como "amoniaco .880". [31]
El amoníaco líquido es un disolvente ionizante no acuoso ampliamente estudiado. Su propiedad más destacada es su capacidad para disolver metales alcalinos para formar soluciones altamente coloreadas y eléctricamente conductoras que contienen electrones solvatados . Aparte de estas notables soluciones, gran parte de la química del amoníaco líquido se puede clasificar por analogía con reacciones relacionadas en soluciones acuosas . La comparación de las propiedades físicas del NH 3 con las del agua muestra que el NH 3 tiene el punto de fusión, el punto de ebullición, la densidad, la viscosidad , la constante dieléctrica y la conductividad eléctrica más bajos . Estas diferencias se atribuyen al menos en parte al enlace de hidrógeno más débil en el NH 3. La constante de autodisociación iónica del NH 3 líquido a −50 °C es de aproximadamente 10 −33 .

El amoníaco líquido es un disolvente ionizante, aunque menos que el agua, y disuelve una variedad de compuestos iónicos, incluidos muchos nitratos , nitritos , cianuros , tiocianatos , complejos de ciclopentadienilo metálico y bis(trimetilsilil)amidas metálicas . [32] La mayoría de las sales de amonio son solubles y actúan como ácidos en soluciones de amoníaco líquido. La solubilidad de las sales de haluro aumenta de fluoruro a yoduro . Una solución saturada de nitrato de amonio ( solución de Divers , llamada así por Edward Divers ) contiene 0,83 moles de soluto por mol de amoníaco y tiene una presión de vapor de menos de 1 bar incluso a 25 °C (77 °F). Sin embargo, pocas sales de oxianiones con otros cationes se disuelven. [34]
El amoníaco líquido disolverá todos los metales alcalinos y otros metales electropositivos como Ca , [35] Sr , Ba , Eu e Yb (también Mg mediante un proceso electrolítico [33] ). En concentraciones bajas (<0,06 mol/L), se forman soluciones de color azul intenso: estas contienen cationes metálicos y electrones solvatados , electrones libres que están rodeados por una jaula de moléculas de amoníaco.
Estas soluciones son agentes reductores fuertes. En concentraciones más altas, las soluciones tienen un aspecto metálico y una conductividad eléctrica mejor. A bajas temperaturas, los dos tipos de soluciones pueden coexistir como fases inmiscibles.

El rango de estabilidad termodinámica de las soluciones de amoníaco líquido es muy estrecho, ya que el potencial de oxidación a dinitrógeno, E ° ( N2 +6[NH4 ] ++ 6e − ⇌8NH3 ) , es solo +0,04 V. En la práctica, tanto la oxidación a dinitrógeno como la reducción a dihidrógeno son lentas. Esto es particularmente cierto en el caso de las soluciones reductoras: las soluciones de los metales alcalinos mencionados anteriormente son estables durante varios días y se descomponen lentamente en la amida metálica y el dihidrógeno. La mayoría de los estudios que involucran soluciones de amoníaco líquido se realizan en condiciones reductoras; aunque la oxidación del amoníaco líquido suele ser lenta, aún existe el riesgo de explosión, particularmente si hay iones de metales de transición como posibles catalizadores.
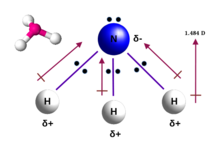

La molécula de amoníaco tiene una forma piramidal trigonal , como lo predice la teoría de repulsión de pares electrónicos de la capa de valencia (teoría VSEPR) con un ángulo de enlace determinado experimentalmente de 106,7°. [36] El átomo de nitrógeno central tiene cinco electrones externos con un electrón adicional de cada átomo de hidrógeno. Esto da un total de ocho electrones, o cuatro pares de electrones que están dispuestos tetraédricamente . Tres de estos pares de electrones se utilizan como pares de enlace, lo que deja un par solitario de electrones. El par solitario se repele con más fuerza que los pares de enlace; por lo tanto, el ángulo de enlace no es 109,5°, como se esperaba para una disposición tetraédrica regular, sino 106,8°. [36] Esta forma le da a la molécula un momento dipolar y la hace polar . La polaridad de la molécula, y especialmente su capacidad para formar enlaces de hidrógeno , hace que el amoníaco sea altamente miscible con agua. El par solitario hace que el amoníaco sea una base , un aceptor de protones. El amoníaco es moderadamente básico; Una solución acuosa de 1,0 M tiene un pH de 11,6 y si a dicha solución se le añade un ácido fuerte hasta que la solución se vuelve neutra ( pH = 7 ), el 99,4% de las moléculas de amoniaco están protonadas . La temperatura y la salinidad también afectan a la proporción de amonio [NH 4 ] + . Este último tiene la forma de un tetraedro regular y es isoelectrónico con el metano .
La molécula de amoniaco sufre fácilmente una inversión de nitrógeno a temperatura ambiente; una analogía útil es la de un paraguas que se da vuelta al revés con un fuerte viento. La barrera de energía para esta inversión es de 24,7 kJ/mol y la frecuencia de resonancia es de 23,79 GHz , que corresponde a una radiación de microondas de una longitud de onda de 1,260 cm. La absorción a esta frecuencia fue el primer espectro de microondas que se observó [37] y se utilizó en el primer máser .
Una de las propiedades más características del amoniaco es su basicidad . Se considera que el amoniaco es una base débil. Se combina con ácidos para formar sales de amonio ; así, con ácido clorhídrico forma cloruro de amonio (sal amoniacal); con ácido nítrico , nitrato de amonio , etc. El gas amoniaco perfectamente seco no se combinará con el gas cloruro de hidrógeno perfectamente seco ; la humedad es necesaria para que se produzca la reacción. [38] [39]
Como experimento de demostración bajo aire con humedad ambiental, se abren botellas de soluciones concentradas de amoníaco y ácido clorhídrico y se produce una nube de cloruro de amonio que parece surgir "de la nada" a medida que se forma el aerosol de sal donde las dos nubes de reactivos que se difunden se encuentran entre las dos botellas.
Las sales producidas por la acción del amoniaco sobre los ácidos se conocen como sales de amonio y todas contienen el ion amonio ( [NH 4 ] + ). [38]
Aunque el amoniaco es bien conocido como una base débil, también puede actuar como un ácido extremadamente débil. Es una sustancia prótica y es capaz de formar amidas (que contienen el ion NH − 2 ). Por ejemplo, el litio se disuelve en amoniaco líquido para dar una solución azul ( electrón solvatado ) de amida de litio :
Al igual que el agua, el amoníaco líquido sufre autoionización molecular para formar sus conjugados ácidos y básicos :
El amoniaco suele funcionar como una base débil , por lo que tiene cierta capacidad amortiguadora . Los cambios en el pH harán que haya más o menos cationes amonio ( NH + 4 ) y aniones amida ( NH − 2 ) presentes en la solución . A presión y temperatura estándar,
El amoníaco no arde fácilmente ni mantiene la combustión , excepto en mezclas estrechas de combustible y aire de 15 a 28 % de amoníaco por volumen en el aire. [40] Cuando se mezcla con oxígeno , arde con una llama de color verde amarillento pálido. La ignición ocurre cuando el cloro pasa al amoníaco, formando nitrógeno y cloruro de hidrógeno ; si el cloro está presente en exceso, también se forma el altamente explosivo tricloruro de nitrógeno ( NCl 3 ).
La combustión del amoniaco para formar nitrógeno y agua es exotérmica :
El cambio de entalpía estándar de la combustión , Δ H ° c , expresado por mol de amoniaco y con condensación del agua formada, es de −382,81 kJ/mol. El dinitrógeno es el producto termodinámico de la combustión : todos los óxidos de nitrógeno son inestables con respecto al N 2 y al O 2 , lo que constituye el principio que subyace al convertidor catalítico . Los óxidos de nitrógeno se pueden formar como productos cinéticos en presencia de catalizadores apropiados , una reacción de gran importancia industrial en la producción de ácido nítrico :
Una reacción posterior conduce al NO 2 :
La combustión de amoníaco en el aire es muy difícil en ausencia de un catalizador (como una gasa de platino o un óxido de cromo (III) caliente ), debido al calor de combustión relativamente bajo, una velocidad de combustión laminar más baja, una temperatura de autoignición alta , un calor de vaporización alto y un rango de inflamabilidad estrecho . Sin embargo, estudios recientes han demostrado que se puede lograr una combustión eficiente y estable de amoníaco utilizando cámaras de combustión de remolino, reavivando así el interés de la investigación en el amoníaco como combustible para la producción de energía térmica. [41] El rango de inflamabilidad del amoníaco en aire seco es de 15,15 a 27,35% y en aire con una humedad relativa del 100% es de 15,95 a 26,55%. [42] [ aclaración necesaria ] Para estudiar la cinética de la combustión del amoníaco, se requiere el conocimiento de un mecanismo de reacción confiable y detallado, pero esto ha sido un desafío para obtener. [43]
El amoníaco es un precursor directo o indirecto de la mayoría de los compuestos nitrogenados manufacturados. Es el precursor del ácido nítrico, que es la fuente de la mayoría de los compuestos aromáticos N-sustituidos.
Las aminas se pueden formar mediante la reacción del amoníaco con haluros de alquilo o, más comúnmente, con alcoholes :
Su reacción de apertura de anillo con óxido de etileno produce etanolamina , dietanolamina y trietanolamina .
Las amidas se pueden preparar mediante la reacción del amoniaco con el ácido carboxílico y sus derivados. Por ejemplo, el amoniaco reacciona con el ácido fórmico (HCOOH) para producir formamida ( HCONH 2 ) cuando se calienta. Los cloruros de acilo son los más reactivos, pero el amoniaco debe estar presente en al menos un exceso del doble para neutralizar el cloruro de hidrógeno formado. Los ésteres y anhídridos también reaccionan con el amoniaco para formar amidas. Las sales de amonio de los ácidos carboxílicos se pueden deshidratar para formar amidas calentándolas a 150–200 °C, siempre que no haya grupos sensibles al calor.
Otros compuestos organonitrógenos incluyen alprazolam , etanolamina , carbamato de etilo y hexametilentetramina .
El ácido nítrico se genera mediante el proceso de Ostwald por oxidación del amoníaco con aire sobre un catalizador de platino a 700–850 °C (1292–1562 °F), ≈9 atm. El óxido nítrico y el dióxido de nitrógeno son intermediarios en esta conversión: [44]
El ácido nítrico se utiliza para la producción de fertilizantes , explosivos y muchos compuestos organonitrógenos.
El hidrógeno del amoniaco es susceptible de ser reemplazado por una gran cantidad de sustituyentes. El gas amoniaco reacciona con el sodio metálico para formar sodamida , NaNH 2 . [38]
Con el cloro se forma monocloramina .
El amoníaco pentavalente se conoce como λ 5 -amina; el pentahidruro de nitrógeno se descompone espontáneamente en amoníaco trivalente (λ 3 -amina) y gas hidrógeno en condiciones normales. Esta sustancia se investigó como posible combustible sólido para cohetes en 1966. [45]
El amoniaco también se utiliza para fabricar los siguientes compuestos:
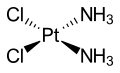
El amoníaco es un ligando que forma complejos de amina metálica . Por razones históricas, el amoníaco se denomina amina en la nomenclatura de compuestos de coordinación . Un complejo de amina notable es el cisplatino ( Pt(NH 3 ) 2 Cl 2 , un fármaco anticancerígeno ampliamente utilizado. Los complejos de amina de cromo (III) formaron la base de la teoría revolucionaria de Alfred Werner sobre la estructura de los compuestos de coordinación. Werner observó que solo se podían formar dos isómeros ( fac - y mer -) del complejo [CrCl 3 (NH 3 ) 3 ] , y concluyó que los ligandos deben estar dispuestos alrededor del ion metálico en los vértices de un octaedro .
El amoníaco forma aductos 1:1 con una variedad de ácidos de Lewis, como I 2 , fenol y Al(CH 3 ) 3 . El amoníaco es una base dura (teoría HSAB) y sus parámetros E y C son E B = 2,31 y C B = 2,04. Su fuerza donante relativa hacia una serie de ácidos, en comparación con otras bases de Lewis, se puede ilustrar mediante gráficos CB .
El amoníaco y las sales de amonio se pueden detectar fácilmente, en trazas muy pequeñas, mediante la adición de la solución de Nessler , que da una coloración amarilla distintiva en presencia de la más mínima traza de amoníaco o sales de amonio. La cantidad de amoníaco en las sales de amonio se puede estimar cuantitativamente mediante la destilación de las sales con sodio (NaOH) o hidróxido de potasio (KOH), absorbiendo el amoníaco desprendido en un volumen conocido de ácido sulfúrico estándar y determinando luego volumétricamente el exceso de ácido ; o el amoníaco se puede absorber en ácido clorhídrico y el cloruro de amonio así formado precipitar como hexacloroplatinato de amonio , [NH 4 ] 2 [PtCl 6 ] . [46]
Las barras de azufre se queman para detectar pequeñas fugas en los sistemas de refrigeración industriales de amoníaco. Se pueden detectar cantidades mayores calentando las sales con un álcali cáustico o con cal viva , cuando el olor característico del amoníaco será inmediatamente evidente. [46] El amoníaco es un irritante y la irritación aumenta con la concentración; el límite de exposición permisible es de 25 ppm y letal por encima de 500 ppm en volumen. [47] Los detectores convencionales apenas detectan concentraciones más altas, el tipo de detector se elige de acuerdo con la sensibilidad requerida (por ejemplo, semiconductor, catalítico, electroquímico). Se han propuesto sensores holográficos para detectar concentraciones de hasta 12,5% en volumen. [48]
En un laboratorio, el amoníaco gaseoso se puede detectar utilizando ácido clorhídrico concentrado o cloruro de hidrógeno gaseoso. De la reacción entre el amoníaco y el HCl(g) surge un humo blanco denso (que es vapor de cloruro de amonio ). [49]
El nitrógeno amoniacal (NH3 - N) es una medida que se utiliza habitualmente para medir la cantidad de iones de amonio , derivados de forma natural del amoniaco y que se devuelven al amoniaco a través de procesos orgánicos, en el agua o en líquidos residuales. Es una medida que se utiliza principalmente para cuantificar valores en sistemas de tratamiento de residuos y de purificación de agua , así como para medir la salud de las reservas de agua naturales y artificiales. Se mide en unidades de mg/L ( miligramo por litro ).


El historiador griego Heródoto mencionó que había afloramientos de sal en una zona de Libia que estaba habitada por un pueblo llamado los 'ammonios' (ahora el oasis de Siwa en el noroeste de Egipto, donde todavía existen lagos salados). [50] [51] El geógrafo griego Estrabón también mencionó la sal de esta región. Sin embargo, los autores antiguos Dioscórides , Apicio , Arriano , Sinesio y Aecio de Amida describieron esta sal como formando cristales transparentes que podían usarse para cocinar y que eran esencialmente sal de roca . [52] Hammoniacus sal aparece en los escritos de Plinio , [53] aunque no se sabe si el término es equivalente al más moderno sal ammoniac (cloruro de amonio). [21] [54] [55]
La fermentación de la orina por las bacterias produce una solución de amoníaco ; por lo tanto, la orina fermentada se utilizaba en la Antigüedad clásica para lavar telas y ropa, para quitar el pelo de las pieles en preparación para el curtido, para servir como mordiente para teñir telas y para eliminar el óxido del hierro. [56] También la utilizaban los dentistas antiguos para lavar los dientes. [57] [58] [59]
En forma de sal amoniacal (نشادر, nushadir ), el amoníaco era importante para los alquimistas musulmanes . Fue mencionado en el Libro de las Piedras , probablemente escrito en el siglo IX y atribuido a Jābir ibn Hayyān . [60] También fue importante para los alquimistas europeos del siglo XIII, siendo mencionado por Alberto Magno . [21] También fue utilizado por los tintoreros en la Edad Media en forma de orina fermentada para alterar el color de los tintes vegetales. En el siglo XV, Basilio Valentín demostró que el amoníaco podía obtenerse mediante la acción de los álcalis sobre la sal amoniacal. [61] En un período posterior, cuando la sal amoniacal se obtenía destilando las pezuñas y los cuernos de los bueyes y neutralizando el carbonato resultante con ácido clorhídrico , se aplicó al amoníaco el nombre de "espíritu de cuerno de ciervo". [21] [62]
El amoníaco gaseoso fue aislado por primera vez por Joseph Black en 1756 al hacer reaccionar sal amónica ( cloruro de amonio ) con magnesia calcinada ( óxido de magnesio ). [63] [64] Fue aislado nuevamente por Peter Woulfe en 1767, [65] [66] por Carl Wilhelm Scheele en 1770 [67] y por Joseph Priestley en 1773 y fue denominado por él "aire alcalino". [21] [68] Once años después, en 1785, Claude Louis Berthollet determinó su composición. [69] [21]
La producción de amoniaco a partir del nitrógeno del aire (y del hidrógeno) fue inventada por Fritz Haber y Robert LeRossignol. La patente fue enviada en 1909 (USPTO Nr 1,202,995) y otorgada en 1916. Más tarde, Carl Bosch desarrolló el método industrial para la producción de amoniaco ( proceso Haber-Bosch ). Se utilizó por primera vez a escala industrial en Alemania durante la Primera Guerra Mundial , [70] tras el bloqueo aliado que cortó el suministro de nitratos desde Chile . El amoniaco se utilizó para producir explosivos para sostener los esfuerzos de guerra. [71] El Premio Nobel de Química de 1918 fue otorgado a Fritz Haber "por la síntesis de amoniaco a partir de sus elementos".
Antes de la disponibilidad del gas natural, el hidrógeno como precursor de la producción de amoníaco se producía mediante la electrólisis del agua o utilizando el proceso cloro-álcali .
Con la llegada de la industria del acero en el siglo XX, el amoníaco se convirtió en un subproducto de la producción de carbón de coque .
En los EE. UU., en 2019 [update], aproximadamente el 88% del amoníaco se utilizó como fertilizante, ya sea como sales, soluciones o anhidro. [72] Cuando se aplica al suelo, ayuda a aumentar el rendimiento de cultivos como el maíz y el trigo . [73] El 30% del nitrógeno agrícola aplicado en los EE. UU. está en forma de amoníaco anhidro y, en todo el mundo, se aplican 110 millones de toneladas cada año. [74] Las soluciones de amoníaco que van del 16% al 25% se utilizan en la industria de la fermentación como fuente de nitrógeno para microorganismos y para ajustar el pH durante la fermentación. [75]
Debido a las propiedades de vaporización del amoníaco, es un refrigerante útil . [70] Se usaba comúnmente antes de la popularización de los clorofluorocarbonos (freones). El amoníaco anhidro se usa ampliamente en aplicaciones de refrigeración industrial y pistas de hockey debido a su alta eficiencia energética y bajo costo. Sufre la desventaja de la toxicidad y requiere componentes resistentes a la corrosión, lo que restringe su uso doméstico y a pequeña escala. Junto con su uso en la refrigeración moderna por compresión de vapor, se usa en una mezcla junto con hidrógeno y agua en refrigeradores de absorción . El ciclo Kalina , que es de creciente importancia para las plantas de energía geotérmica, depende del amplio rango de ebullición de la mezcla de amoníaco y agua.
El refrigerante de amoníaco también se utiliza en los radiadores a bordo de la Estación Espacial Internacional en circuitos que se utilizan para regular la temperatura interna y permitir experimentos que dependen de la temperatura. [76] [77] El amoníaco se encuentra bajo suficiente presión para permanecer líquido durante todo el proceso. Los sistemas de refrigeración de amoníaco monofásicos también sirven a la electrónica de potencia en cada par de paneles solares.
La importancia potencial del amoníaco como refrigerante ha aumentado con el descubrimiento de que los CFC y HFC liberados son gases de efecto invernadero potentes y estables. [78]
Ya en 1895 se sabía que el amoníaco era "fuertemente antiséptico ... se necesitan 1,4 gramos por litro para conservar el té de carne (caldo)". [79] En un estudio, el amoníaco anhidro destruyó el 99,999% de las bacterias zoonóticas en tres tipos de alimento para animales , pero no en el ensilado . [80] [81] Actualmente, el amoníaco anhidro se utiliza comercialmente para reducir o eliminar la contaminación microbiana de la carne de vacuno . [82] [83] La carne de vacuno magra de textura fina (conocida popularmente como " baba rosa ") en la industria de la carne de vacuno se elabora a partir de recortes grasos de carne de vacuno (c. 50-70% de grasa) eliminando la grasa mediante calor y centrifugación , y luego tratándola con amoníaco para matar E. coli . El proceso fue considerado eficaz y seguro por el Departamento de Agricultura de los EE. UU. basándose en un estudio que encontró que el tratamiento reduce E. coli a niveles indetectables. [84] Ha habido preocupaciones sobre la seguridad del proceso, así como quejas de los consumidores sobre el sabor y el olor de la carne tratada con amoníaco. [85]

El amoníaco se ha utilizado como combustible y se ha propuesto como alternativa a los combustibles fósiles y al hidrógeno. Al ser líquido a temperatura ambiente bajo su propia presión de vapor y tener una alta densidad de energía volumétrica y gravimétrica, se considera un transportador adecuado para el hidrógeno [86] y puede ser más económico que el transporte directo de hidrógeno líquido [87] .
En comparación con el hidrógeno, el amoníaco es más fácil de almacenar. En comparación con el hidrógeno como combustible , el amoníaco es mucho más eficiente energéticamente y podría producirse, almacenarse y distribuirse a un costo mucho menor que el hidrógeno, que debe mantenerse comprimido o como líquido criogénico. [88] [89] La densidad energética bruta del amoníaco líquido es de 11,5 MJ/L, [88] que es aproximadamente un tercio de la del diésel .
El amoníaco se puede convertir nuevamente en hidrógeno para ser utilizado en el suministro de energía a las celdas de combustible de hidrógeno, o se puede utilizar directamente en celdas de combustible de amoníaco directo de óxido sólido de alta temperatura para proporcionar fuentes de energía eficientes que no emitan gases de efecto invernadero . [90] [91] La conversión de amoníaco en hidrógeno se puede lograr a través del proceso de amida de sodio [92] o la descomposición catalítica del amoníaco utilizando catalizadores sólidos. [93]

Se han propuesto y utilizado ocasionalmente motores de amoníaco o motores de amoníaco, que utilizan amoníaco como fluido de trabajo . [94] El principio es similar al utilizado en una locomotora sin fuego , pero con amoníaco como fluido de trabajo, en lugar de vapor o aire comprimido. Los motores de amoníaco se utilizaron experimentalmente en el siglo XIX por Goldsworthy Gurney en el Reino Unido y la línea de tranvías de St. Charles Avenue en Nueva Orleans en las décadas de 1870 y 1880, [95] y durante la Segunda Guerra Mundial se utilizó amoníaco para impulsar autobuses en Bélgica . [96]
El amoníaco se propone a veces como una alternativa práctica al combustible fósil para motores de combustión interna . [96] [97] [98] [99] Sin embargo, el amoníaco no se puede utilizar fácilmente en los motores de ciclo Otto existentes debido a su rango de inflamabilidad muy estrecho. A pesar de esto, se han realizado varias pruebas. [100] [101] [102] Su alto índice de octano de 120 [103] y baja temperatura de llama [104] permiten el uso de altas relaciones de compresión sin una penalización de alta producción de NO x . Dado que el amoníaco no contiene carbono, su combustión no puede producir dióxido de carbono , monóxido de carbono , hidrocarburos u hollín .
La producción de amoníaco genera actualmente el 1,8% de las emisiones globales de CO2 . El “amoníaco verde” es el amoníaco producido utilizando hidrógeno verde (hidrógeno producido por electrólisis), mientras que el “amoníaco azul” es el amoníaco producido utilizando hidrógeno azul (hidrógeno producido por reformado de metano con vapor, donde el dióxido de carbono ha sido capturado y almacenado). [105]
Los motores de cohetes también han sido alimentados con amoníaco. El motor de cohete Reaction Motors XLR99 que propulsó el avión de investigación hipersónico X-15 utilizó amoníaco líquido. Aunque no es tan potente como otros combustibles, no deja hollín en el motor de cohete reutilizable y su densidad coincide aproximadamente con la densidad del oxidante, el oxígeno líquido , lo que simplificó el diseño del avión.
En 2020, Arabia Saudita envió 40 toneladas métricas de "amoniaco azul" líquido a Japón para su uso como combustible. [106] Se produjo como subproducto de las industrias petroquímicas y se puede quemar sin emitir gases de efecto invernadero . Su densidad energética por volumen es casi el doble de la del hidrógeno líquido. Si el proceso de creación se puede ampliar a través de recursos puramente renovables, produciendo amoniaco verde, podría marcar una gran diferencia para evitar el cambio climático . [107] La empresa ACWA Power y la ciudad de Neom han anunciado la construcción de una planta de hidrógeno y amoniaco verde en 2020. [108]
El amoniaco verde se considera un combustible potencial para los futuros buques portacontenedores. En 2020, las empresas DSME y MAN Energy Solutions anunciaron la construcción de un buque a base de amoniaco; DSME planea comercializarlo en 2025. [109] También se está explorando el uso del amoniaco como posible combustible alternativo para los motores a reacción de los aviones . [110]
Japón tiene la intención de implementar un plan para desarrollar una tecnología de co-combustión de amoníaco que pueda aumentar el uso de amoníaco en la generación de energía, como parte de los esfuerzos para ayudar a las empresas de servicios públicos nacionales y de otros países asiáticos a acelerar su transición a la neutralidad de carbono . [111] En octubre de 2021, se celebró la primera Conferencia Internacional sobre Amoníaco Combustible (ICFA2021). [112] [113]
En junio de 2022, IHI Corporation logró reducir los gases de efecto invernadero en más del 99% durante la combustión de amoníaco líquido en una turbina de gas de 2000 kilovatios, logrando una generación de energía verdaderamente libre de CO2 . [ 114] En julio de 2022, las naciones del Quad (Japón, EE . UU., Australia e India) acordaron promover el desarrollo tecnológico para el hidrógeno y el amoníaco de combustión limpia como combustibles en la primera reunión de energía del grupo de seguridad. [115] Sin embargo, a partir de 2022 [update], se producen cantidades significativas de NOx. [ 116] El óxido nitroso también puede ser un problema, ya que es un " gas de efecto invernadero que se sabe que posee hasta 300 veces el potencial de calentamiento global (GWP) del dióxido de carbono ". [117]
A alta temperatura y en presencia de un catalizador adecuado , el amoníaco se descompone en sus elementos constituyentes. [118] La descomposición del amoníaco es un proceso ligeramente endotérmico que requiere 23 kJ/mol (5,5 kcal/mol ) de amoníaco y produce hidrógeno y nitrógeno gaseoso.
El amoníaco se utiliza para depurar el SO2 de la quema de combustibles fósiles, y el producto resultante se convierte en sulfato de amonio para su uso como fertilizante. El amoníaco neutraliza los contaminantes de óxido de nitrógeno ( NOx ) emitidos por los motores diésel. Esta tecnología, llamada SCR ( reducción catalítica selectiva ), se basa en un catalizador basado en vanadio . [119]
Se puede utilizar amoníaco para mitigar los derrames gaseosos de fosgeno . [120]

El amoníaco, en forma de vapor liberado por las sales aromáticas , ha encontrado un uso significativo como estimulante respiratorio. El amoníaco se utiliza comúnmente en la fabricación ilegal de metanfetamina mediante una reducción de Birch . [122] El método Birch para fabricar metanfetamina es peligroso porque el metal alcalino y el amoníaco líquido son extremadamente reactivos, y la temperatura del amoníaco líquido lo hace susceptible a una ebullición explosiva cuando se agregan reactivos. [123]
El amoníaco líquido se utiliza para el tratamiento de tejidos de algodón, confiriéndoles propiedades como la mercerización , mediante el uso de álcalis. En particular, se utiliza para el prelavado de la lana. [124]
A temperatura y presión estándar, el amoníaco es menos denso que la atmósfera y tiene aproximadamente entre el 45 y el 48 % del poder de sustentación del hidrógeno o el helio . El amoníaco se ha utilizado a veces para llenar globos como gas de sustentación . Debido a su punto de ebullición relativamente alto (en comparación con el helio y el hidrógeno), el amoníaco podría refrigerarse y licuarse a bordo de un dirigible para reducir la sustentación y agregar lastre (y volver a convertirse en gas para agregar sustentación y reducir el lastre). [125]
Se ha utilizado amoníaco para oscurecer el roble blanco aserrado en cuartos en muebles de estilo Arts & Crafts y Mission. Los vapores de amoníaco reaccionan con los taninos naturales de la madera y hacen que cambie de color. [126]

La Administración de Seguridad y Salud Ocupacional de los Estados Unidos (OSHA) ha establecido un límite de exposición de 15 minutos para el amoníaco gaseoso de 35 ppm por volumen en el aire ambiental y un límite de exposición de 8 horas de 25 ppm por volumen. [128] El Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH) redujo recientemente el IDLH (Inmediatamente Peligroso para la Vida y la Salud, el nivel al que un trabajador sano puede estar expuesto durante 30 minutos sin sufrir efectos irreversibles para la salud) de 500 a 300 basándose en interpretaciones recientes más conservadoras de la investigación original de 1943. Otras organizaciones tienen diferentes niveles de exposición. Estándares de la Marina de los Estados Unidos [US Bureau of Ships 1962] concentraciones máximas permitidas (MAC): para exposición continua (60 días) es 25 ppm; para exposición de 1 hora es 400 ppm. [129]
El vapor de amoníaco tiene un olor penetrante, fuerte e irritante que actúa como advertencia de una exposición potencialmente peligrosa. El umbral de olor promedio es de 5 ppm, muy por debajo de cualquier peligro o daño. La exposición a concentraciones muy altas de amoníaco gaseoso puede provocar daño pulmonar y muerte. [128] El amoníaco está regulado en los EE. UU. como un gas no inflamable, pero cumple con la definición de material tóxico por inhalación y requiere un permiso de seguridad peligroso cuando se transporta en cantidades superiores a 3500 galones estadounidenses (13 000 L; 2900 galones imperiales). [130]
El amoníaco líquido es peligroso porque es higroscópico y puede provocar quemaduras cáusticas . Para obtener más información, consulte el apartado Gasero § Efectos sobre la salud de cargas específicas transportadas en gaseros .
La toxicidad de las soluciones de amoníaco no suele causar problemas a los seres humanos ni a otros mamíferos, ya que existe un mecanismo específico para evitar su acumulación en el torrente sanguíneo. El amoníaco se convierte en carbamoil fosfato por la enzima carbamoil fosfato sintetasa , y luego entra en el ciclo de la urea para incorporarse a los aminoácidos o excretarse en la orina. [131] Los peces y los anfibios carecen de este mecanismo, ya que normalmente pueden eliminar el amoníaco de sus cuerpos por excreción directa. El amoníaco incluso en concentraciones diluidas es altamente tóxico para los animales acuáticos, y por esta razón se clasifica como peligroso para el medio ambiente . El amoníaco atmosférico desempeña un papel clave en la formación de partículas finas . [132]
El amoniaco es un componente del humo del tabaco . [133]
El amoníaco está presente en las corrientes de aguas residuales de la coquización, como un subproducto líquido de la producción de coque a partir de carbón . [134] En algunos casos, el amoníaco se descarga al medio marino donde actúa como contaminante. La acería Whyalla en Australia del Sur es un ejemplo de una instalación de producción de coque que descarga amoníaco en aguas marinas. [135]
Se cree que la toxicidad del amoníaco es una causa de pérdidas inexplicables en los criaderos de peces . El exceso de amoníaco puede acumularse y provocar alteraciones del metabolismo o aumentos del pH corporal del organismo expuesto. La tolerancia varía entre las especies de peces. [136] En concentraciones más bajas, alrededor de 0,05 mg/L, el amoníaco no ionizado es perjudicial para las especies de peces y puede provocar un crecimiento deficiente y tasas de conversión alimenticias, una fecundidad y fertilidad reducidas y un aumento del estrés y la susceptibilidad a infecciones y enfermedades bacterianas. [137] Expuestos al exceso de amoníaco, los peces pueden sufrir pérdida de equilibrio, hiperexcitabilidad, aumento de la actividad respiratoria y la absorción de oxígeno y aumento de la frecuencia cardíaca. [136] En concentraciones superiores a 2,0 mg/L, el amoníaco provoca daños en las branquias y los tejidos, letargo extremo, convulsiones, coma y muerte. [136] [138] Los experimentos han demostrado que la concentración letal para una variedad de especies de peces varía de 0,2 a 2,0 mg/L. [138]
Durante el invierno, cuando se administran menos alimentos a los peces de acuicultura, los niveles de amoníaco pueden ser más altos. Las temperaturas ambientales más bajas reducen la tasa de fotosíntesis de las algas, por lo que las algas presentes eliminan menos amoníaco. En un entorno de acuicultura, especialmente a gran escala, no existe un remedio de acción rápida para los niveles elevados de amoníaco. Se recomienda la prevención en lugar de la corrección para reducir el daño a los peces de cultivo [138] y, en sistemas de agua abierta, al medio ambiente circundante.
Similar al propano , el amoníaco anhidro hierve por debajo de la temperatura ambiente cuando está a presión atmosférica. Un recipiente de almacenamiento capaz de 250 psi (1,7 MPa ) es adecuado para contener el líquido. [139] El amoníaco se utiliza en numerosas aplicaciones industriales diferentes que requieren recipientes de almacenamiento de acero inoxidable o de carbono. El amoníaco con al menos un 0,2% en peso de contenido de agua no es corrosivo para el acero al carbono. Los tanques de almacenamiento de construcción de acero al carbono NH3 con 0,2% en peso o más de agua podrían durar más de 50 años en servicio. [140] Los expertos advierten que no se debe permitir que los compuestos de amonio entren en contacto con bases (a menos que sea en una reacción intencionada y contenida), ya que podrían liberarse cantidades peligrosas de gas amoníaco.
.jpg/440px-Ammonia_solution_(25-28%).jpg)
Los peligros de las soluciones de amoníaco dependen de la concentración: las soluciones de amoníaco "diluidas" suelen tener una concentración del 5 al 10 % en peso (< 5,62 mol/L); las soluciones "concentradas" suelen prepararse con una concentración >25 % en peso. Una solución al 25 % (en peso) tiene una densidad de 0,907 g/cm 3 , y una solución con una densidad menor estará más concentrada. La clasificación de la Unión Europea de las soluciones de amoníaco se muestra en la tabla.
El vapor de amoniaco de las soluciones concentradas de amoniaco es muy irritante para los ojos y el tracto respiratorio , y los expertos advierten que estas soluciones solo se deben manipular en una campana extractora de humos . Las soluciones saturadas ('0,880' – ver § Propiedades ) pueden desarrollar una presión significativa dentro de una botella cerrada en climas cálidos, y los expertos también advierten que la botella se debe abrir con cuidado. Esto no suele ser un problema para las soluciones al 25% ('0,900').
Los expertos advierten que las soluciones de amoniaco no deben mezclarse con halógenos , ya que se forman productos tóxicos y/o explosivos. Los expertos también advierten que el contacto prolongado de las soluciones de amoniaco con sales de plata , mercurio o yoduro también puede dar lugar a productos explosivos: este tipo de mezclas se forman a menudo en el análisis inorgánico cualitativo y que es necesario acidificarlas ligeramente, pero no concentrarlas (<6% p/v) antes de desecharlas una vez finalizado el ensayo.
El amoníaco anhidro está clasificado como tóxico ( T ) y peligroso para el medio ambiente ( N ). El gas es inflamable ( temperatura de autoignición : 651 °C) y puede formar mezclas explosivas con el aire (16-25%). El límite de exposición permisible (PEL) en los Estados Unidos es de 50 ppm (35 mg/m 3 ), mientras que la concentración IDLH se estima en 300 ppm. La exposición repetida al amoníaco reduce la sensibilidad al olor del gas: normalmente, el olor es detectable en concentraciones inferiores a 50 ppm, pero las personas desensibilizadas pueden no detectarlo incluso en concentraciones de 100 ppm. El amoníaco anhidro corroe las aleaciones que contienen cobre y zinc , lo que hace que los accesorios de latón no sean apropiados para manipular el gas. El amoníaco líquido también puede atacar el caucho y ciertos plásticos.
El amoniaco reacciona violentamente con los halógenos . El triyoduro de nitrógeno , un explosivo primario de alto poder , se forma cuando el amoniaco entra en contacto con el yodo . El amoniaco provoca la polimerización explosiva del óxido de etileno . También forma compuestos explosivos fulminantes con compuestos de oro , plata , mercurio , germanio o telurio , y con estibina . También se han descrito reacciones violentas con acetaldehído , soluciones de hipoclorito , ferricianuro de potasio y peróxidos .
El amoniaco tiene una de las tasas de producción más altas de cualquier sustancia química inorgánica. La producción a veces se expresa en términos de "nitrógeno fijado". Se estimó que la producción mundial fue de 160 millones de toneladas en 2020 (147 toneladas de nitrógeno fijado). [142] China representó el 26,5% de esa cantidad, seguida de Rusia con el 11,0%, Estados Unidos con el 9,5% y la India con el 8,3%. [142]
Antes del inicio de la Primera Guerra Mundial , la mayor parte del amoníaco se obtenía mediante la destilación en seco [143] de desechos vegetales y animales nitrogenados, incluido el estiércol de camello , donde se destilaba mediante la reducción de ácido nitroso y nitritos con hidrógeno; además, se producía mediante la destilación de carbón , y también mediante la descomposición de sales de amonio mediante hidróxidos alcalinos [144] como la cal viva : [21]
Para la síntesis de laboratorio a pequeña escala, se puede calentar urea e hidróxido de calcio o hidróxido de sodio :

El proceso Haber , [145] también llamado proceso Haber-Bosch, es el principal procedimiento industrial para la producción de amoniaco . [146] [147] Convierte el nitrógeno atmosférico (N 2 ) en amoniaco (NH 3 ) mediante una reacción con hidrógeno (H 2 ) utilizando un catalizador de metal de hierro finamente dividido :
Esta reacción es ligeramente favorable en términos de entalpía , pero desfavorable en términos de entropía porque cuatro equivalentes de gases reactivos se convierten en dos equivalentes de gas producto. Como resultado, se necesitan altas presiones y temperaturas moderadamente altas para impulsar la reacción .
Los químicos alemanes Fritz Haber y Carl Bosch desarrollaron el proceso en la primera década del siglo XX, y su eficiencia mejorada sobre los métodos existentes como los procesos Birkeland-Eyde y Frank-Caro fue un avance importante en la producción industrial de amoníaco. [148] [149] [150] El proceso Haber se puede combinar con el reformado con vapor para producir amoníaco con solo tres insumos químicos: agua, gas natural y nitrógeno atmosférico. Tanto Haber como Bosch finalmente recibieron el Premio Nobel de Química : Haber en 1918 por la síntesis de amoníaco específicamente, y Bosch en 1931 por contribuciones relacionadas con la química de alta presión .Ammonia can be synthesized electrochemically. The only required inputs are sources of nitrogen (potentially atmospheric) and hydrogen (water), allowing generation at the point of use. The availability of renewable energy creates the possibility of zero emission production.[151][152]
'Green Ammonia' is a name for ammonia produced from hydrogen that is in turn produced from carbon-free sources such as electrolysis of water. Ammonia from this source can be used as a liquid fuel with zero contribution to global climate change.
Another electrochemical synthesis mode involves the reductive formation of lithium nitride, which can be protonated to ammonia, given a proton source, which can be hydrogen. In the early years of the development of this process, ethanol has been used as such a source. The first use of this chemistry was reported in 1930, where lithium solutions in ethanol were used to produce ammonia at pressures of up to 1000 bar.[153] In 1994, Tsuneto et al. used lithium electrodeposition in tetrahydrofuran to synthesize ammonia at more moderate pressures with reasonable Faradaic efficiency.[154] Subsequent studies have further explored the ethanol–tetrahydrofuran system for electrochemical ammonia synthesis.[155][156] Beyond simply mediating proton transfer to the nitrogen reduction reaction, ethanol has been found to play a multifaceted role, influencing electrolyte transformations and contributing to the formation of the solid electrolyte interphase, which enhances overall reaction efficiency[157][155]
In 2020, a solvent-agnostic gas diffusion electrode was shown to improve nitrogen transport to the reactive lithium. NH3 production rates of up to 30 ± 5 nmol/s/cm2 and Faradaic efficiencies of up to 47.5 ± 4% at ambient temperature and 1 bar pressure were achieved.[158]
Ethanol can be replaced with a tetraalkyl phosphonium salt.[159] The study observed NH3 production rates of 53 ± 1 nmol/s/cm2 at 69 ± 1% faradaic efficiency experiments under 0.5-bar hydrogen and 19.5-bar nitrogen partial pressure at ambient temperature.[159]
In 2022, ammonia was produced via the lithium mediated process in a continuous-flow electrolyzer also demonstrating the hydrogen gas as proton source. The study synthesized ammonia at 61 ± 1% Faradaic efficiency at a current density of −6 mA/cm2 at 1 bar and room temperature.[160]

Ammonia is essential for life.[162] For example, it is required for the formation of amino acids and nucleic acids, fundamental building blocks of life. Ammonia is however quite toxic. Nature thus uses carriers for ammonia. Within a cell, glutamate serves this role. In the bloodstream, glutamine is a source of ammonia.[163]
Ethanolamine, required for cell membranes, is the substrate for ethanolamine ammonia-lyase, which produces ammonia:[164]
Ammonia is both a metabolic waste and a metabolic input throughout the biosphere. It is an important source of nitrogen for living systems. Although atmospheric nitrogen abounds (more than 75%), few living creatures are capable of using atmospheric nitrogen in its diatomic form, N2 gas. Therefore, nitrogen fixation is required for the synthesis of amino acids, which are the building blocks of protein. Some plants rely on ammonia and other nitrogenous wastes incorporated into the soil by decaying matter. Others, such as nitrogen-fixing legumes, benefit from symbiotic relationships with rhizobia bacteria that create ammonia from atmospheric nitrogen.[165]
In humans, inhaling ammonia in high concentrations can be fatal. Exposure to ammonia can cause headaches, edema, impaired memory, seizures and coma as it is neurotoxic in nature.[166]
In certain organisms, ammonia is produced from atmospheric nitrogen by enzymes called nitrogenases. The overall process is called nitrogen fixation. Intense effort has been directed toward understanding the mechanism of biological nitrogen fixation. The scientific interest in this problem is motivated by the unusual structure of the active site of the enzyme, which consists of an Fe7MoS9 ensemble.[167]
Ammonia is also a metabolic product of amino acid deamination catalyzed by enzymes such as glutamate dehydrogenase 1. Ammonia excretion is common in aquatic animals. In humans, it is quickly converted to urea (by liver), which is much less toxic, particularly less basic. This urea is a major component of the dry weight of urine. Most reptiles, birds, insects, and snails excrete uric acid solely as nitrogenous waste.
Ammonia plays a role in both normal and abnormal animal physiology. It is biosynthesised through normal amino acid metabolism and is toxic in high concentrations. The liver converts ammonia to urea through a series of reactions known as the urea cycle. Liver dysfunction, such as that seen in cirrhosis, may lead to elevated amounts of ammonia in the blood (hyperammonemia). Likewise, defects in the enzymes responsible for the urea cycle, such as ornithine transcarbamylase, lead to hyperammonemia. Hyperammonemia contributes to the confusion and coma of hepatic encephalopathy, as well as the neurological disease common in people with urea cycle defects and organic acidurias.[168]
Ammonia is important for normal animal acid/base balance. After formation of ammonium from glutamine, α-ketoglutarate may be degraded to produce two bicarbonate ions, which are then available as buffers for dietary acids. Ammonium is excreted in the urine, resulting in net acid loss. Ammonia may itself diffuse across the renal tubules, combine with a hydrogen ion, and thus allow for further acid excretion.[169]
Ammonium ions are a toxic waste product of metabolism in animals. In fish and aquatic invertebrates, it is excreted directly into the water. In mammals, sharks, and amphibians, it is converted in the urea cycle to urea, which is less toxic and can be stored more efficiently. In birds, reptiles, and terrestrial snails, metabolic ammonium is converted into uric acid, which is solid and can therefore be excreted with minimal water loss.[170]

Ammonia has been detected in the atmospheres of the giant planets Jupiter, Saturn, Uranus and Neptune, along with other gases such as methane, hydrogen, and helium. The interior of Saturn may include frozen ammonia crystals.[171] It is found on Deimos and Phobos–the two moons of Mars.[citation needed]
Ammonia was first detected in interstellar space in 1968, based on microwave emissions from the direction of the galactic core.[172] This was the first polyatomic molecule to be so detected. The sensitivity of the molecule to a broad range of excitations and the ease with which it can be observed in a number of regions has made ammonia one of the most important molecules for studies of molecular clouds.[173] The relative intensity of the ammonia lines can be used to measure the temperature of the emitting medium.
The following isotopic species of ammonia have been detected: NH3,15NH3, NH2D, NHD2, and ND3. The detection of triply deuterated ammonia was considered a surprise as deuterium is relatively scarce. It is thought that the low-temperature conditions allow this molecule to survive and accumulate.[174]
Since its interstellar discovery, NH3 has proved to be an invaluable spectroscopic tool in the study of the interstellar medium. With a large number of transitions sensitive to a wide range of excitation conditions, NH3 has been widely astronomically detected–its detection has been reported in hundreds of journal articles. Listed below is a sample of journal articles that highlights the range of detectors that have been used to identify ammonia.
The study of interstellar ammonia has been important to a number of areas of research in the last few decades. Some of these are delineated below and primarily involve using ammonia as an interstellar thermometer.
The interstellar abundance for ammonia has been measured for a variety of environments. The [NH3]/[H2] ratio has been estimated to range from 10−7 in small dark clouds[175] up to 10−5 in the dense core of the Orion molecular cloud complex.[176] Although a total of 18 total production routes have been proposed,[177] the principal formation mechanism for interstellar NH3 is the reaction:
The rate constant, k, of this reaction depends on the temperature of the environment, with a value of at 10 K.[178] The rate constant was calculated from the formula . For the primary formation reaction, a = 1.05×10−6 and B = −0.47. Assuming an NH+4 abundance of and an electron abundance of 10−7 typical of molecular clouds, the formation will proceed at a rate of 1.6×10−9 cm−3s−1 in a molecular cloud of total density 105 cm−3.[179]
All other proposed formation reactions have rate constants of between two and 13 orders of magnitude smaller, making their contribution to the abundance of ammonia relatively insignificant.[180] As an example of the minor contribution other formation reactions play, the reaction:
has a rate constant of 2.2×10−15. Assuming H2 densities of 105 and [NH2]/[H2] ratio of 10−7, this reaction proceeds at a rate of 2.2×10−12, more than three orders of magnitude slower than the primary reaction above.
Some of the other possible formation reactions are:
There are 113 total proposed reactions leading to the destruction of NH3. Of these, 39 were tabulated in extensive tables of the chemistry among C, N and O compounds.[181] A review of interstellar ammonia cites the following reactions as the principal dissociation mechanisms:[173]
with rate constants of 4.39×10−9[182] and 2.2×10−9,[183] respectively. The above equations (1, 2) run at a rate of 8.8×10−9 and 4.4×10−13, respectively. These calculations assumed the given rate constants and abundances of [NH3]/[H2] = 10−5, [[H3]+]/[H2] = 2×10−5, [HCO+]/[H2] = 2×10−9, and total densities of n = 105, typical of cold, dense, molecular clouds.[184] Clearly, between these two primary reactions, equation (1) is the dominant destruction reaction, with a rate ≈10,000 times faster than equation (2). This is due to the relatively high abundance of [H3]+.
Radio observations of NH3 from the Effelsberg 100-m Radio Telescope reveal that the ammonia line is separated into two components–a background ridge and an unresolved core. The background corresponds well with the locations previously detected CO.[185] The 25 m Chilbolton telescope in England detected radio signatures of ammonia in H II regions, HNH2O masers, H–H objects, and other objects associated with star formation. A comparison of emission line widths indicates that turbulent or systematic velocities do not increase in the central cores of molecular clouds.[186]
Microwave radiation from ammonia was observed in several galactic objects including W3(OH), Orion A, W43, W51, and five sources in the galactic centre. The high detection rate indicates that this is a common molecule in the interstellar medium and that high-density regions are common in the galaxy.[187]
VLA observations of NH3 in seven regions with high-velocity gaseous outflows revealed condensations of less than 0.1 pc in L1551, S140, and Cepheus A. Three individual condensations were detected in Cepheus A, one of them with a highly elongated shape. They may play an important role in creating the bipolar outflow in the region.[188]
Extragalactic ammonia was imaged using the VLA in IC 342. The hot gas has temperatures above 70 K, which was inferred from ammonia line ratios and appears to be closely associated with the innermost portions of the nuclear bar seen in CO.[189] NH3 was also monitored by VLA toward a sample of four galactic ultracompact HII regions: G9.62+0.19, G10.47+0.03, G29.96-0.02, and G31.41+0.31. Based upon temperature and density diagnostics, it is concluded that in general such clumps are probably the sites of massive star formation in an early evolutionary phase prior to the development of an ultracompact HII region.[190]
Absorption at 2.97 micrometres due to solid ammonia was recorded from interstellar grains in the Becklin–Neugebauer Object and probably in NGC 2264-IR as well. This detection helped explain the physical shape of previously poorly understood and related ice absorption lines.[191]
A spectrum of the disk of Jupiter was obtained from the Kuiper Airborne Observatory, covering the 100 to 300 cm−1 spectral range. Analysis of the spectrum provides information on global mean properties of ammonia gas and an ammonia ice haze.[192]
A total of 149 dark cloud positions were surveyed for evidence of 'dense cores' by using the (J,K) = (1,1) rotating inversion line of NH3. In general, the cores are not spherically shaped, with aspect ratios ranging from 1.1 to 4.4. It is also found that cores with stars have broader lines than cores without stars.[193]
Ammonia has been detected in the Draco Nebula and in one or possibly two molecular clouds, which are associated with the high-latitude galactic infrared cirrus. The finding is significant because they may represent the birthplaces for the Population I metallicity B-type stars in the galactic halo that could have been borne in the galactic disk.[194]
By balancing and stimulated emission with spontaneous emission, it is possible to construct a relation between excitation temperature and density. Moreover, since the transitional levels of ammonia can be approximated by a 2-level system at low temperatures, this calculation is fairly simple. This premise can be applied to dark clouds, regions suspected of having extremely low temperatures and possible sites for future star formation. Detections of ammonia in dark clouds show very narrow lines – indicative not only of low temperatures, but also of a low level of inner-cloud turbulence. Line ratio calculations provide a measurement of cloud temperature that is independent of previous CO observations. The ammonia observations were consistent with CO measurements of rotation temperatures of ≈10 K. With this, densities can be determined, and have been calculated to range between 104 and 105 cm−3 in dark clouds. Mapping of NH3 gives typical clouds sizes of 0.1 pc and masses near 1 solar mass. These cold, dense cores are the sites of future star formation.
Ultra-compact HII regions are among the best tracers of high-mass star formation. The dense material surrounding UCHII regions is likely primarily molecular. Since a complete study of massive star formation necessarily involves the cloud from which the star formed, ammonia is an invaluable tool in understanding this surrounding molecular material. Since this molecular material can be spatially resolved, it is possible to constrain the heating/ionising sources, temperatures, masses, and sizes of the regions. Doppler-shifted velocity components allow for the separation of distinct regions of molecular gas that can trace outflows and hot cores originating from forming stars.
Ammonia has been detected in external galaxies,[195][196] and by simultaneously measuring several lines, it is possible to directly measure the gas temperature in these galaxies. Line ratios imply that gas temperatures are warm (≈50 K), originating from dense clouds with sizes of tens of parsecs. This picture is consistent with the picture within our Milky Way galaxy – hot dense molecular cores form around newly forming stars embedded in larger clouds of molecular material on the scale of several hundred parsecs (giant molecular clouds; GMCs).