La activación del enlace carbono-carbono se refiere a la ruptura de enlaces carbono-carbono en moléculas orgánicas. Este proceso es una herramienta importante en la síntesis orgánica , ya que permite la formación de nuevos enlaces carbono-carbono y la construcción de moléculas orgánicas complejas. [1] Sin embargo, la activación del enlace C–C es un desafío principalmente por las siguientes razones: (1) la activación del enlace CH es un proceso competitivo de la activación CC, que es tanto energética como cinéticamente más favorable; (2) la accesibilidad del centro del metal de transición a los enlaces C–C es generalmente difícil debido a su naturaleza "oculta"; (3) estabilidad relativamente alta del enlace C–C (90 kcal/mol −1 ). Como resultado, en la etapa temprana, la mayoría de los ejemplos de activación CC son de sistemas de anillos encordados, [2] [3] lo que hace que la activación CC sea más favorable al aumentar la energía del material de partida. Sin embargo, la activación CC de enlaces CC no deformados ha seguido siendo un desafío hasta las últimas dos décadas.
Debido a la dificultad de la activación de CC, se requiere una fuerza impulsora para facilitar la reacción. Una estrategia común es formar complejos metálicos estables. Un ejemplo es el reportado por Milstein y colaboradores, en el cual el enlace C(sp 2 )–C(sp 3 ) de ligandos de bisfosfina fue escindido selectivamente por una serie de metales para producir complejos de pinza estables en condiciones suaves. [4] [5] [6]

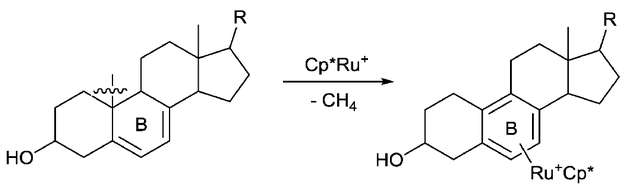
La aromatización es otra fuerza impulsora que se utiliza para la activación del enlace C-C. Por ejemplo, el grupo de Chaudret informó que el enlace C-C de los compuestos esteroides se puede escindir a través de la aromatización del anillo B promovida por Ru. [7] Al mismo tiempo, se libera una molécula de metano, que posiblemente sea otra fuerza impulsora de esta reacción.
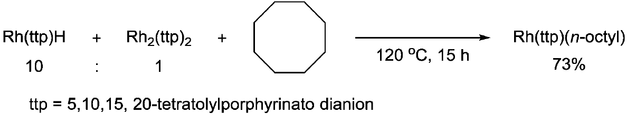
Además, también se ha demostrado que el metalorradical tiene la capacidad de escindir el enlace simple C-C. El grupo Chan informó sobre la escisión del enlace C-C del ciclooctano mediante la adición 1,2 con hidruro de porfirina Rh(III), que involucraba al radical [Rh II (ttp)]· como intermediario clave. [8]
En términos generales, existen dos vías mecanísticas distintas que conducen a la activación del enlace CC: (a) la eliminación del carbono β de los complejos metálicos. En este mecanismo, se forman al mismo tiempo un intermediario M–C y un doble enlace; y (b) la adición oxidativa directa de enlaces C–C en aductos metálicos de baja valencia para formar un complejo bis(organil)metálico.

En 1997, el grupo Tamaru informó sobre la primera eliminación de un carbono β catalizada por un metal de un compuesto no deformado. [9] Su trabajo reveló una nueva apertura de anillo catalizada por Pd(0) de carbonatos cíclicos de 4-vinilo. Propusieron que la reacción se inicia con la eliminación de dióxido de carbono para formar el intermedio π-alilpaladio, que es seguido por β-decarbopaladación para formar dienales y dienonas. Desde entonces, este campo ha florecido y se desarrollaron muchas reacciones similares que mostraron su gran potencial en la síntesis orgánica. La etapa inicial de la investigación en este campo se ha centrado en la reacción de las especies M–O–C–C y la eliminación del carbono β del intermedio M–N–C–C no se descubrió hasta los últimos diez años. En 2010, Nakamura informó sobre una reacción de sustitución catalizada por Cu de aminas propargílicas con alquinos u otras aminas como el primer ejemplo de eliminación de aminas de carbono β catalizada por metales de transición. [10]

En comparación con la eliminación del carbono β, la adición oxidativa del enlace CC es una forma más directa de activación del enlace CC. Sin embargo, es más difícil de hacer por las siguientes razones: 1) Forma dos enlaces MC débiles a expensas de romper un enlace CC estable, por lo que es energéticamente desfavorable; 2) el enlace CC suele estar obstaculizado, lo que hace que sea difícil acercarse al centro metálico. Como resultado, la escisión de compuestos no deformados que se ha logrado se centra principalmente en sustratos de cetona. Esto se debe a que el enlace C–C adyacente al carbonilo de las cetonas es más débil y se puede escindir mucho más fácilmente. También se beneficia del menor impedimento estérico de la estructura plana del motivo carbonílico. Suggs y Jun son pioneros en este campo. Descubrieron que un complejo Rh(I), [RhCl(C 2 H 4 ) 2 ] 2 , puede insertarse oxidativamente en el enlace C–C de las 8-acilquinolinas en la posición 8 para formar rodaciclos de 5 miembros relativamente estables. Posteriormente, la 8-acilquinolina puede acoplarse con etileno para producir 8-quinolinil etilcetona, que representó la primera escisión de enlaces C–C catalizada por un metal de transición mediante adición oxidativa. [11]

Las reacciones de activación de enlaces carbono-carbono tienen numerosas aplicaciones en la síntesis orgánica, la ciencia de los materiales y los productos farmacéuticos. En la síntesis orgánica, estas reacciones se utilizan para construir moléculas complejas de una manera altamente eficiente y selectiva. Por ejemplo, en 2021, el Grupo Dong describió la primera síntesis total enantioselectiva del producto natural penicibilaenos utilizando una estrategia de activación de enlaces carbono-carbono en etapa tardía. [12] También hay muchos otros ejemplos que destacan el potencial de las estrategias de activación de enlaces carbono-carbono en la síntesis total de productos naturales complejos con alto estereocontrol.