La actinina es una proteína de microfilamentos . La proteína funcional es un dímero antiparalelo , que une los filamentos delgados en los sarcómeros adyacentes y, por lo tanto, coordina las contracciones entre los sarcómeros en el eje horizontal. La alfa-actinina es parte de la superfamilia de la espectrina . Esta superfamilia está formada por la espectrina, la distrofina y sus homólogas e isoformas. En las células no musculares, se encuentra junto a los filamentos de actina y en los sitios de adhesión [1] . La disposición en forma de red proporciona estabilidad al aparato contráctil muscular. [1] Específicamente, ayuda a unir los filamentos de actina a la membrana celular. [2] Hay un sitio de unión en cada extremo de la varilla y con haces de filamentos de actina. [1]
Las alfa-actininas no sarcoméricas, codificadas por ACTN1 y ACTN4 , se expresan ampliamente. La expresión de ACTN2 se encuentra tanto en el músculo cardíaco como en el esquelético, mientras que ACTN3 se limita a este último. Ambos extremos del dímero de alfa-actinina en forma de varilla contienen dominios de unión a actina. Se producen seis proteínas diferentes a partir de cuatro genes que codifican alfa-actinina. Estas seis proteínas pueden dividirse a su vez en dos grupos diferentes: isoformas musculares (insensibles al calcio) y citoesqueléticas no musculares (sensibles al calcio). [1]
Existe la creencia de que existe un gen ancestro común similar a la alfa-actinina al observar las características de la alfa-actinina y la espectrina. [3] El examen de las secuencias de repetición de la espectrina proporciona evidencia de un modelo de dos etapas que describe la evolución de la superfamilia de la espectrina. Al observar su ancestro común, la alfa-actinina y la espectrina tienen cuatro repeticiones homólogas. [3] Una duplicación genética resultó en la aparición de un linaje estable que condujo a los genes de alfa-actinina modernos. Simultáneamente, el otro gen duplicado adquirió repeticiones adicionales a través de una serie de eventos de entrecruzamiento desiguales. Esto creó el ancestro de la subunidad de la espectina, que es un homodímero antiparalelo que puede entrecruzar filamentos de actina. [3] La alfa-actinina 1 (ACTN1) se descubrió hace cuarenta años debido a que estaba presente en el aparato contráctil del músculo estriado en grandes cantidades. [4] La alfa-actinina-1 es necesaria para la unión de los miofilamentos de actina a las líneas Z en las células del músculo esquelético , [5] y a los cuerpos densos en las células del músculo liso . [6] La alfa-actinina 2 (ACTN2) se encuentra principalmente en las fibras musculares cardíacas y oxidativas. Parte de la ACTN2 se observa en el cerebro. La alfa-actinina 3 (ACTN3) se encuentra típicamente en las fibras musculares de tipo II, comúnmente conocidas como fibras musculares de contracción rápida. [4]
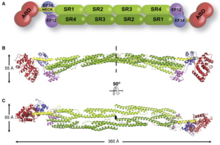
Tiene un extremo N-terminal que tienen todos los miembros de la superfamilia. Este se compone de dos homologías de calponina (CH) consecutivas donde las repeticiones de espectrina vienen justo después. Esto permite que se decida la longitud y la flexibilidad de la proteína de unión a actina. Los enlaces cruzados de filamentos de actina involucran alfa-actinina, que es un dímero antiparalelo funcional. [1] Consiste en un dominio de unión de actina (ABD) conectado a cuatro repeticiones de espectrina que forman la varilla central a través de una región de cuello flexible. Estas repeticiones son repeticiones de 122 aminoácidos. [8] A esto le sigue un dominio similar a calmodulina (CaM) C-terminal que contiene dos motivos de unión de calcio de mano EF. [8] [1] Esto forma el sitio de unión en cada extremo de la proteína que da como resultado una molécula en forma de varilla y con haces de filamentos de actina. [1] La apariencia en forma de varilla se debe a que la región SR tiene una forma cilíndrica. [7] En cada extremo se encuentra el dominio funcional (ABD y CaM). [1] La unión del calcio solo está presente en ACTN1 y ACTN4, mientras que ACTN2 y ACTN3 han perdido la capacidad de unirse al calcio. [9]
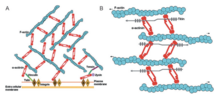
La alfa-actinina y la actina son proteínas altamente conservadas, siendo la alfa-actinina la más conservada en todo el dominio de la familia de proteínas. Esto se debe al ABD que se une a los dominios CH de tipo 1 y tipo 2 (CH1 y CH2). El dominio CH1-CH2 tiene una porción estabilizadora hidrofílica y una parte hidrofóbica. El núcleo de cada dominio CH tiene cuatro hélices (A, C, E y G). Las hélices C y G son paralelas entre sí y la hélice A y E del extremo N las rodea. En humanos, se determinaron las estructuras cristalinas de los ABD de la alfa-actinina 1, 3 y 4. [1] El ABD forma una conformación cerrada. La RMN ha demostrado que hay tres ABD principales. Los tres sitios son el extremo N de la hélice A de CH1, el extremo C de la hélice G de CH1 y el enlazador entre dominios bordeado por el segmento del extremo N del dominio CH2. [1] Estos tienen una alta afinidad por los filamentos de actina. Sin embargo, deben trabajar juntos para tener la mayor afinidad, ya que el CH2 no puede unirse a los filamentos de actina. Dicho esto, el dominio de unión a la actina se encuentra en la región N-terminal de la molécula de alfa-actinina. [8]
La alfa-actinina 3 (ACTN3) es deficiente en alrededor del dieciséis por ciento de los humanos y desempeña un papel importante en el metabolismo muscular. [10] Esta deficiencia se debe a un polimorfismo de codón de terminación prematuro (R577X). [11] El gen R577X estaba más alto en atletas de resistencia que en atletas de velocidad. [12] Entre las cuatro alfa-actininas de mamíferos, ACTN3 se destaca como la más especializada, expresada principalmente en fibras glucolíticas rápidas dentro del músculo esquelético. [11] En humanos que tienen ACTN3, los científicos han visto mejores resultados en el rendimiento de potencia y sprint en atletas y en la población general. [10] Aunque esto se ha encontrado, la selección positiva reciente parece haber influido en el genotipo nulo XX, posiblemente debido a su papel emergente en la regulación del metabolismo muscular, como lo sugiere la evidencia disponible. [10] La falta de ACTN3 da como resultado vías más oxidativas de energía que se utilizan a medida que se reduce la actividad de la glucógeno fosforilasa. Esta falta de ACTN3 no conduce a una causa clara de enfermedad muscular [10] pero se ha observado una alteración en la función muscular. [12]
La alfa-actinina 4 (ACTN4) se expresa en células no musculares. Es importante porque es el vínculo entre dos componentes tumorales. La ACTN4 guía la conexión entre el citoesqueleto de actina dentro de la célula y las integrinas que interactúan directamente con la matriz extracelular del estroma. Además, puede detectar y responder a la fuerza aplicada externamente. [9] Este proceso es crucial para la formación y continuación del cáncer de mama, colorrectal, de ovario y de páncreas. La explicación de por qué la ACTN4 contribuye a la formación del cáncer aún se desconoce. En las células cancerosas del melanoma, la ACTN4 desempeña un papel en la morfología celular. Cambia la célula de una célula de tipo más mesenquimal a una célula de tipo ameboide al reducir el sitio de adhesión focal. [9] El cambio en el sitio de adhesión focal es importante porque los sitios de adhesión focal son críticos para la creación y el ensamblaje de fibras de estrés de actina y los comportamientos migratorios de las células. [9] El cambio de una célula de tipo mesenquimal a una célula de tipo ameboide permite una mayor tasa de invasión a través del colágeno. En las células de tipo mesenquimal, dependen del punto de adhesión focal y de la integrina. Esto permite su invasión a través del colágeno. Las células de tipo ameboide carecen de fibras de estrés y utilizan una contracción mediada por miosina II alta que le permite invadir el mecanismo de formación de vesículas. [9] Este proceso es lo que los científicos están estudiando más a fondo, ya que podría aclarar el aumento significativo de la invasión y la metástasis observado a medida que navegan a través del estroma denso de los tumores. [9] Las mutaciones en ACTN4 pueden causar la enfermedad renal glomeruloesclerosis focal y segmentaria (GEFS). [13]