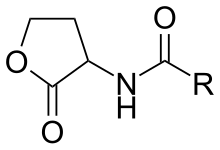
Las N -acil homoserina lactonas (abreviadas como AHL o N-AHL) son una clase de moléculas de señalización involucradas en la detección de quórum bacteriano , un medio de comunicación entre bacterias que permite comportamientos basados en la densidad de población.
La primera AHL (N-3-(oxo-hexanoil)-homoserina lactona) se encontró como el inductor natural de la bioluminiscencia en la bacteria Vibrio fischeri . [1] La detección de quórum por medio de AHL contribuye a regular la transcripción de genes específicos y, por lo tanto, la expresión de fenotipos específicos, incluido el crecimiento, la virulencia , la formación de biopelículas , la bioluminiscencia y la producción de exopolisacáridos (EPS). [2] Más de 50 especies de bacterias gramnegativas (incluidas varias especies patógenas) utilizan AHL como autoinductores y medio de comunicación en la detección de quórum. En un estudio, se demostró que AHL interactúa con células eucariotas y mitiga una respuesta inmune y facilita la infección. [3] Los AHL son uno de los principales grupos de moléculas autoinductoras (AI) que se encuentran principalmente en proteobacterias gramnegativas pero también en algunos bacteriodetes, cianobacterias y arqueas. [4] Los otros dos grupos principales son los oligopéptidos AI en bacterias grampositivas ; y el autoinductor-2 (AI-2), como señal universal para las comunicaciones entre especies. [5]
Surge por la reacción de las proteínas transportadoras de acilo con la S-adenosilmetionina. Esta última dona el equivalente de 4-aminobutirolactona . La metiltioadenosina es un coproducto . [6]
La homoserina lactona también es un producto de la reacción proteolítica del bromuro de cianógeno (CNBr) con un residuo de metionina . Esta reacción es importante para la secuenciación química de las proteínas.
Las AHL tienen secciones hidrofóbicas e hidrofílicas. La sección hidrofílica consiste en el anillo de homoserina lactona y el grupo amida. La sección hidrofóbica tiene una cadena de hidrocarburos específica de la cepa con variedades en longitud y nivel de oxigenación con un grupo 3-oxo. La longitud de la cadena acilo generalmente varía de 4 a 18 carbonos. La longitud de la cadena lateral del grupo R es variable. Las longitudes de cadena varían de 4 a 18 átomos de carbono y en la sustitución de un carbonilo en el tercer carbono. [7] Las secciones hidrofílicas forman una red unida por hidrógeno dentro del sitio de unión del receptor, mientras que los sitios hidrofóbicos contribuyen a las propiedades de difusión y unión dentro del bolsillo hidrofóbico. [8] Los estudios aún no han demostrado una correlación entre las enzimas AHL sintasa y el tipo de AHL. La proteína LuxI sintetiza una molécula de homoserina-lactona acilada. El gen LuxI está altamente conservado, lo que indica que, aunque diverso, hay un número limitado de señales de tipo AHL que son producidas por bacterias. Sin embargo, en la familia de enzimas AHL sintetasa, la región C-terminal, que determina el tipo de sustratos que la sintetasa puede reconocer y la longitud de la cadena acilo subsiguiente, no está conservada. Además, hasta el momento no hay evidencia de que la distribución de la AHL sintetasa y las especies estén correlacionadas. [9] A diferencia de los genes LuxI, los receptores de las AHL, la proteína LuxR y sus genes, son altamente variables entre especies.
La señalización del quórum bacteriano comienza con las N-AHL secretadas al medio ambiente.
En el proceso de detección de quórum, primero la proteína LuxI sintetiza una molécula de homoserina-lactona acilada que puede atravesar la membrana celular siguiendo el gradiente a través de la difusión hacia el espacio ambiental. Cuando la concentración de estos autoinductores en el ambiente es menor que en el interior de la célula, se moverán a favor del gradiente y abandonarán la célula, por lo tanto, no se unirán a su receptor, LuxR, que está en el citoplasma. Cuando la población de bacterias alcanza un umbral, y la concentración de los autoinductores en el ambiente es mayor que en el interior de la célula, se moverán a lo largo del gradiente hacia el interior de la célula y se unirán al receptor. De este modo, se formará el complejo LuxR-AHL. [10] Este complejo se unirá a una sección de 20 pares de bases (pb) de ADN, llamada caja lux . Esta región está en o cerca de la región promotora lux , que se encuentra ~40 pb aguas arriba del gen regulado. Debido a que LuxR está unido al promotor, la ARN polimerasa se recluta a esta región promotora y se induce la expresión génica. [11] Además, el complejo LuxR-AHL regulará positivamente la transcripción de la proteína LuxI, lo que aumentará la producción de AHL (bucle de retroalimentación positiva). La transcripción de los genes diana se regulará y, como resultado, se coordinará la expresión génica de una población entera. [12] Varios estudios han investigado la posible eficacia de las AHL en la infección y la resistencia a los antibióticos. El sistema LuxR-LuxI mediado por AHL es el sistema QS mejor evaluado en especies bacterianas resistentes a múltiples fármacos. [13]
A diferencia del quórum sensing, el quórum quenching impide la comunicación bacteriana e influye en su expresión genética. Los objetivos del quórum quenching son las moléculas señal, la maquinaria biosintética de las moléculas señal y las proteínas reguladoras que perciben estas moléculas señal, siendo la degradación de AHL a través de enzimas degradantes de AHL y la limitación de la acumulación de señales el mecanismo principal. Las AHL son degradadas por enzimas a través de tres mecanismos: hidrólisis de lactona, hidrólisis del enlace amida y modificación de la cadena acilo. La hidrólisis de lactona ocurre cuando la lactonasa AHL hidroliza los anillos de lactona de homoserina. Este proceso se observó por primera vez en especies de Bacillus . Las acilasas AHL catalizan la destrucción completa e irreversible de las AHL a través de la hidrólisis de los enlaces amida. La oxidasa y reductasa AHL, descubiertas por primera vez en Rhodococcus erythropolis, catalizan un cambio en la estructura química de las señales, que afecta el reconocimiento de la señal AHL e interfiere con los procesos regulados por el quórum sensing. La segunda AHLasa es una monooxigenasa P450 de Bacillus megaterium que oxida los ácidos grasos y los aminoácidos N-acilados grasos. Las lactonasas y las acilasas son las dos pioneras de los mecanismos de extinción de quórum. Las lactonasas rompen los enlaces de lactona en los autoinductores, lo que hace que no puedan unirse a los reguladores transcripcionales objetivo y, por lo tanto, aumenta la resistencia a las enfermedades. [14]
Las plantas tienen un papel fundamental en la configuración de nuestro mundo y su relación con los microorganismos es de gran importancia. A lo largo de la larga historia de coevolución de plantas y microbios, las plantas han evolucionado para responder a los microbios simbióticos o patógenos de formas apropiadas con un perfil de expresión genética adaptado, como la cooperación con saprótrofos bacterianos que conducen a una vida endofítica o respuestas de defensa contra patógenos. Los AHL desempeñan un papel importante en la simbiosis de rizobios y legumbres que dará como resultado la formación de nódulos. [15] Los experimentos han informado que la aplicación de AHL activa el promotor GH3 responsable de la auxina (regula positivamente los genes relacionados con la auxina) y regula negativamente los genes relacionados con la citoquinina (el cambio en la relación entre auxina y citoquinina puede promover el crecimiento). [16] Además, después de la aplicación de AHL, se ha mejorado la nodulación en las raíces. [17] Además, el flujo de agua y minerales a través de la planta fue mayor a medida que aumentaba la apertura de los estomas y, por lo tanto, cambió la tasa general de transpiración. [18] Además de las interacciones beneficiosas entre bacterias y plantas mediadas por AHL, se demostró que los compuestos AHL de señalización QS funcionan como una señal de comunicación importante en interacciones simbióticas tripartitas entre bacterias, hongos y plantas. La bacteria endofítica con autoinducción de AHL y produce una variedad de AHL de cadena lateral larga parece ayudar al hongo a interactuar de manera simbiótica con las plantas hospedantes colonizadas. El hongo Serendipita indica, que se aisló de la rizosfera de las plantas, está asociado con la tolerancia al estrés y la promoción del crecimiento de las plantas. Se demostró que este hongo alberga una bacteria endofúngica, Rhizobium radiobacter F4, que tiene genes de autoinducción de AHL. Cuando se inoculó R. radiobacter F4 en Arabidopsis o trigo ( Triticum aestivum ), confirió una estimulación similar del crecimiento y el rendimiento, así como la preparación de las respuestas de defensa y el aumento de la aptitud ambiental. Curiosamente, cuando se agotaron los compuestos AHL, la colonización de las raíces, la promoción del crecimiento y las actividades de inducción de resistencia disminuyeron. Estos hallazgos sugieren que siempre que se aplica el hongo S. indica para apoyar el vigor del crecimiento de diversas plantas, el R. radiobacter productor de AHL endofúngico está colonizando la planta huésped y participa para dirigir la coordinación de la interacción microbio-planta. [19]
Los microbios son un actor clave a cargo del destino del nitrógeno en el suelo y el agua. La detección de quórum mediada por AHL tiene un papel importante en el ciclo del nitrógeno. Todas las bacterias nitrificantes y algunas bacterias desnitrificantes utilizan AHL como sus moléculas de señal. [20] Las AHL influyen en la eficiencia y regulan las funciones involucradas en la nitrificación y la desnitrificación. Algunas especies bacterianas de bacterias oxidantes de amoníaco, como Nitrosomonas europaea, Nitrosospira multiformis, Nitrosospira briensis , utilizan AHL C6 a C14. Las bacterias oxidantes de nitrito (NOB), como Nitrobacter winogradskyi, Nitrobacter vulgaris y Nitrospira moscoviensis, también utilizan AHL C8 o C10 . Candidatus Jettenia caeni con modo de oxidación anaeróbica de amonio (annamox) utiliza AHL C6 y C8. Además, Pseudomonas aeruginosa y Paracoccus denitrificans, como bacterias desnitrificantes, también utilizan C4-HSL y C16-AHL, respectivamente. En algunas de las bacterias nitrificantes y desnitrificantes, como Nitrobacter hamburgensis, no se encontraron AHL, aunque sí se encontraron proteínas receptoras y sintetasa de AHL putativas. [9]