La calcitonina es una hormona peptídica de 32 aminoácidos secretada por las células parafoliculares (también conocidas como células C) de la tiroides (o endostilo ) en humanos y otros cordados [5] en el cuerpo ultimofaríngeo . [6] Actúa para reducir el calcio en sangre (Ca 2+ ), oponiéndose a los efectos de la hormona paratiroidea (PTH). [7]
Su importancia en los humanos no ha sido tan bien establecida como su importancia en otros animales, ya que su función no suele ser significativa en la regulación de la homeostasis normal del calcio . [8] Pertenece a la familia de proteínas similares a la calcitonina .
Históricamente, la calcitonina también se ha denominado tirocalcitonina. [9]
La calcitonina se forma por la escisión proteolítica de un prepéptido más grande , que es el producto del gen CALC1 ( CALCA ). Funcionalmente es un antagonista de la PTH y la vitamina D3. El gen CALC1 pertenece a una superfamilia de precursores de hormonas proteicas relacionadas, que incluyen la proteína precursora amiloide de los islotes , el péptido relacionado con el gen de la calcitonina y el precursor de la adrenomedulina .
La secreción de calcitonina es estimulada por:
La hormona participa en el metabolismo del calcio (Ca 2+ ). De muchas maneras, la calcitonina contrarresta la acción de la hormona paratiroidea (PTH) y la vitamina D .
Más específicamente, la calcitonina reduce los niveles de Ca 2+ en sangre de dos maneras:
Las altas concentraciones de calcitonina pueden aumentar la excreción urinaria de calcio y fosfato a través de los túbulos renales . [15] lo que conduce a una marcada hipocalcemia . Sin embargo, este es un efecto menor sin importancia fisiológica en humanos. También es un efecto de corta duración porque los riñones se vuelven resistentes a la calcitonina, como lo demuestra la excreción intacta de calcio por parte de los riñones en pacientes con tumores tiroideos que secretan calcitonina en exceso. [16]
En sus acciones de conservación del esqueleto, la calcitonina protege contra la pérdida de calcio del esqueleto durante los períodos de movilización de calcio, como el embarazo y, especialmente, la lactancia . Los mecanismos de protección incluyen la inhibición directa de la resorción ósea y el efecto indirecto a través de la inhibición de la liberación de prolactina de la glándula pituitaria. La razón esgrimida es que la prolactina induce la liberación del péptido relacionado con la PTH que mejora la resorción ósea, pero todavía se está investigando. [17] [18] [19]
Otros efectos son la prevención de la hipercalcemia posprandial resultante de la absorción de Ca 2+ . Además, la calcitonina inhibe la ingesta de alimentos en ratas y monos, y puede tener una acción sobre el sistema nervioso central que involucra la regulación de la alimentación y el apetito.
La calcitonina reduce el calcio y el fósforo en sangre principalmente a través de su inhibición de los osteoclastos. Los osteoblastos no tienen receptores de calcitonina y, por lo tanto, no se ven afectados directamente por los niveles de calcitonina. Sin embargo, dado que la resorción ósea y la formación ósea son procesos acoplados, finalmente la inhibición de la actividad osteoclástica por parte de la calcitonina conduce a un aumento de la actividad osteoblástica (como efecto indirecto). [16]
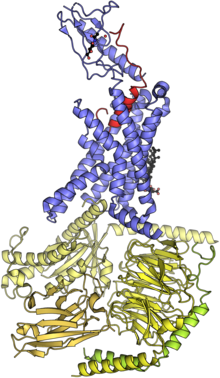
El receptor de calcitonina es un receptor acoplado a la proteína G localizado en los osteoclastos [20] , así como en las células renales y cerebrales. Está acoplado a una subunidad G s α , estimulando así la producción de AMPc por la adenilato ciclasa en las células diana. También puede afectar a los ovarios en las mujeres y a los testículos en los hombres. [ cita requerida ]
La calcitonina fue purificada por primera vez en 1962 por Douglas Harold Copp y B. Cheney en la Universidad de Columbia Británica , Canadá. [21] Inicialmente se pensó que era secretada por la glándula paratiroides , pero Iain Macintyre y su equipo de la Royal Postgraduate Medical School, Londres, demostraron que era secretada por las células parafoliculares de la glándula tiroides . [22] El Dr. Copp nombró calcitonina a la hormona descubierta debido a su papel en "mantener el tono normal del calcio". [21]
El análisis de calcitonina se utiliza para identificar pacientes con enfermedades nodulares de la tiroides . Es útil para hacer un diagnóstico temprano del carcinoma medular de tiroides. Una neoplasia maligna de las células parafoliculares, es decir, el cáncer medular de tiroides (CMT), generalmente produce un nivel elevado de calcitonina sérica. El pronóstico del CMT depende de la detección y el tratamiento tempranos.
La calcitonina también ha tenido un impacto significativo en la biología molecular , ya que el gen que codifica la calcitonina fue el primer gen descubierto en células de mamíferos que se empalma alternativamente , lo que ahora se sabe que es un mecanismo omnipresente en los eucariotas . [23] [24]
La calcitonina se ha utilizado clínicamente para trastornos metabólicos óseos durante más de 50 años. [25] La calcitonina de salmón se utiliza para el tratamiento de:
Se ha investigado como un posible tratamiento no quirúrgico para la estenosis espinal . [31]
La siguiente información procede del Compendio Electrónico de Medicamentos del Reino Unido [32]
La calcitonina de salmón se absorbe y se elimina rápidamente. Las concentraciones plasmáticas máximas se alcanzan en la primera hora tras la administración.
Los estudios realizados en animales han demostrado que la calcitonina se metaboliza principalmente a través de la proteólisis en el riñón tras la administración parenteral. Los metabolitos carecen de la actividad biológica específica de la calcitonina. La biodisponibilidad tras la inyección subcutánea e intramuscular en humanos es alta y similar para las dos vías de administración (71% y 66%, respectivamente).
La calcitonina tiene semividas de absorción y eliminación cortas de 10 a 15 minutos y 50 a 80 minutos, respectivamente. La calcitonina de salmón se degrada principalmente y casi exclusivamente en los riñones, formando fragmentos farmacológicamente inactivos de la molécula. Por lo tanto, el aclaramiento metabólico es mucho menor en pacientes con insuficiencia renal terminal que en sujetos sanos. Sin embargo, se desconoce la relevancia clínica de este hallazgo. La unión a proteínas plasmáticas es del 30% al 40%.
Existe una relación entre la dosis subcutánea de calcitonina y las concentraciones plasmáticas máximas. Tras la administración parenteral de 100 UI de calcitonina, la concentración plasmática máxima se sitúa entre 200 y 400 pg/ml. Los niveles sanguíneos más elevados pueden estar asociados a una mayor incidencia de náuseas, vómitos y diarrea secretora.
Se han realizado estudios convencionales de toxicidad a largo plazo, reproducción, mutagenicidad y carcinogenicidad en animales de laboratorio. La calcitonina de salmón carece de potencial embriotóxico, teratogénico y mutagénico.
Se ha informado de un aumento de la incidencia de adenomas hipofisarios en ratas a las que se les administró calcitonina sintética de salmón durante un año. Esto se considera un efecto específico de la especie y sin relevancia clínica. [33] La calcitonina de salmón no atraviesa la barrera placentaria.
En animales lactantes a los que se les administró calcitonina, se ha observado una supresión de la producción de leche. La calcitonina se secreta en la leche.
La calcitonina se extrae de las glándulas ultimobranquiales (glándulas similares a la tiroides) de los peces, en particular del salmón. La calcitonina del salmón se parece a la calcitonina humana, pero es más activa. En la actualidad, se produce mediante tecnología de ADN recombinante o mediante síntesis química de péptidos . Se ha demostrado que las propiedades farmacológicas de los péptidos sintéticos y recombinantes son cualitativa y cuantitativamente equivalentes. [32]
La calcitonina se puede utilizar terapéuticamente para el tratamiento de la hipercalcemia o la osteoporosis . [34] En un estudio clínico reciente, las inyecciones subcutáneas de calcitonina han reducido la incidencia de fracturas y han reducido la disminución de la masa ósea en mujeres con diabetes tipo 2 complicada con osteoporosis. [35]
Las inyecciones subcutáneas de calcitonina en pacientes con manía dieron como resultado disminuciones significativas en la irritabilidad, euforia e hiperactividad y, por lo tanto, la calcitonina es prometedora para el tratamiento del trastorno bipolar . [36] Sin embargo, no se han informado más trabajos sobre esta posible aplicación de la calcitonina.
Puede utilizarse como marcador tumoral en el diagnóstico del cáncer medular de tiroides , en el que pueden estar presentes niveles elevados de calcitonina y niveles elevados después de la cirugía pueden indicar recurrencia. Incluso puede utilizarse en muestras de biopsia de lesiones sospechosas (p. ej . , ganglios linfáticos inflamados ) para establecer si son metástasis del cáncer original.
Se ha sugerido que los valores de corte de calcitonina para distinguir los casos de cáncer medular de tiroides son los siguientes, donde un valor más alto aumenta la sospecha de cáncer medular de tiroides: [37]
Cuando tenga más de 3 años, se podrán utilizar los puntos de corte para adultos.
Una revisión sistemática Cochrane evaluó la precisión diagnóstica de la calcitonina basal y estimulada para el cáncer de tiroides medular. [38] Aunque tanto la prueba de calcitonina basal como la combinada de calcitonina basal y estimulada presentaron una alta precisión ( sensibilidad : entre 82% y 100%; especificidad : entre 97,2% y 100%), estos resultados tuvieron un alto riesgo de sesgo debido a fallas de diseño de los estudios incluidos. [38] En general, el valor de las pruebas de rutina de calcitonina para el diagnóstico y pronóstico del cáncer de tiroides medular sigue siendo incierto y cuestionable. [38]
También se han descrito niveles elevados de calcitonina en otras afecciones, como la hiperplasia de células C, el carcinoma de células de avena no tiroideo, el carcinoma no tiroideo y otras neoplasias malignas no tiroideas, la lesión renal aguda y la insuficiencia renal crónica , la hipercalcemia , la hipergastrinemia y otros trastornos gastrointestinales, y la enfermedad pulmonar . [39]
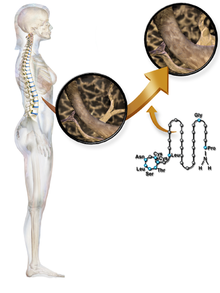
La calcitonina es una hormona polipeptídica de 32 aminoácidos, con un peso molecular de 3454,93 daltons. Su estructura está formada por una única hélice alfa. [40] El empalme alternativo del gen que codifica la calcitonina produce un péptido distante de 37 aminoácidos, llamado péptido relacionado con el gen de la calcitonina (CGRP), tipo beta. [41]
Las siguientes son las secuencias de aminoácidos de la calcitonina del salmón y del ser humano: [ cita requerida ] [42]
Cis-Ser-Asn-Leu-Ser-Thr-Cis-Val-Leu-Gly-Lys-Leu-Ser-Gln-Glu-Leu-His-Lys-Leu-Gln-Thr-Tyr-Pro-Arg-Thr-Asn-Thr-Gly-Ser-Gly-Thr-Pro
Cis-Gli-Asn-Leu-Ser-Thr-Cis-Met-Leu-Gli-Thr-Tyr-Thr-Gln-Asp-Phe-Asn-Lys-Phe-His-Thr-Phe-Pro-Gln-Thr-Ala-Ile-Gli-Val-Gli-Ala-Pro
En comparación con la calcitonina del salmón, la calcitonina humana difiere en 16 residuos.
Además de las formas de dosificación inyectables y en aerosol nasal de la calcitonina de salmón, actualmente se encuentran en desarrollo clínico formulaciones orales no invasivas del péptido. La corta vida media de este péptido en suero desencadenó varios intentos de aumentar las concentraciones plasmáticas. El péptido está complejado con una macromolécula que actúa como potenciador de la absorción a través de la vía transcelular y, además, protege al péptido del pH severo y las condiciones enzimáticas del tracto gastrointestinal. Esta complejación es débil, no covalente y reversible y el fármaco permanece químicamente sin modificar. Después de pasar por el intestino, el agente de administración se disocia del péptido. Una de las formulaciones orales ampliamente estudiadas es la de sales disódicas de calcitonina oral 5-CNAC. Esta novedosa plataforma oral en una serie de ensayos clínicos en diferentes fases ha demostrado un prometedor perfil farmacocinético mejorado, alta biodisponibilidad, seguridad bien establecida y eficacia comparable a la de la calcitonina nasal, especialmente para el tratamiento de la pérdida ósea posmenopáusica. [25]