La estreptavidina / ˌ s t r ɛ p ˈ t æ v ɪ d ɪ n / es una proteína de 52 kDa (tetrámero) purificada de la bacteria Streptomyces avidinii . Los homotetrámeros de estreptavidina tienen una afinidad extraordinariamente alta por la biotina (también conocida como vitamina B7 o vitamina H). Con una constante de disociación (K d ) del orden de ≈10 −14 mol/L, [1] la unión de la biotina a la estreptavidina es una de las interacciones no covalentes más fuertes conocidas en la naturaleza. La estreptavidina se utiliza ampliamente en biología molecular y bionanotecnología debido a la resistencia del complejo estreptavidina-biotina a solventes orgánicos, desnaturalizantes (por ejemplo, cloruro de guanidinio ), detergentes (por ejemplo, SDS , Triton X-100 ), enzimas proteolíticas y extremos de temperatura y pH.
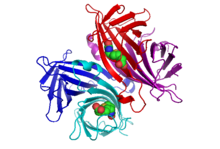
La estructura cristalina de la estreptavidina con biotina unida fue descrita por dos grupos en 1989. La estructura fue resuelta usando difracción anómala de longitud de onda múltiple por Hendrickson et al. [2] en la Universidad de Columbia y usando reemplazo isomorfo múltiple por Weber et al. [3] en el Departamento de Investigación y Desarrollo Central de EI DuPont. A septiembre de 2017, hay 171 estructuras depositadas en el Protein Data Bank . Vea este enlace para una lista completa. Los extremos N y C de la proteína de longitud completa de 159 residuos se procesan para dar una estreptavidina "central" más corta, generalmente compuesta por los residuos 13-139; la eliminación de los extremos N y C es necesaria para la mayor afinidad de unión a la biotina. La estructura secundaria de un monómero de estreptavidina está compuesta por ocho cadenas β antiparalelas, que se pliegan para dar una estructura terciaria de barril β antiparalela . En un extremo de cada barril β se encuentra un sitio de unión de biotina . Cuatro monómeros de estreptavidina idénticos (es decir, cuatro barriles β idénticos) se asocian para dar la estructura cuaternaria tetramérica de la estreptavidina. El sitio de unión de biotina en cada barril está formado por residuos del interior del barril, junto con un Trp120 conservado de una subunidad vecina. De esta manera, cada subunidad contribuye al sitio de unión de la subunidad vecina, por lo que el tetrámero también puede considerarse un dímero de dímeros funcionales.
Las numerosas estructuras cristalinas del complejo estreptavidina-biotina han arrojado luz sobre los orígenes de la notable afinidad. En primer lugar, existe una alta complementariedad de forma entre el bolsillo de unión y la biotina. En segundo lugar, existe una extensa red de enlaces de hidrógeno formados con la biotina cuando está en el sitio de unión. Hay ocho enlaces de hidrógeno hechos directamente con residuos en el sitio de unión (la llamada "primera capa" de enlace de hidrógeno), que involucran los residuos Asn23, Tyr43, Ser27, Ser45, Asn49, Ser88, Thr90 y Asp128. También hay una "segunda capa" de enlace de hidrógeno que involucra residuos que interactúan con los residuos de la primera capa. Sin embargo, la afinidad estreptavidina-biotina excede la que se predeciría a partir de las interacciones de enlace de hidrógeno solo, lo que sugiere otro mecanismo que contribuye a la alta afinidad. [4] El bolsillo de unión de la biotina es hidrófobo y se producen numerosos contactos mediados por la fuerza de van der Waals e interacciones hidrófobas con la biotina cuando se encuentra en el bolsillo, lo que también se cree que explica la alta afinidad. En particular, el bolsillo está revestido con residuos de triptófano conservados. Por último, la unión de la biotina está acompañada por la estabilización de un bucle flexible que conecta las cadenas β 3 y 4 (L3/4), que se cierra sobre la biotina unida, actuando como una "tapa" sobre el bolsillo de unión y contribuyendo a la tasa de disociación extremadamente lenta de la biotina.
La mayoría de los intentos de mutar la estreptavidina dan como resultado una menor afinidad de unión a la biotina, lo que es de esperar en un sistema tan optimizado. Sin embargo, se descubrió que un mutante de estreptavidina diseñado recientemente, llamado traptavidina, tenía una disociación de la biotina más de diez veces más lenta, además de una mayor estabilidad térmica y mecánica. [5] Esta menor tasa de disociación estuvo acompañada por una disminución del doble de la tasa de asociación.
La afinidad de unión de la biotina puede verse afectada por el etiquetado químico de la estreptavidina, como con fluoróforos reactivos a las aminas ; la flavidina es un mutante de estreptavidina sin cadenas laterales de lisina, que conserva buenas características de unión a la biotina después de dicho etiquetado con colorante fluorescente donde el colorante se acopla al extremo amino. [6]
Entre los usos más comunes de la estreptavidina se encuentran la purificación o detección de diversas biomoléculas. La fuerte interacción estreptavidina-biotina se puede utilizar para unir diversas biomoléculas entre sí o sobre un soporte sólido. Se necesitan condiciones duras para romper la interacción estreptavidina-biotina, que a menudo desnaturaliza la proteína de interés que se está purificando. Sin embargo, se ha demostrado que una incubación corta en agua por encima de 70 °C romperá reversiblemente la interacción (al menos para el ADN biotinilado) sin desnaturalizar la estreptavidina, lo que permite la reutilización del soporte sólido de estreptavidina. [7] Otra aplicación de la estreptavidina es la purificación y detección de proteínas modificadas genéticamente con el péptido Strep-tag . La estreptavidina se utiliza ampliamente en Western blotting e inmunoensayos conjugada con alguna molécula reportera, como la peroxidasa de rábano picante . La estreptavidina también se ha utilizado en el campo en desarrollo de la nanobiotecnología , el uso de moléculas biológicas como proteínas o lípidos para crear dispositivos/estructuras a nanoescala . En este contexto, la estreptavidina se puede utilizar como un bloque de construcción para unir moléculas de ADN biotinilado para crear andamios de nanotubos de carbono de pared simple [8] o incluso poliedros de ADN complejos. [9] La estreptavidina tetramérica también se ha utilizado como un centro alrededor del cual se pueden organizar otras proteínas, ya sea por una etiqueta de afinidad como Strep-tag o AviTag o por fusión genética a SpyTag . [10] La fusión a SpyTag permitió la generación de ensamblajes con 8 o 20 subunidades de estreptavidina. Además de una sonda de fuerza molecular para estudios de microscopía de fuerza atómica , [11] también se han creado materiales novedosos como redes cristalinas 3D [12] . La estreptavidina tiene un punto isoeléctrico (pI) ligeramente ácido de ~5, pero también está disponible comercialmente una forma recombinante de estreptavidina con un pI casi neutro.
La inmunoterapia dirigida previamente utiliza estreptavidina conjugada con un anticuerpo monoclonal contra antígenos específicos de células cancerosas, seguida de una inyección de biotina radiomarcada para administrar la radiación solo a la célula cancerosa. Los obstáculos iniciales incluyen la saturación de los sitios de unión de la biotina en la estreptavidina con biotina endógena en lugar de la biotina radiomarcada inyectada, y un alto grado de exposición radiactiva en los riñones debido a las fuertes propiedades de adsorción celular de la estreptavidina. Actualmente se cree que este alto nivel de unión a tipos de células adherentes, como plaquetas activadas y melanomas, es el resultado de la unión de integrinas mediada a través de la secuencia RYD en la estreptavidina. [13]

La estreptavidina es un tetrámero y cada subunidad se une a la biotina con igual afinidad. La multivalencia es una ventaja en aplicaciones como la tinción de tetrámeros MHC , donde los efectos de avidez mejoran la capacidad de las moléculas MHC unidas a la estreptavidina para detectar células T específicas. [14] En otros casos, como el uso de estreptavidina para obtener imágenes de proteínas específicas en células, la multivalencia puede perturbar la función de la proteína de interés. La estreptavidina monovalente es una forma recombinante diseñada de estreptavidina que es un tetrámero pero solo uno de los cuatro sitios de unión es funcional. Este único sitio de unión tiene una afinidad de 10 −14 mol/L y no puede causar reticulación. [15] Las aplicaciones de la estreptavidina monovalente han incluido el seguimiento fluorescente de los receptores de la superficie celular , la decoración de origami de ADN y la actuación como puntero para identificar regiones específicas para la microscopía crioelectrónica .
La estreptavidina monomérica es una forma recombinante de estreptavidina con mutaciones para romper el tetrámero en un monómero y mejorar la solubilidad de la subunidad aislada resultante. Las versiones monoméricas de estreptavidina tienen una afinidad por la biotina de 10 −7 mol/L 10 −8 mol/L y, por lo tanto, no son ideales para aplicaciones de etiquetado, pero son útiles para la purificación, donde la reversibilidad es deseable. [16] [17]

Se puede producir una estreptavidina con exactamente dos sitios de unión de biotina por tetrámero mezclando subunidades con y sin un sitio de unión de biotina funcional y purificando mediante cromatografía de intercambio iónico . Los sitios de unión funcionales tienen la misma estabilidad de unión de biotina que la estreptavidina de tipo salvaje. La estreptavidina divalente con los dos sitios de unión de biotina juntos (cis-divalente) o separados (trans-divalente) se puede purificar por separado. [18]
También se puede producir una estreptavidina con exactamente tres sitios de unión de biotina por tetrámero utilizando el mismo principio que para producir estreptavidinas divalentes. [19]
Se han obtenido estreptavidinas de mayor valencia utilizando la química de la conjugación de enlaces isopeptídicos utilizando la tecnología SpyTag/SpyCatcher . [20] Esto implica tener un tetrámero de estreptavidina con tres sitios de unión de biotina y una estreptavidina muerta fusionada a SpyTag o SpyCatcher. Cuando los diferentes tetrámeros se mezclan, se produce un enlace covalente que permite un mayor número de sitios de unión de biotina. Con este método se han creado seis y doce sitios de unión de biotina por molécula.
La estreptavidina no es la única proteína capaz de unirse a la biotina con alta afinidad. La avidina es la otra proteína de unión a la biotina más notable. Originalmente aislada de la yema de huevo, la avidina solo tiene un 30% de identidad de secuencia con la estreptavidina, pero una estructura secundaria, terciaria y cuaternaria casi idéntica. La avidina tiene una mayor afinidad por la biotina ( K d ~ 10 −15 M) pero, a diferencia de la estreptavidina, la avidina está glicosilada, cargada positivamente, tiene actividad pseudocatalítica (la avidina puede mejorar la hidrólisis alcalina de un enlace éster entre la biotina y un grupo nitrofenilo) y tiene una mayor tendencia a la agregación. Por otro lado, la estreptavidina es el mejor aglutinante de conjugados de biotina; la avidina tiene una afinidad de unión menor que la estreptavidina cuando la biotina está conjugada con otra molécula, a pesar de que la avidina tiene una mayor afinidad por la biotina libre, no conjugada. Debido a que la estreptavidina carece de cualquier modificación de carbohidratos y tiene un pI casi neutro , tiene la ventaja de una unión no específica mucho menor que la avidina. La avidina desglicosilada (NeutrAvidin) es más comparable en tamaño, pI y unión no específica a la estreptavidina.
Grupos que investigan y desarrollan estreptavidina o proteínas de la familia de la avidina (orden alfabético)