La hemorreología , también escrita haemorreología ( haemo del griego 'αἷμα, haima ' sangre '; y reología , del griego ῥέω rhéō , ' flujo ' y -λoγία, -logia 'estudio de'), o reología de la sangre , es el estudio de las propiedades de flujo de la sangre y sus elementos de plasma y células . La perfusión tisular adecuada puede ocurrir solo cuando las propiedades reológicas de la sangre están dentro de ciertos niveles. Las alteraciones de estas propiedades juegan un papel importante en los procesos patológicos. [1] La viscosidad sanguínea está determinada por la viscosidad plasmática, el hematocrito (fracción de volumen de los glóbulos rojos, que constituyen el 99,9% de los elementos celulares) y las propiedades mecánicas de los glóbulos rojos . Los glóbulos rojos tienen un comportamiento mecánico único, que puede discutirse bajo los términos de deformabilidad de los eritrocitos y agregación de los eritrocitos . [2] Debido a eso, la sangre se comporta como un fluido no newtoniano . Como tal, la viscosidad de la sangre varía con la velocidad de corte . La sangre se vuelve menos viscosa a altas velocidades de corte como las experimentadas con un mayor flujo, como durante el ejercicio o en la sístole máxima . Por lo tanto, la sangre es un fluido pseudoplástico . Por el contrario, la viscosidad de la sangre aumenta cuando la velocidad de corte disminuye con el aumento de los diámetros de los vasos o con un flujo bajo, como después de una obstrucción o en diástole . La viscosidad de la sangre también aumenta con el aumento de la agregabilidad de los glóbulos rojos.
La viscosidad sanguínea es una medida de la resistencia de la sangre al flujo. También puede describirse como el espesor y la viscosidad de la sangre. Esta propiedad biofísica la convierte en un determinante crítico de la fricción contra las paredes de los vasos , la tasa de retorno venoso , el trabajo que necesita el corazón para bombear sangre y la cantidad de oxígeno que se transporta a los tejidos y órganos. Estas funciones del sistema cardiovascular están directamente relacionadas con la resistencia vascular , la precarga , la poscarga y la perfusión , respectivamente. [ cita requerida ]
Los determinantes primarios de la viscosidad sanguínea son el hematocrito , la deformabilidad de los glóbulos rojos , la agregación de los glóbulos rojos y la viscosidad plasmática . La viscosidad del plasma está determinada por el contenido de agua y los componentes macromoleculares , por lo que estos factores que afectan la viscosidad sanguínea son la concentración de proteínas plasmáticas y los tipos de proteínas en el plasma. [3] Sin embargo, el hematocrito tiene el impacto más fuerte en la viscosidad de la sangre total. Un aumento de una unidad en el hematocrito puede causar hasta un 4% de aumento en la viscosidad sanguínea. [2] Esta relación se vuelve cada vez más sensible a medida que aumenta el hematocrito. Cuando el hematocrito aumenta al 60 o 70%, lo que a menudo ocurre en la policitemia , [4] la viscosidad sanguínea puede llegar a ser tan grande como 10 veces la del agua, y su flujo a través de los vasos sanguíneos se retrasa en gran medida debido a una mayor resistencia al flujo. [5] Esto conducirá a una disminución del suministro de oxígeno . [6] Otros factores que influyen en la viscosidad sanguínea incluyen la temperatura , donde un aumento de la temperatura da como resultado una disminución de la viscosidad. Esto es particularmente importante en caso de hipotermia , donde un aumento en la viscosidad de la sangre causará problemas con la circulación sanguínea.
Muchos factores de riesgo cardiovascular convencionales se han relacionado de forma independiente con la viscosidad de la sangre total.
La anemia puede reducir la viscosidad sanguínea, lo que puede provocar insuficiencia cardíaca . [7] Además, la elevación de la viscosidad plasmática se correlaciona con la progresión de las enfermedades coronarias y arteriales periféricas . [3] [4]
En pascales - segundos (Pa·s), la viscosidad de la sangre a 37 °C es normalmente de 3 × 10 −3 a 4 × 10 −3 , [8] respectivamente 3 - 4 centi poise (cP) en el sistema de unidades centímetro gramo segundo .
,
donde es la densidad. La viscosidad sanguínea se puede medir con viscosímetros capaces de realizar mediciones a distintas velocidades de corte, como un viscosímetro rotacional . [9]
La sangre es un fluido viscoelástico , lo que significa que posee características tanto viscosas como fluidas. El componente viscoso surge principalmente a través de la viscosidad del plasma sanguíneo, mientras que el componente elástico surge de la deformación de los glóbulos rojos . A medida que el corazón se contrae, la energía mecánica se transfiere del corazón a la sangre; una pequeña parte de la energía se disipa por la viscosidad de la suspensión , otra parte se almacena como energía elástica en los glóbulos rojos y la energía restante se utiliza para impulsar la circulación sanguínea y, por lo tanto, se convierte en energía cinética . Los fluidos viscoelásticos conforman una clase más grande de fluidos llamados fluidos no newtonianos .
Los glóbulos rojos ocupan aproximadamente la mitad del volumen de la sangre y poseen propiedades elásticas. Esta propiedad elástica es el factor que más contribuye al comportamiento viscoelástico de la sangre. El gran porcentaje de volumen de glóbulos rojos a un nivel de hematocrito normal deja poco espacio para el movimiento y la deformación de las células sin interactuar con una célula vecina. Los cálculos han demostrado que el porcentaje máximo de volumen de glóbulos rojos sin deformación es del 58%, lo que se encuentra dentro del rango de los niveles que ocurren normalmente. [10] Debido al espacio limitado entre los glóbulos rojos, es obvio que para que la sangre fluya, la interacción significativa entre células desempeñará un papel clave. Esta interacción y tendencia de las células a agregarse es un contribuyente principal al comportamiento viscoelástico de la sangre. La deformación y agregación de los glóbulos rojos también está asociada con cambios inducidos por el flujo en la disposición y la orientación como un tercer factor principal en su comportamiento viscoelástico. [11] [12] Otros factores que contribuyen a las propiedades viscoelásticas de la sangre son la viscosidad del plasma, la composición del plasma, la temperatura y la velocidad de flujo o velocidad de corte. En conjunto, estos factores hacen que la sangre humana sea viscoelástica , no newtoniana y tixotrópica . [13]
Cuando los glóbulos rojos están en reposo o a velocidades de cizallamiento muy bajas, tienden a agregarse y apilarse de una manera energéticamente favorable. La atracción se atribuye a grupos cargados en la superficie de las células y a la presencia de fibrinógeno y globulinas. [14] Esta configuración agregada es una disposición de células con la menor cantidad de deformación. Con velocidades de cizallamiento muy bajas, la propiedad viscoelástica de la sangre está dominada por la agregación y la deformabilidad celular es relativamente insignificante. A medida que aumenta la velocidad de cizallamiento, el tamaño de los agregados comienza a disminuir. Con un aumento adicional en la velocidad de cizallamiento, las células se reorganizarán y orientarán para proporcionar canales para que el plasma pase a través y para que las células se deslicen. En este rango de velocidad de cizallamiento baja a media, las células se mueven con respecto a las células vecinas permitiendo el flujo. La influencia de las propiedades de agregación en la viscoelasticidad disminuye y la influencia de la deformabilidad de los glóbulos rojos comienza a aumentar. A medida que las velocidades de cizallamiento se vuelven grandes, los glóbulos rojos se estirarán o deformarán y se alinearán con el flujo. Se forman capas de células separadas por el plasma y el flujo se atribuye ahora a capas de células que se deslizan sobre capas de plasma. La capa de células permite un flujo más fácil de la sangre y, como tal, hay una viscosidad y una elasticidad reducidas. La viscoelasticidad de la sangre está dominada por la deformabilidad de los glóbulos rojos.
El modelo de Maxwell se refiere a los fluidos de Maxwell o al material de Maxwell . El material en el modelo de Maxwell es un fluido , lo que significa que respeta las propiedades de continuidad para ecuaciones conservadoras: los fluidos son un subconjunto de las fases de la materia e incluyen líquidos, gases, plasmas y, en cierta medida, sólidos plásticos. El modelo de Maxwell está hecho para estimar valores conservadores locales de viscoelasticidad mediante una medida global en el volumen integral del modelo que se transpondrá a diferentes situaciones de flujo. La sangre es un material complejo donde diferentes células, como los glóbulos rojos, son discontinuas en el plasma. Su tamaño y forma también son irregulares porque no son esferas perfectas. Para complicar aún más la forma del volumen sanguíneo, los glóbulos rojos no se distribuyen de manera idéntica en un volumen de muestra de sangre porque migran con gradientes de velocidad en dirección a las áreas de mayor velocidad, lo que llama la famosa representación del efecto Fåhræus-Lindqvist , agregados o separados en flujos de envoltura o tapón descritos por Thurston. [15] Típicamente, el Modelo de Maxwell descrito abajo considera uniformemente el material (color azul uniforme) como un fluido de partículas perfectamente distribuidas en todas partes del volumen (en azul) pero Thurston revela que los paquetes de glóbulos rojos, tapones, están más presentes en la región de alta velocidad, si y es la dirección de la altura en la figura del modelo de Maxwell, ( y ~H) y hay una capa de células libres en el área de menor velocidad ( y ~0) lo que significa que la fase de fluido de plasma que se deforma bajo el Modelo de Maxwell se tensa siguiendo revestimientos internos que escapan completamente del modelo analítico de Maxwell. [ cita requerida ]
En teoría, un fluido en un modelo de Maxwell se comporta exactamente de manera similar en cualquier otra geometría de flujo, como tuberías, celdas rotatorias o en estado de reposo. Pero en la práctica, las propiedades de la sangre varían con la geometría y se ha demostrado que la sangre es un material inadecuado para ser estudiado como fluido en sentido común. Por lo tanto, el modelo de Maxwell proporciona tendencias que deben completarse en una situación real seguida por el modelo de Thurston [15] en un vaso con respecto a la distribución de células en flujos de envoltura y de tapón. [ cita requerida ]
Si se considera un pequeño volumen cúbico de sangre, con fuerzas que actúan sobre él mediante el bombeo del corazón y fuerzas de corte de los límites, el cambio de forma del cubo tendrá dos componentes:
Al eliminar la fuerza, el cubo se recuperaría parcialmente. La deformación elástica se invierte, pero el deslizamiento no. Esto explica por qué la parte elástica solo se nota en un flujo inestable. En un flujo constante, el deslizamiento seguirá aumentando y las mediciones de la fuerza que no varía con el tiempo descuidarán las contribuciones de la elasticidad.

La figura 1 se puede utilizar para calcular los siguientes parámetros necesarios para la evaluación de la sangre cuando se ejerce una fuerza.
Se utiliza un flujo sinusoidal variable en el tiempo para simular la pulsación de un corazón. Un material viscoelástico sometido a un flujo variable en el tiempo dará como resultado una variación de fase entre y representada por . Si , el material es puramente elástico porque la tensión y la deformación están en fase, de modo que la respuesta de una causada por la otra es inmediata. Si = 90°, el material es puramente viscoso porque la deformación va 90 grados por detrás de la tensión. Un material viscoelástico estará en algún punto entre 0 y 90 grados.
La variación temporal sinusoidal es proporcional a . Por lo tanto, la relación de tamaño y fase entre la tensión, la deformación y la velocidad de corte se describen utilizando esta relación y una frecuencia en radianes, donde es la frecuencia en hercios .
Los componentes de la tensión cortante compleja se pueden escribir como:
Donde es la tensión viscosa y es la tensión elástica. El coeficiente complejo de viscosidad se puede encontrar tomando la relación entre la tensión cortante compleja y la velocidad cortante compleja: [16]
De manera similar, el módulo dinámico complejo G se puede obtener tomando la relación entre la tensión cortante compleja y la deformación cortante compleja.
Relacionando las ecuaciones con términos viscoelásticos comunes obtenemos el módulo de almacenamiento, G', y el módulo de pérdida, G".
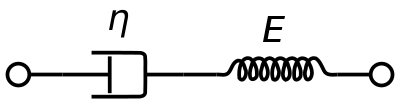
Para representar las propiedades viscoelásticas de la sangre , se suele utilizar un modelo de material viscoelástico de Maxwell . Utiliza un amortiguador puramente viscoso y un resorte puramente elástico conectados en serie. El análisis de este modelo proporciona la viscosidad compleja en términos de la constante del amortiguador y la constante del resorte.
Uno de los modelos constitutivos más utilizados para la viscoelasticidad de la sangre es el modelo Oldroyd-B. Existen varias variaciones del modelo no newtoniano Oldroyd-B que caracterizan el comportamiento de adelgazamiento por cizallamiento debido a la agregación y dispersión de glóbulos rojos a baja velocidad de cizallamiento. Aquí consideramos un modelo Oldroyd-B tridimensional acoplado con la ecuación de momento y el tensor de tensión total. [17] Se utiliza un flujo no newtoniano que asegura que la viscosidad de la sangre es una función del diámetro del vaso d y el hematocrito h. En el modelo Oldroyd-B, la relación entre el tensor de tensión de cizallamiento B y el tensor de tensión de orientación A viene dada por:
donde D/Dt es la derivada del material, V es la velocidad del fluido, C1, C2, g, son constantes. S y B se definen de la siguiente manera:
Los glóbulos rojos están sujetos a una intensa estimulación mecánica tanto del flujo sanguíneo como de las paredes de los vasos, y sus propiedades reológicas son importantes para su eficacia en el desempeño de sus funciones biológicas en la microcirculación. [18] Se ha demostrado que los glóbulos rojos por sí mismos exhiben propiedades viscoelásticas. Existen varios métodos utilizados para explorar las propiedades mecánicas de los glóbulos rojos, como:
Estos métodos sirvieron para caracterizar la deformabilidad de los glóbulos rojos en términos de cizallamiento, flexión, módulos de expansión de área y tiempos de relajación. [20] Sin embargo, no pudieron explorar las propiedades viscoelásticas. Se han implementado otras técnicas, como las mediciones fotoacústicas. Esta técnica utiliza un rayo láser de pulso único para generar una señal fotoacústica en los tejidos y se mide el tiempo de decaimiento de la señal. De acuerdo con la teoría de la viscoelasticidad lineal, el tiempo de decaimiento es igual a la relación viscosidad-elasticidad y, por lo tanto, se pueden obtener las características de viscoelasticidad de los glóbulos rojos. [21]
Otra técnica experimental utilizada para evaluar la viscoelasticidad consistió en utilizar perlas de ferromagnetismo adheridas a la superficie de una célula. Luego se aplicaron fuerzas a la perla magnética mediante citometría de torsión magnética óptica, lo que permitió a los investigadores explorar las respuestas dependientes del tiempo de los glóbulos rojos. [22]
es el par mecánico por unidad de volumen del cordón (unidades de tensión) y viene dado por:
donde H es el campo de torsión magnético aplicado, es el ángulo del momento magnético de la cuenta con respecto a la dirección de magnetización original, y c es la constante de la cuenta que se obtiene mediante experimentos realizados colocando la cuenta en un fluido de viscosidad conocida y aplicando un campo de torsión.
El módulo dinámico complejo G se puede utilizar para representar las relaciones entre la tensión y la deformación oscilantes:
¿Dónde está el módulo de almacenamiento y es el módulo de pérdida ?
donde y son las amplitudes de tensión y deformación y es el cambio de fase entre ellas.

A partir de las relaciones anteriores, los componentes del módulo complejo se determinan a partir de un bucle que se crea comparando el cambio en el par con el cambio en el tiempo que forma un bucle cuando se representa gráficamente. Los límites del bucle - d(t) y el área, A, delimitada por el bucle - d(t), que representa la disipación de energía por ciclo, se utilizan en los cálculos. El ángulo de fase , el módulo de almacenamiento G' y el módulo de pérdida G se convierten entonces en:
donde d es el desplazamiento.
La histéresis que se muestra en la figura 3 representa la viscoelasticidad presente en los glóbulos rojos. No está claro si esto está relacionado con las fluctuaciones moleculares de la membrana o con la actividad metabólica controlada por las concentraciones intracelulares de ATP . Se necesitan más investigaciones para explorar completamente estas interacciones y arrojar luz sobre las características subyacentes de la deformación viscoelástica de los glóbulos rojos.
Al observar el comportamiento viscoelástico de la sangre in vivo , es necesario considerar también los efectos de las arterias , los capilares y las venas . La viscosidad de la sangre tiene una influencia primaria en el flujo en las arterias más grandes, mientras que la elasticidad, que reside en la deformabilidad elástica de los glóbulos rojos, tiene una influencia primaria en las arteriolas y los capilares. [23] Comprender la propagación de ondas en las paredes arteriales, la hemodinámica local y el gradiente de tensión cortante de la pared es importante para comprender los mecanismos de la función cardiovascular. Las paredes arteriales son anisotrópicas y heterogéneas, compuestas de capas con diferentes características biomecánicas, lo que dificulta mucho la comprensión de las influencias mecánicas que las arterias contribuyen al flujo sanguíneo. [24]
Desde un punto de vista médico, resulta evidente la importancia de estudiar las propiedades viscoelásticas de la sangre. Con el desarrollo de dispositivos protésicos cardiovasculares, como válvulas cardíacas y bombas de sangre, se requiere la comprensión del flujo sanguíneo pulsante en geometrías complejas. Algunos ejemplos específicos son los efectos de la viscoelasticidad de la sangre y sus implicaciones para la prueba de bombas de sangre pulsátiles. [25] Se han documentado fuertes correlaciones entre la viscoelasticidad de la sangre y el flujo sanguíneo cerebral regional y global durante la derivación cardiopulmonar. [26]
Esto también ha abierto el camino para el desarrollo de un análogo de la sangre con el fin de estudiar y probar dispositivos protésicos. El análogo clásico de glicerina y agua proporciona una buena representación de la viscosidad y los efectos inerciales, pero carece de las propiedades elásticas de la sangre real. Uno de estos análogos de la sangre es una solución acuosa de goma xantana y glicerina desarrollada para igualar los componentes viscosos y elásticos de la compleja viscosidad de la sangre. [27]
Los glóbulos rojos normales son deformables, pero muchas enfermedades, como la anemia falciforme , reducen su elasticidad, lo que los hace menos deformables. Los glóbulos rojos con deformabilidad reducida tienen una mayor impedancia al flujo, lo que conduce a un aumento de la agregación de glóbulos rojos y una reducción de la saturación de oxígeno que puede conducir a más complicaciones. La presencia de células con deformabilidad disminuida, como es el caso de la anemia falciforme, tiende a inhibir la formación de capas de plasma y, midiendo la viscoelasticidad, se puede cuantificar el grado de inhibición. [28]
En los primeros trabajos teóricos, la sangre se consideraba un fluido viscoso no newtoniano. Los estudios iniciales habían evaluado la sangre durante un flujo constante y, más tarde, utilizando un flujo oscilante. [29] El profesor George B. Thurston, de la Universidad de Texas, presentó por primera vez la idea de que la sangre es viscoelástica en 1972. Los estudios anteriores que analizaron la sangre en un flujo constante mostraron propiedades elásticas insignificantes porque el régimen elástico se almacena en la sangre durante el inicio del flujo y, por lo tanto, su presencia queda oculta cuando un flujo alcanza el estado constante. Los primeros estudios utilizaron las propiedades encontradas en el flujo constante para derivar propiedades para situaciones de flujo inestable. [30] [31] Los avances en los procedimientos y dispositivos médicos exigieron una mejor comprensión de las propiedades mecánicas de la sangre. [ cita requerida ]
Las relaciones entre la tensión de corte y la velocidad de corte de la sangre deben determinarse experimentalmente y expresarse mediante ecuaciones constitutivas . Dado el complejo comportamiento macrorreológico de la sangre, no es sorprendente que una sola ecuación no pueda describir por completo los efectos de varias variables reológicas (por ejemplo, hematocrito , velocidad de corte). Por lo tanto, existen varios enfoques para definir estas ecuaciones, algunas de las cuales son el resultado de datos experimentales de ajuste de curvas y otras se basan en un modelo reológico particular.
El hallazgo de que, para la sangre que fluye de manera constante en tubos con diámetros inferiores a 300 micrómetros, el hematocrito promedio de la sangre en el tubo es menor que el hematocrito de la sangre en el reservorio que alimenta el tubo se conoce como efecto Fåhræus. Este efecto se genera en la longitud de entrada de concentración del tubo, en la que los eritrocitos se mueven hacia la región central del tubo a medida que fluyen aguas abajo. Se estima que esta longitud de entrada es aproximadamente la distancia que recorre la sangre en un cuarto de segundo para la sangre en la que la agregación de glóbulos rojos es insignificante y el diámetro del vaso es mayor que aproximadamente 20 micrómetros. [1]
A medida que la dimensión característica de un canal de flujo se acerca al tamaño de las partículas en una suspensión, se debe esperar que el modelo continuo simple de la suspensión no sea aplicable. A menudo, este límite de la aplicabilidad del modelo continuo comienza a manifestarse en dimensiones de canal características que son aproximadamente 30 veces el diámetro de la partícula: en el caso de la sangre con una dimensión característica de GR de 8 μm, se produce una falla aparente a aproximadamente 300 micrómetros. Esto fue demostrado por Fåhraeus y Lindqvist, quienes descubrieron que la viscosidad aparente de la sangre era una función del diámetro del tubo para diámetros de 300 micrómetros y menores cuando fluía sangre con hematocrito constante desde un depósito bien agitado a través de un tubo. El hallazgo de que para tubos pequeños con diámetros inferiores a aproximadamente 300 micrómetros y para velocidades de flujo más rápidas que no permiten una agregación apreciable de eritrocitos, la viscosidad efectiva de la sangre depende del diámetro del tubo se conoce como el efecto Fåhræus-Lindqvist. [1]
{{cite book}}: |journal=ignorado ( ayuda )