La viruela era una enfermedad infecciosa causada por el virus variola (a menudo llamado virus de la viruela), que pertenece al género Orthopoxvirus . [7] [11] El último caso natural se diagnosticó en octubre de 1977, y la Organización Mundial de la Salud (OMS) certificó la erradicación mundial de la enfermedad en 1980, [10] convirtiendo a la viruela en la única enfermedad humana que ha sido erradicada hasta la fecha. [12]
Los síntomas iniciales de la enfermedad incluían fiebre y vómitos. [5] A esto le seguía la formación de úlceras en la boca y una erupción cutánea . [5] Con el paso de los días, la erupción cutánea se convertía en las características ampollas llenas de líquido con una abolladura en el centro. [5] Luego, las protuberancias formaban costras y se caían, dejando cicatrices. [5] La enfermedad se transmitía de una persona a otra principalmente a través del contacto prolongado cara a cara con una persona infectada o (raramente) a través de objetos contaminados . [6] [13] [14] La prevención se lograba principalmente a través de la vacuna contra la viruela . [9] Una vez que la enfermedad se había desarrollado, ciertos medicamentos antivirales podrían haber ayudado potencialmente, pero dichos medicamentos no estuvieron disponibles hasta después de que la enfermedad fuera erradicada. [9] El riesgo de muerte era de alrededor del 30%, con tasas más altas entre los bebés. [6] [15] A menudo, los que sobrevivían tenían cicatrices extensas en la piel y algunos quedaban ciegos. [6]
La evidencia más temprana de la enfermedad data de alrededor de 1500 a. C. en momias egipcias . [16] [17] La enfermedad se produjo históricamente en brotes . [10] Fue una de varias enfermedades introducidas por el intercambio colombino al Nuevo Mundo , lo que provocó la muerte de grandes franjas de nativos americanos . En la Europa del siglo XVIII, se estima que 400.000 personas murieron por la enfermedad por año, y que un tercio de todos los casos de ceguera se debieron a la viruela. [10] [18] Se estima que la viruela mató hasta 300 millones de personas en el siglo XX [19] [20] y alrededor de 500 millones de personas en los últimos 100 años de su existencia. [21] Las muertes anteriores incluyeron a seis monarcas europeos , incluido Luis XV de Francia en 1774. [10] [18] Tan recientemente como en 1967, ocurrieron 15 millones de casos al año. [10] El último caso mortal conocido ocurrió en el Reino Unido en 1978 .
La inoculación contra la viruela parece haber comenzado en China alrededor del siglo XVI. [22] [23] Europa adoptó esta práctica de Asia en la primera mitad del siglo XVIII. [24] En 1796, Edward Jenner introdujo la vacuna moderna contra la viruela. [25] [26] En 1967, la OMS intensificó los esfuerzos para eliminar la enfermedad. [10] La viruela es una de las dos enfermedades infecciosas que se han erradicado, la otra es la peste bovina (una enfermedad de los ungulados de dedos pares ) en 2011. [27] [28] El término "viruela" se utilizó por primera vez en Inglaterra en el siglo XVI para distinguir la enfermedad de la sífilis , que entonces se conocía como la "gran viruela". [29] [30] Otros nombres históricos para la enfermedad incluyen viruela, monstruo moteado y peste roja. [3] [4] [30]
Estados Unidos y Rusia conservan muestras del virus variola en laboratorios, lo que ha provocado debates sobre su seguridad .
Existen dos formas de viruela. La viruela mayor es la forma grave y más común, con un exantema más extenso y fiebre más alta. La viruela menor es una presentación menos común, que causa una enfermedad menos grave, típicamente viruela discreta, con tasas de mortalidad históricas del 1% o menos. [32] Se observaron infecciones subclínicas ( asintomáticas ) con el virus variola, pero no fueron comunes. [33] Además, una forma llamada variola sine eruptione (viruela sin exantema) se observó generalmente en personas vacunadas. Esta forma se caracterizaba por una fiebre que se producía después del período de incubación habitual y solo podía confirmarse mediante estudios de anticuerpos o, raramente, mediante cultivo viral . [33] Además, había dos tipos muy raros y fulminantes de viruela, las formas maligna (plana) y hemorrágica, que generalmente eran fatales.
Los síntomas iniciales fueron similares a los de otras enfermedades virales que todavía existen, como la gripe y el resfriado común : fiebre de al menos 38,3 °C (101 °F), dolor muscular , malestar , dolor de cabeza y fatiga. Como el tracto digestivo era el más afectado, a menudo se producían náuseas, vómitos y dolor de espalda. La fase prodrómica temprana solía durar entre 2 y 4 días. Entre los días 12 y 15, aparecieron las primeras lesiones visibles (pequeñas manchas rojizas llamadas enantema ) en las membranas mucosas de la boca, la lengua, el paladar y la garganta, y la temperatura descendió hasta casi lo normal. Estas lesiones se agrandaron y se rompieron rápidamente, liberando grandes cantidades de virus en la saliva. [34]
El virus variola tendía a atacar las células de la piel, causando los granos característicos, o máculas , asociados con la enfermedad. Se desarrollaba una erupción en la piel entre 24 y 48 horas después de que aparecieran las lesiones en las membranas mucosas. Por lo general, las máculas aparecían primero en la frente, luego se extendían rápidamente a toda la cara, las porciones proximales de las extremidades, el tronco y, por último, a las porciones distales de las extremidades. El proceso no tardaba más de 24 a 36 horas, después de las cuales no aparecían nuevas lesiones. [34] En este punto, la enfermedad variola mayor podía tomar varios cursos muy diferentes, lo que dio lugar a cuatro tipos de viruela según la clasificación de Rao: [35] viruela ordinaria, modificada, maligna (o plana) y hemorrágica. Históricamente, la viruela ordinaria tenía una tasa de mortalidad general de alrededor del 30%, y las formas maligna y hemorrágica eran generalmente mortales. La forma modificada casi nunca era mortal. En los primeros casos hemorrágicos, las hemorragias se producían antes de que se desarrollara cualquier lesión cutánea. [36] El período de incubación entre la contracción y los primeros síntomas evidentes de la enfermedad fue de 7 a 14 días. [37]

Al menos el 90% de los casos de viruela entre personas no vacunadas fueron del tipo común. [33] En esta forma de la enfermedad, al segundo día de la erupción las máculas se habían convertido en pápulas elevadas . Al tercer o cuarto día, las pápulas se habían llenado de un líquido opalescente para convertirse en vesículas . Este líquido se volvió opaco y turbio en 24 a 48 horas, dando lugar a pústulas .
Al sexto o séptimo día, todas las lesiones cutáneas se habían convertido en pústulas. Entre el séptimo y el décimo día, las pústulas habían madurado y alcanzado su tamaño máximo. Las pústulas eran muy elevadas, típicamente redondas, tensas y firmes al tacto. Las pústulas estaban profundamente incrustadas en la dermis, lo que les daba la sensación de una pequeña perla en la piel. El líquido se filtraba lentamente de las pústulas y, al final de la segunda semana, las pústulas se habían desinflado y habían comenzado a secarse, formando costras o costras. Al día 16-20, se habían formado costras sobre todas las lesiones, que habían comenzado a desprenderse, dejando cicatrices despigmentadas . [38]
La viruela común generalmente producía una erupción cutánea discreta, en la que las pústulas se destacaban en la piel por separado. La distribución de la erupción era más densa en la cara, más densa en las extremidades que en el tronco y más densa en las partes distales de las extremidades que en las proximales. En la mayoría de los casos, las palmas de las manos y las plantas de los pies estaban afectadas. [33]
En ocasiones, las ampollas se fusionaban y formaban una erupción confluente que comenzaba a separar las capas externas de la piel de la carne subyacente. Los pacientes con viruela confluente a menudo seguían enfermos incluso después de que se formaran costras sobre todas las lesiones. En una serie de casos, la tasa de letalidad en la viruela confluente fue del 62 %. [33]

En cuanto al carácter de la erupción y la rapidez de su desarrollo, la viruela modificada se presentó principalmente en personas previamente vacunadas. Fue poco frecuente en personas no vacunadas, con un estudio de caso que mostró un 1-2% de casos modificados en comparación con alrededor del 25% en personas vacunadas. En esta forma, la enfermedad prodrómica todavía ocurrió, pero puede haber sido menos grave que en el tipo ordinario. Por lo general, no hubo fiebre durante la evolución de la erupción. Las lesiones cutáneas tendieron a ser menos numerosas y evolucionaron más rápidamente, fueron más superficiales y pueden no haber mostrado la característica uniforme de la viruela más típica. [38] La viruela modificada rara vez, o nunca, fue mortal. Esta forma de viruela mayor se confundía más fácilmente con la varicela . [33]
.jpg/440px-Malignant_smallpox_(cropped).jpg)
En la viruela de tipo maligno (también llamada viruela plana) las lesiones permanecieron casi al ras de la piel en el momento en que se habrían formado vesículas elevadas en el tipo ordinario. Se desconoce por qué algunas personas desarrollaron este tipo. Históricamente, representó el 5-10% de los casos, y la mayoría (72%) fueron niños. [3] La viruela maligna estuvo acompañada de una fase prodrómica grave que duró 3-4 días, fiebre alta prolongada y síntomas graves de viremia . Los síntomas prodrómicos continuaron incluso después de la aparición de la erupción. [3] La erupción en las membranas mucosas ( enantema ) fue extensa. Las lesiones cutáneas maduraron lentamente, eran típicamente confluentes o semiconfluentes, y para el séptimo u octavo día, eran planas y parecían estar enterradas en la piel. A diferencia de la viruela de tipo ordinario, las vesículas contenían poco líquido, eran suaves y aterciopeladas al tacto y pueden haber contenido hemorragias. La viruela maligna era casi siempre mortal y la muerte se producía generalmente entre el octavo y el duodécimo día de la enfermedad. A menudo, un día o dos antes de la muerte, las lesiones se volvían de un gris ceniciento, lo que, junto con la distensión abdominal, era un signo de mal pronóstico. [3] Se cree que esta forma de viruela es causada por una inmunidad celular deficiente a la viruela. Si la persona se recuperaba, las lesiones se desvanecían gradualmente y no formaban cicatrices ni costras. [39]
La viruela hemorrágica es una forma grave que se acompaña de un sangrado extenso en la piel, las mucosas, el tracto gastrointestinal y las vísceras . Esta forma se desarrolla en aproximadamente el 2% de las infecciones y se presenta principalmente en adultos. [33] Las pústulas no suelen formarse en la viruela hemorrágica. En cambio, el sangrado se produce debajo de la piel, lo que hace que se vea carbonizada y negra, [33] por lo que esta forma de la enfermedad también se conoce como viruela negra o "viruela negra". [40] La viruela hemorrágica ha sido causada muy raramente por el virus variola minor. [41] Si bien el sangrado puede ocurrir en casos leves y no afectar los resultados, [42] la viruela hemorrágica suele ser mortal. [43] La vacunación no parece proporcionar inmunidad a ninguna de las formas de viruela hemorrágica y algunos casos incluso ocurrieron entre personas que fueron revacunadas poco antes. Tiene dos formas. [3]
.jpg/440px-Hemorrhagic_smallpox_2_(cropped).jpg)
La forma temprana o fulminante de la viruela hemorrágica (conocida como púrpura variolosa ) comienza con una fase prodrómica caracterizada por fiebre alta, dolor de cabeza intenso y dolor abdominal. [39] La piel se vuelve oscura y eritematosa, y esto es seguido rápidamente por el desarrollo de petequias y sangrado en la piel, conjuntiva y membranas mucosas. La muerte a menudo ocurre repentinamente entre el quinto y séptimo día de enfermedad, cuando solo están presentes unas pocas lesiones cutáneas insignificantes. Algunas personas sobreviven unos días más, durante los cuales la piel se desprende y el líquido se acumula debajo de ella, rompiéndose a la más mínima lesión. Las personas suelen estar conscientes hasta la muerte o poco antes. [43] La autopsia revela petequias y sangrado en el bazo, riñón, membranas serosas , músculos esqueléticos, pericardio , hígado, gónadas y vejiga. [41] Históricamente, esta afección se diagnosticaba erróneamente con frecuencia, y el diagnóstico correcto solo se realizaba en la autopsia. [41] Es más probable que esta forma se presente en mujeres embarazadas que en la población general (aproximadamente el 16% de los casos en mujeres embarazadas no vacunadas fueron viruela hemorrágica temprana, frente a aproximadamente el 1% en mujeres no embarazadas y hombres adultos). [43] La tasa de letalidad de la viruela hemorrágica temprana se acerca al 100%. [43]
También existe una forma posterior de viruela hemorrágica (denominada viruela hemorrágica tardía o variolosa pustula hemorrhagica ). El pródromo es grave y similar al observado en la viruela hemorrágica temprana, y la fiebre persiste durante todo el curso de la enfermedad. [3] El sangrado aparece en el período eruptivo temprano (pero más tarde que el observado en la púrpura variolosa ), y la erupción suele ser plana y no progresa más allá de la etapa vesicular. Las hemorragias en las membranas mucosas parecen ocurrir con menos frecuencia que en la forma hemorrágica temprana. [33] A veces, la erupción forma pústulas que sangran en la base y luego sufren el mismo proceso que en la viruela común. Esta forma de la enfermedad se caracteriza por una disminución de todos los elementos de la cascada de coagulación y un aumento de la antitrombina circulante . [34] Esta forma de viruela se presenta en un 3% a 25% de los casos fatales, dependiendo de la virulencia de la cepa de viruela. [36] La mayoría de las personas con la forma tardía mueren dentro de los ocho a diez días de la enfermedad. Entre los pocos que se recuperan, las lesiones hemorrágicas desaparecen gradualmente después de un largo período de convalecencia. [3] La tasa de letalidad de la viruela hemorrágica tardía es de alrededor del 90-95%. [35] Las mujeres embarazadas tienen un poco más de probabilidades de sufrir esta forma de la enfermedad, aunque no tanto como la viruela hemorrágica temprana. [3]
La viruela es causada por la infección con el virus variola, que pertenece a la familia Poxviridae , subfamilia Chordopoxvirinae , género Orthopoxvirus .
La fecha de aparición de la viruela no está establecida. Lo más probable es que haya evolucionado a partir de un virus terrestre africano de roedores hace entre 68.000 y 16.000 años. [44] La amplia gama de fechas se debe a los diferentes registros utilizados para calibrar el reloj molecular . Un clado fue el de las cepas variola major (la forma clínicamente más grave de la viruela) que se extendió desde Asia hace entre 400 y 1.600 años. Un segundo clado incluía tanto alastrim (una viruela fenotípicamente leve) descrita en los continentes americanos como aislados de África occidental que divergieron de una cepa ancestral entre 1.400 y 6.300 años antes del presente. Este clado divergió a su vez en dos subclados hace al menos 800 años. [45]
Una segunda estimación ha situado la separación del virus variola de Taterapox (un Orthopoxvirus de algunos roedores africanos, incluidos los jerbos ) hace 3.000 a 4.000 años. [46] Esto es consistente con la evidencia arqueológica e histórica sobre la aparición de la viruela como una enfermedad humana que sugiere un origen relativamente reciente. Si se supone que la tasa de mutación es similar a la de los herpesvirus , la fecha de divergencia del virus variola de Taterapox se ha estimado en hace 50.000 años. [46] Si bien esto es consistente con las otras estimaciones publicadas, sugiere que la evidencia arqueológica e histórica es muy incompleta. Se necesitan mejores estimaciones de las tasas de mutación en estos virus.
El análisis de una cepa que data de alrededor de 1650 reveló que esta cepa era basal respecto de las otras cepas secuenciadas en la actualidad. [47] La tasa de mutación de este virus está bien modelada por un reloj molecular. La diversificación de cepas solo ocurrió en los siglos XVIII y XIX.
El virus de la viruela es grande y tiene forma de ladrillo y mide aproximadamente de 302 a 350 nanómetros por 244 a 270 nm, [48] con un genoma de ADN bicatenario lineal único de 186 pares de kilobases (kbp) de tamaño y que contiene un bucle de horquilla en cada extremo. [49] [50]
Cuatro ortopoxvirus causan infecciones en humanos: viruela, vaccinia , viruela bovina y viruela del mono . El virus viruela infecta solo a humanos en la naturaleza, aunque se han infectado primates y otros animales en un entorno experimental. Los virus vaccinia, vaccinia y viruela del mono pueden infectar tanto a humanos como a otros animales en la naturaleza. [33]
El ciclo de vida de los poxvirus es complicado porque tienen múltiples formas infecciosas y distintos mecanismos de entrada a la célula. Los poxvirus son únicos entre los virus de ADN humanos porque se replican en el citoplasma de la célula en lugar de en el núcleo . Para replicarse, los poxvirus producen una variedad de proteínas especializadas que no producen otros virus de ADN , la más importante de las cuales es una ARN polimerasa dependiente de ADN asociada al virus .
Tanto los viriones envueltos como los no envueltos son infecciosos. La envoltura viral está formada por membranas de Golgi modificadas que contienen polipéptidos específicos del virus, incluida la hemaglutinina . [49] La infección con el virus variola major o el virus variola minor confiere inmunidad contra el otro. [34]
La forma infecciosa más común de la enfermedad fue causada por la cepa del virus variola major, conocida por su tasa de mortalidad significativamente más alta en comparación con su contraparte, la variola minor. La variola major tuvo una tasa de mortalidad de alrededor del 30%, mientras que la tasa de mortalidad de la variola minor fue de alrededor del 1%. A lo largo del siglo XVIII, la variola major fue responsable de alrededor de 400.000 muertes anuales solo en Europa. Los sobrevivientes de la enfermedad a menudo enfrentaban consecuencias de por vida, como ceguera y cicatrices severas, que eran casi universales entre los que se recuperaban. [51]
En la primera mitad del siglo XX, la viruela mayor fue la principal causa de los brotes de viruela en Asia y la mayor parte de África. Mientras tanto, la viruela menor se encontró con mayor frecuencia en regiones de Europa, América del Norte, América del Sur y ciertas partes de África. [52]
El virus variola minor, también llamado alastrim, era una forma menos común del virus y mucho menos mortal. Aunque el variola minor tenía el mismo período de incubación y etapas patogénicas que la viruela, se cree que tuvo una tasa de mortalidad de menos del 1%, en comparación con el 30% del variola major. Al igual que el variola major, el variola minor se propagaba a través de la inhalación del virus en el aire, lo que podía ocurrir por contacto cara a cara o a través de fómites. La infección con el virus variola minor confería inmunidad contra el más peligroso virus variola major.
Como la viruela menor era una enfermedad menos debilitante que la viruela, las personas podían caminar con más frecuencia y, por lo tanto, infectar a otros más rápidamente. Como tal, la viruela menor se extendió por los Estados Unidos, Gran Bretaña y Sudáfrica a principios del siglo XX, convirtiéndose en la forma dominante de la enfermedad en esas áreas y, por lo tanto, disminuyendo rápidamente las tasas de mortalidad. Junto con la viruela mayor, la forma menor ahora ha sido totalmente erradicada del mundo. El último caso de viruela menor autóctona se informó en un cocinero somalí, Ali Maow Maalin, en octubre de 1977, y la viruela se declaró oficialmente erradicada en todo el mundo en mayo de 1980. [16] La viruela menor también se llamó viruela blanca, viruela kaffir, sarna cubana, viruela de las Indias Occidentales, viruela de la leche y pseudovariola.
El genoma del virus variola major tiene una longitud de aproximadamente 186.000 pares de bases. [53] Está hecho de ADN bicatenario lineal y contiene la secuencia codificante de aproximadamente 200 genes . [54] Los genes no suelen superponerse y suelen aparecer en bloques que apuntan hacia la región terminal más cercana del genoma. [55] La secuencia codificante de la región central del genoma es muy consistente en los ortopoxvirus , y la disposición de los genes es consistente en los cordopoxvirus. [54] [55]
El centro del genoma del virus variólico contiene la mayoría de los genes virales esenciales, incluidos los genes para proteínas estructurales , replicación de ADN , transcripción y síntesis de ARNm . [54] Los extremos del genoma varían más entre cepas y especies de ortopoxvirus . [54] Estas regiones contienen proteínas que modulan los sistemas inmunes de los huéspedes y son las principales responsables de la variabilidad en la virulencia en la familia de los ortopoxvirus . [54] Estas regiones terminales en los poxvirus son secuencias de repeticiones terminales invertidas (ITR). [55] Estas secuencias son idénticas pero orientadas de manera opuesta en cada extremo del genoma, lo que lleva a que el genoma sea un bucle continuo de ADN. [55] Los componentes de las secuencias ITR incluyen un bucle de horquilla rico en A/T con pares de bases incompletos , una región de aproximadamente 100 pares de bases necesarios para resolver el ADN concatomérico (un tramo de ADN que contiene múltiples copias de la misma secuencia), algunos marcos de lectura abiertos y secuencias cortas repetidas en tándem de número y longitud variables. [55] Las ITR de poxviridae varían en longitud entre cepas y especies. [55] La secuencia codificante de la mayoría de las proteínas virales en el virus variola major tiene al menos un 90% de similitud con el genoma de vaccinia , un virus relacionado utilizado para la vacunación contra la viruela. [55]
La expresión genética del virus variola ocurre completamente dentro del citoplasma de la célula huésped y sigue una progresión distinta durante la infección. [55] Después de la entrada de un virión infeccioso en una célula huésped, la síntesis de ARNm viral se puede detectar en 20 minutos. [55] Aproximadamente la mitad del genoma viral se transcribe antes de la replicación del ADN viral. [55] El primer conjunto de genes expresados se transcribe por la maquinaria viral preexistente empaquetada dentro del virión infectante. [55] Estos genes codifican los factores necesarios para la síntesis de ADN viral y para la transcripción del siguiente conjunto de genes expresados. [55] A diferencia de la mayoría de los virus de ADN, la replicación de ADN en el virus variola y otros poxvirus tiene lugar dentro del citoplasma de la célula infectada. [55] El momento exacto de la replicación del ADN después de la infección de una célula huésped varía entre los poxviridae . [55] La recombinación del genoma ocurre dentro de las células infectadas activamente. [55] Tras el inicio de la replicación del ADN viral, un conjunto intermedio de genes codifica factores de transcripción de expresión génica tardía. [55] Los productos de los genes tardíos incluyen factores de transcripción necesarios para transcribir los genes tempranos de los nuevos viriones, así como la ARN polimerasa viral y otras enzimas esenciales para las nuevas partículas virales. [55] Estas proteínas se empaquetan luego en nuevos viriones infecciosos capaces de infectar otras células. [55]
Quedan dos muestras vivas del virus variola major, una en los Estados Unidos, en el CDC de Atlanta, y otra en el Instituto Vector en Koltsovo, Rusia. [56] La investigación con las muestras de virus restantes está estrictamente controlada, y cada propuesta de investigación debe ser aprobada por la OMS y la Asamblea Mundial de la Salud (AMS). [56] La mayoría de las investigaciones sobre poxvirus se realizan utilizando el virus vaccinia, estrechamente relacionado, como organismo modelo. [55] El virus vaccinia, que se utiliza para vacunar contra la viruela, también se está investigando como vector viral para vacunas contra enfermedades no relacionadas. [57]
El genoma del virus variola major fue secuenciado por primera vez en su totalidad en la década de 1990. [54] La secuencia codificante completa está disponible públicamente en línea. La secuencia de referencia actual para el virus variola major fue secuenciada a partir de una cepa que circuló en la India en 1967. Además, existen secuencias para muestras de otras cepas que se recolectaron durante la campaña de erradicación de la OMS. [54] Un navegador de genoma para una base de datos completa de secuencias anotadas del virus variola y otros poxvirus está disponible públicamente a través del Centro de Recursos de Bioinformática Viral . [58]
La OMS actualmente prohíbe la ingeniería genética del virus variola. [59] Sin embargo, en 2004, un comité asesor de la OMS votó a favor de permitir la edición del genoma de las dos muestras restantes del virus variola major para agregar un gen marcador . [59] Este gen, llamado GFP , o proteína fluorescente verde, haría que las muestras vivas del virus brillaran de color verde bajo luz fluorescente. [60] La inserción de este gen, que no influiría en la virulencia del virus, sería la única modificación permitida del genoma. [60] El comité declaró que la modificación propuesta ayudaría en la investigación de tratamientos al facilitar la evaluación de si un tratamiento potencial era eficaz para matar muestras virales. [60] La recomendación solo podría entrar en vigor si era aprobada por la AMS . [60] Cuando la AMS discutió la propuesta en 2005, se abstuvo de realizar una votación formal sobre la propuesta, declarando que revisaría las propuestas de investigación individuales una a la vez. [61] La adición del gen GFP al genoma de Vaccinia se realiza de forma rutinaria durante la investigación sobre el virus Vaccinia estrechamente relacionado . [62]
La disponibilidad pública de la secuencia completa del virus variola ha suscitado inquietudes sobre la posibilidad de una síntesis ilícita de virus infecciosos. [63] La vacuna , un primo del virus variola, fue sintetizada artificialmente en 2002 por científicos del NIH . [64] Utilizaron un método previamente establecido que implicaba el uso de un genoma viral recombinante para crear un plásmido bacteriano autorreplicante que producía partículas virales. [64]
En 2016, otro grupo sintetizó el virus de la viruela equina utilizando datos de secuencias disponibles públicamente para la viruela equina. [65] Los investigadores argumentaron que su trabajo sería beneficioso para crear una vacuna más segura y efectiva contra la viruela, aunque ya existe una vacuna efectiva. [65] El virus de la viruela equina parecía haberse extinguido anteriormente, lo que generó preocupación sobre la posible resurrección de la viruela mayor y provocó que otros científicos cuestionaran sus motivos. [63] Los críticos encontraron especialmente preocupante que el grupo pudiera recrear un virus viable en un corto período de tiempo con relativamente poco costo o esfuerzo. [65] Aunque la OMS prohíbe a los laboratorios individuales sintetizar más del 20% del genoma a la vez, y las compras de fragmentos del genoma de la viruela están monitoreadas y reguladas, un grupo con intenciones maliciosas podría recopilar, a partir de múltiples fuentes, el genoma sintético completo necesario para producir un virus viable. [65]
La viruela era muy contagiosa, pero generalmente se propagaba más lentamente y de forma menos amplia que otras enfermedades virales, tal vez porque la transmisión requería un contacto cercano y se producía después de la aparición de la erupción. La tasa general de infección también se vio afectada por la corta duración de la etapa infecciosa. En las zonas templadas , el número de infecciones de viruela era mayor durante el invierno y la primavera. En las zonas tropicales, la variación estacional era menos evidente y la enfermedad estaba presente durante todo el año. [33] La distribución por edad de las infecciones de viruela dependía de la inmunidad adquirida . La inmunidad por vacunación disminuía con el tiempo y probablemente se perdía en treinta años. [34] No se sabía que la viruela fuera transmitida por insectos o animales y no había ningún estado de portador asintomático . [33]
La transmisión se produjo a través de la inhalación del virus variólico en el aire , generalmente gotitas expulsadas de la mucosa oral, nasal o faríngea de una persona infectada. Se transmitió de una persona a otra principalmente a través del contacto prolongado cara a cara con una persona infectada. [14]
Algunas infecciones de trabajadores de lavandería con viruela después de manipular ropa de cama contaminada sugirieron que la viruela podría transmitirse a través del contacto directo con objetos contaminados ( fómites ), pero se encontró que esto era raro. [14] [35] También en raras ocasiones, la viruela se transmitió por virus transportados por el aire en entornos cerrados como edificios, autobuses y trenes. [32] El virus puede atravesar la placenta , pero la incidencia de viruela congénita fue relativamente baja. [34] La viruela no fue notablemente infecciosa en el período prodrómico y la eliminación viral generalmente se retrasó hasta la aparición de la erupción, que a menudo estaba acompañada de lesiones en la boca y la faringe. El virus puede transmitirse durante el curso de la enfermedad, pero esto sucedió con mayor frecuencia durante la primera semana de la erupción, cuando la mayoría de las lesiones de la piel estaban intactas. [33] La infectividad disminuyó en 7 a 10 días cuando se formaron costras sobre las lesiones, pero la persona infectada fue contagiosa hasta que se cayó la última costra de viruela. [66]
La preocupación por el posible uso de la viruela para la guerra biológica llevó en 2002 a Donald K. Milton a realizar una revisión detallada de las investigaciones existentes sobre su transmisión y de las recomendaciones vigentes en ese momento para controlar su propagación. Coincidió, citando a Rao, Fenner y otros, en que “la investigación epidemiológica cuidadosa rara vez implicaba a los fómites como fuente de infección”; señaló que “las recomendaciones actuales para el control de las infecciones secundarias de viruela enfatizan la transmisión 'por gotitas expulsadas a contactos cercanos (aquellos que se encuentran a una distancia de 6-7 pies)'”; pero advirtió que el “énfasis en la propagación a través de gotitas grandes puede reducir la vigilancia con la que se mantienen precauciones más difíciles contra la transmisión aérea [es decir, contra gotitas más finas capaces de viajar distancias más largas y penetrar profundamente en el tracto respiratorio inferior]”. [67]
Una vez inhalado, el virus de la viruela invadió las mucosas de la boca, la garganta y las vías respiratorias. Desde allí, migró a los ganglios linfáticos regionales y comenzó a multiplicarse. En la fase inicial de crecimiento, el virus parecía moverse de una célula a otra, pero alrededor del día 12, se produjo una lisis generalizada de las células infectadas y el virus pudo encontrarse en el torrente sanguíneo en grandes cantidades, una condición conocida como viremia . Esto dio lugar a la segunda ola de multiplicación en el bazo , la médula ósea y los ganglios linfáticos.
La definición clínica de viruela común es una enfermedad con inicio agudo de fiebre igual o mayor a 38,3 °C (101 °F) seguida de una erupción caracterizada por vesículas o pústulas firmes y profundas en la misma etapa de desarrollo sin otra causa aparente. [33] Cuando se observó un caso clínico, la viruela se confirmó mediante pruebas de laboratorio.
Microscópicamente , los poxvirus producen cuerpos de inclusión citoplasmáticos característicos , los más importantes de los cuales se conocen como cuerpos de Guarnieri , y son los sitios de replicación viral . Los cuerpos de Guarnieri se identifican fácilmente en biopsias de piel teñidas con hematoxilina y eosina, y aparecen como manchas rosadas. Se encuentran en prácticamente todas las infecciones por poxvirus, pero la ausencia de cuerpos de Guarnieri no podría usarse para descartar la viruela. [68] El diagnóstico de una infección por ortopoxvirus también se puede hacer rápidamente mediante el examen microscópico electrónico del líquido pustuloso o las costras. Todos los ortopoxvirus exhiben viriones idénticos en forma de ladrillo mediante microscopía electrónica. [34] Si se ven partículas con la morfología característica de los herpesvirus, esto eliminará la viruela y otras infecciones por ortopoxvirus.
La identificación definitiva en el laboratorio del virus variólico implicó el cultivo del virus en la membrana corioalantoidea (parte de un embrión de pollo ) y el examen de las lesiones resultantes en condiciones de temperatura definidas. [69] Las cepas se caracterizaron mediante la reacción en cadena de la polimerasa (PCR) y el análisis del polimorfismo de la longitud de los fragmentos de restricción (RFLP). También se desarrollaron pruebas serológicas y ensayos inmunoabsorbentes ligados a enzimas (ELISA), que midieron la inmunoglobulina y el antígeno específicos del virus variólico para ayudar en el diagnóstico de la infección. [70]
En la era inmediatamente posterior a la erradicación, la varicela se confundía comúnmente con la viruela. La varicela y la viruela podían distinguirse por varios métodos. A diferencia de la viruela, la varicela no suele afectar las palmas de las manos ni las plantas de los pies. Además, las pústulas de la varicela son de tamaño variable debido a las variaciones en el momento de la erupción de la pústula: las pústulas de la viruela son casi todas del mismo tamaño ya que el efecto viral progresa de manera más uniforme. Se disponía de una variedad de métodos de laboratorio para detectar la varicela en la evaluación de casos sospechosos de viruela. [33]
.jpg/440px-Smallpox_vaccine_(cropped).jpg)
El primer procedimiento utilizado para prevenir la viruela fue la inoculación con el virus variola minor (un método conocido posteriormente como variolización tras la introducción de la vacuna antivariólica para evitar posibles confusiones), que probablemente se produjo en la India, África y China mucho antes de que la práctica llegara a Europa. [15] La idea de que la inoculación se originó en la India ha sido cuestionada, ya que pocos de los antiguos textos médicos sánscritos describen el proceso de inoculación. [71] Se pueden encontrar relatos de inoculación contra la viruela en China ya a finales del siglo X, y el procedimiento se practicaba ampliamente en el siglo XVI, durante la dinastía Ming . [72] Si tenía éxito, la inoculación producía inmunidad duradera a la viruela. Debido a que la persona estaba infectada con el virus variola, podía producirse una infección grave y la persona podía transmitir la viruela a otras. La variolización tenía una tasa de mortalidad del 0,5 al 2 por ciento, considerablemente menor que la tasa de mortalidad del 20 al 30 por ciento de la viruela. [33] La Royal Society de Londres recibió en 1700 dos informes sobre la práctica china de inoculación : uno del Dr. Martin Lister , que recibió un informe de un empleado de la Compañía de las Indias Orientales destinado en China, y otro de Clopton Havers . [73]
Lady Mary Wortley Montagu observó la inoculación de la viruela durante su estancia en el Imperio otomano , escribió relatos detallados de la práctica en sus cartas y promovió con entusiasmo el procedimiento en Inglaterra a su regreso en 1718. [74] Según Voltaire (1742), los turcos derivaron su uso de la inoculación de la vecina Circasia . Voltaire no especula sobre de dónde los circasianos derivaron su técnica, aunque informa que los chinos la han practicado "estos cien años". [75] En 1721, Cotton Mather y sus colegas provocaron controversia en Boston al inocular a cientos de personas. Después de publicar El método actual de inoculación de la viruela en 1767, el Dr. Thomas Dimsdale fue invitado a Rusia para variolar a la emperatriz Catalina la Grande de Rusia y a su hijo, el gran duque Pablo , lo que hizo con éxito en 1768. En 1796, Edward Jenner , un médico de Berkeley, Gloucestershire , Inglaterra rural, descubrió que se podía producir inmunidad a la viruela inoculando a una persona con material de una lesión de viruela bovina. La viruela bovina es un poxvirus de la misma familia que la viruela. Jenner llamó vacuna al material utilizado para la inoculación a partir de la raíz de la palabra vacca , que en latín significa vaca. El procedimiento era mucho más seguro que la variolización y no implicaba riesgo de transmisión de la viruela. La vacunación para prevenir la viruela pronto se practicó en todo el mundo. Durante el siglo XIX, el virus de la viruela bovina utilizado para la vacunación contra la viruela fue reemplazado por el virus vaccinia. La vaccinia pertenece a la misma familia que la viruela bovina y el virus variola, pero es genéticamente distinta de ambos. No se conoce el origen del virus vaccinia ni cómo llegó a la vacuna. [33]

La formulación actual de la vacuna contra la viruela es una preparación de virus vivo del virus vaccinia infeccioso. La vacuna se administra utilizando una aguja bifurcada (de dos puntas) que se sumerge en la solución de la vacuna. La aguja se utiliza para pinchar la piel (normalmente la parte superior del brazo) varias veces en unos pocos segundos. Si se tiene éxito, se desarrolla un bulto rojo y con picazón en el lugar de la vacuna en tres o cuatro días. En la primera semana, el bulto se convierte en una gran ampolla (llamada "vesícula de Jenner") que se llena de pus y comienza a supurar. Durante la segunda semana, la ampolla comienza a secarse y se forma una costra. La costra se cae en la tercera semana, dejando una pequeña cicatriz. [76]
Los anticuerpos inducidos por la vacuna contra la viruela son protectores cruzados contra otros ortopoxvirus, como el de la viruela del mono, el de la viruela de las vacas y el de la viruela. Los anticuerpos neutralizantes son detectables 10 días después de la primera vacunación y siete días después de la revacunación. Históricamente, la vacuna ha sido eficaz para prevenir la infección por viruela en el 95 por ciento de las personas vacunadas. [77] La vacunación contra la viruela proporciona un alto nivel de inmunidad durante tres a cinco años y una inmunidad decreciente a partir de entonces. Si una persona se vacuna de nuevo más tarde, la inmunidad dura incluso más tiempo. Los estudios de casos de viruela en Europa en los años 1950 y 1960 demostraron que la tasa de mortalidad entre las personas vacunadas menos de 10 años antes de la exposición era del 1,3 por ciento; era del 7 por ciento entre las vacunadas entre 11 y 20 años antes, y del 11 por ciento entre las vacunadas 20 o más años antes de la infección. En cambio, el 52 por ciento de las personas no vacunadas murió. [78]

Existen efectos secundarios y riesgos asociados con la vacuna contra la viruela. En el pasado, aproximadamente 1 de cada 1000 personas vacunadas por primera vez experimentaron reacciones graves, pero no mortales, incluyendo reacción tóxica o alérgica en el lugar de la vacunación ( eritema multiforme ), propagación del virus vaccinia a otras partes del cuerpo y propagación a otras personas. Se produjeron reacciones potencialmente mortales en 14 a 500 personas de cada 1 millón de personas vacunadas por primera vez. Con base en la experiencia pasada, se estima que 1 o 2 personas de 1 millón (0,000198 por ciento) que reciben la vacuna pueden morir como resultado, con mayor frecuencia como resultado de encefalitis posvacunal o necrosis grave en el área de la vacunación (llamada vaccinia progresiva ). [77]
En vista de estos riesgos, cuando la viruela se erradicó de manera efectiva y el número de casos naturales cayó por debajo del número de enfermedades y muertes inducidas por la vacuna, la vacunación infantil de rutina se interrumpió en los Estados Unidos en 1972 y se abandonó en la mayoría de los países europeos a principios de la década de 1970. [10] [79] La vacunación de rutina de los trabajadores de la salud se interrumpió en los EE. UU. en 1976, y entre los reclutas militares en 1990 (aunque el personal militar desplegado en Medio Oriente y Corea todavía recibe la vacuna [80] ). Para 1986, la vacunación de rutina había cesado en todos los países. [10] Ahora se recomienda principalmente para los trabajadores de laboratorio en riesgo de exposición ocupacional. [33] Sin embargo, la posibilidad de que el virus variólico se use como arma biológica ha reavivado el interés en el desarrollo de vacunas más nuevas. [81] La vacuna contra la viruela también es eficaz y, por lo tanto, se administra para la prevención de la mpox . [82]
La vacunación contra la viruela en los tres días posteriores a la exposición evitará o reducirá significativamente la gravedad de los síntomas de la viruela en la gran mayoría de las personas. La vacunación cuatro a siete días después de la exposición puede ofrecer cierta protección contra la enfermedad o puede modificar la gravedad de la enfermedad. [77] Además de la vacunación, el tratamiento de la viruela es principalmente de apoyo, como el cuidado de las heridas y el control de la infección, la terapia con líquidos y la posible asistencia con respirador . Los tipos planos y hemorrágicos de viruela se tratan con las mismas terapias que se usan para tratar el shock , como la reanimación con líquidos . Las personas con tipos semiconfluentes y confluentes de viruela pueden tener problemas terapéuticos similares a los pacientes con quemaduras extensas en la piel . [83]
En julio de 2018, la Administración de Alimentos y Medicamentos aprobó el tecovirimat , el primer fármaco aprobado para el tratamiento de la viruela. [84] Los tratamientos antivirales han mejorado desde las últimas grandes epidemias de viruela, y los estudios sugieren que el fármaco antiviral cidofovir podría ser útil como agente terapéutico. El fármaco debe administrarse por vía intravenosa y puede causar toxicidad renal grave. [85]
ACAM2000 es una vacuna contra la viruela desarrollada por Acambis. Fue aprobada para su uso en los Estados Unidos por la FDA estadounidense el 31 de agosto de 2007. Contiene virus vaccinia vivo , clonado de la misma cepa utilizada en una vacuna anterior , Dryvax . Mientras que el virus Dryvax se cultivó en la piel de terneros y se liofilizó, el virus de ACAM2000 se cultiva en células epiteliales de riñón ( células Vero ) de un mono verde africano . La eficacia y la incidencia de reacciones adversas son similares a las de Dryvax. [81] La vacuna no está disponible de forma rutinaria para el público estadounidense; sin embargo, se utiliza en el ejército y se mantiene en la Reserva Nacional Estratégica . [86]
En junio de 2021, el brincidofovir fue aprobado para uso médico en los Estados Unidos para el tratamiento de la viruela humana causada por el virus variola. [87] [88]
.jpg/440px-Man_with_facial_scarring_and_blindness_due_to_smallpox,_1972_(cropped).jpg)
La tasa de mortalidad de la viruela menor es de aproximadamente el 1%, mientras que la tasa de mortalidad de la viruela mayor es de aproximadamente el 30%. [89]
La viruela de tipo ordinario confluente es mortal en un 50-75% de los casos, la de tipo ordinario semiconfluente en un 25-50% de los casos, y en los casos en que el exantema es discreto, la tasa de letalidad es inferior al 10%. La tasa de letalidad general en niños menores de 1 año es del 40-50%. Los tipos hemorrágico y plano tienen las tasas de letalidad más altas. La tasa de letalidad de la viruela de tipo plano o hemorrágico tardío es del 90% o más y se observa casi el 100% en los casos de viruela hemorrágica temprana. [43] La tasa de letalidad de la viruela menor es del 1% o menos. [38] No hay evidencia de infección crónica o recurrente con el virus de la viruela. [38] En los casos de viruela plana en personas vacunadas, la afección fue extremadamente rara pero menos letal, y una serie de casos mostró una tasa de mortalidad del 67%. [3]
En los casos letales de viruela común, la muerte suele producirse entre los días 10 y 16 de la enfermedad. La causa de muerte por viruela no está clara, pero ahora se sabe que la infección afecta a múltiples órganos. Los complejos inmunes circulantes , la viremia abrumadora o una respuesta inmune descontrolada pueden ser factores contribuyentes. [33] En la viruela hemorrágica temprana, la muerte se produce de repente unos seis días después de que se desarrolla la fiebre. La causa de muerte en los casos hemorrágicos tempranos se debe comúnmente a insuficiencia cardíaca y edema pulmonar . En los casos hemorrágicos tardíos, la viremia alta y sostenida, la pérdida grave de plaquetas y la respuesta inmune deficiente se citaron a menudo como causas de muerte. [3] En la viruela plana, los modos de muerte son similares a los de las quemaduras, con pérdida de líquido , proteínas y electrolitos , y sepsis fulminante . [83]
Las complicaciones de la viruela se producen con mayor frecuencia en el sistema respiratorio y varían desde una simple bronquitis hasta una neumonía mortal . Las complicaciones respiratorias tienden a desarrollarse alrededor del octavo día de la enfermedad y pueden ser de origen viral o bacteriano. La infección bacteriana secundaria de la piel es una complicación relativamente poco común de la viruela. Cuando esto ocurre, la fiebre generalmente permanece elevada. [33]
Otras complicaciones incluyen encefalitis (1 de cada 500 pacientes), que es más común en adultos y puede causar discapacidad temporal; cicatrices permanentes, más notablemente en la cara; y complicaciones que afectan los ojos (2% de todos los casos). Se pueden formar pústulas en el párpado, la conjuntiva y la córnea , lo que lleva a complicaciones como conjuntivitis , queratitis , úlcera corneal , iritis , iridociclitis y atrofia del nervio óptico. La ceguera resulta en aproximadamente el 35-40% de los ojos afectados con queratitis y úlcera corneal. La viruela hemorrágica puede causar hemorragias subconjuntivales y retinianas . En el 2-5% de los niños pequeños con viruela, los viriones alcanzan las articulaciones y el hueso, causando osteomielitis variolosa . Las lesiones óseas son simétricas, más comunes en los codos, las piernas y característicamente causan separación de la epífisis y reacciones periósticas marcadas . Las articulaciones hinchadas limitan el movimiento y la artritis puede provocar deformidades en las extremidades, anquilosis , huesos malformados, articulaciones inestables y dedos rechonchos. [34]
Entre el 65 y el 80% de los sobrevivientes quedan marcados con cicatrices profundas (marcas de viruela), más prominentes en la cara.

La evidencia clínica creíble más antigua de la viruela se encuentra en las descripciones de enfermedades similares a la viruela en escritos médicos de la antigua India (tan temprano como 1500 a. C.), [90] [91] y China (1122 a. C.), [92] así como en un estudio de la momia egipcia de Ramsés V (fallecido en 1145 a. C.). [91] [93] Se ha especulado que los comerciantes egipcios trajeron la viruela a la India durante el primer milenio a. C., donde permaneció como una enfermedad humana endémica durante al menos 2000 años. La viruela probablemente se introdujo en China durante el siglo I d. C. desde el suroeste, y en el siglo VI se llevó de China a Japón. [3] En Japón, se cree que la epidemia de 735-737 mató a un tercio de la población. [18] [94] Al menos siete deidades religiosas han sido dedicadas específicamente a la viruela, como el dios Sopona en la religión yoruba en África occidental. En la India, la diosa hindú de la viruela, Shitala , era adorada en templos de todo el país. [95]
Un punto de vista diferente es que la viruela surgió en 1588 d. C. y los casos informados anteriormente se identificaron incorrectamente como viruela. [96] [47]
El momento de la llegada de la viruela a Europa y al suroeste de Asia no está tan claro. La viruela no está descrita con claridad ni en el Antiguo ni en el Nuevo Testamento de la Biblia ni en la literatura de los griegos o los romanos. Aunque algunos han identificado la plaga de Atenas (que se dice que se originó en « Etiopía » y Egipto) o la plaga que levantó el asedio de Siracusa por parte de Cartago en el año 396 a. C. con la viruela, [3] muchos estudiosos coinciden en que es muy poco probable que una enfermedad tan grave como la viruela mayor hubiera escapado a la descripción de Hipócrates si hubiera existido en la región mediterránea durante su vida. [42]
Aunque la peste antonina que arrasó el Imperio romano entre 165 y 180 d. C. pudo haber sido causada por la viruela, [97] San Nicasio de Reims se convirtió en el santo patrón de las víctimas de la viruela por haber sobrevivido supuestamente a un ataque en 450, [3] y San Gregorio de Tours registró un brote similar en Francia e Italia en 580, el primer uso del término variola . [3] Otros historiadores especulan que los ejércitos árabes llevaron por primera vez la viruela desde África al suroeste de Europa durante los siglos VII y VIII. [3] En el siglo IX, el médico persa Rhazes proporcionó una de las descripciones más definitivas de la viruela y fue el primero en diferenciar la viruela del sarampión y la varicela en su Kitab fi al-jadari wa-al-hasbah ( El libro de la viruela y el sarampión ). [98] Durante la Edad Media se produjeron varios brotes de viruela en Europa. Sin embargo, la viruela no se había establecido allí hasta que el crecimiento demográfico y la movilidad marcados por las Cruzadas lo permitieron. Para el siglo XVI, la viruela se había arraigado en la mayor parte de Europa, [3] donde tenía una tasa de mortalidad de hasta el 30 por ciento. Esta ocurrencia endémica de la viruela en Europa es de particular importancia histórica, ya que las sucesivas exploraciones y colonizaciones por parte de los europeos tendieron a propagar la enfermedad a otras naciones. Para el siglo XVI, la viruela se había convertido en una causa predominante de morbilidad y mortalidad en gran parte del mundo. [3]
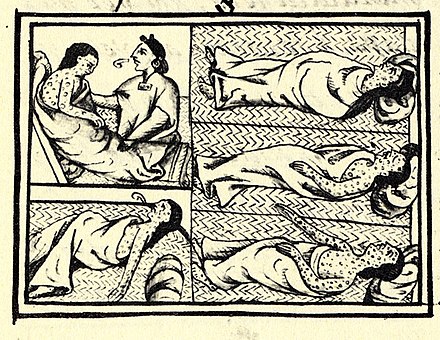
No había descripciones creíbles de enfermedades similares a la viruela en las Américas antes de la exploración hacia el oeste por los europeos en el siglo XV d.C. [45] La viruela se introdujo en la isla caribeña de La Española en 1507, y en el continente en 1520, cuando los colonos españoles de La Española llegaron a México, llevando inadvertidamente la viruela con ellos. Debido a que la población amerindia nativa no había adquirido inmunidad a esta nueva enfermedad, sus pueblos fueron diezmados por epidemias. Tal interrupción y pérdidas de población fueron un factor importante en el logro de la conquista española de los aztecas y los incas . [3] De manera similar, el asentamiento inglés de la costa este de América del Norte en 1633 en Plymouth, Massachusetts, estuvo acompañado de brotes devastadores de viruela entre las poblaciones nativas americanas, [99] y posteriormente entre los colonos nativos. [100] Las tasas de letalidad durante los brotes en las poblaciones nativas americanas fueron tan altas como el 90%. [101] La viruela se introdujo en Australia en 1789 y nuevamente en 1829, [3] aunque los cirujanos coloniales, que en 1829 estaban intentando distinguir entre la viruela y la varicela (que podía ser casi igualmente fatal para los aborígenes), estaban divididos en cuanto a si la epidemia de 1829-1830 era varicela o viruela. [102] Aunque la viruela nunca fue endémica en el continente, [3] ha sido descrita como la principal causa de muerte en las poblaciones aborígenes entre 1780 y 1870. [103]
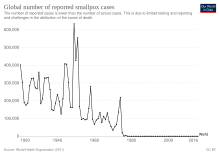

A mediados del siglo XVIII, la viruela era una enfermedad endémica importante en todo el mundo, excepto en Australia y en pequeñas islas que no habían sido exploradas por el exterior. En la Europa del siglo XVIII, la viruela era una de las principales causas de muerte, matando a unos 400.000 europeos cada año. [104] Hasta el 10 por ciento de los niños suecos morían de viruela cada año, [18] y la tasa de mortalidad infantil en Rusia podría haber sido incluso mayor. [92] El uso generalizado de la variolización en unos pocos países, en particular Gran Bretaña, sus colonias norteamericanas y China, redujo un poco el impacto de la viruela entre las clases ricas durante la última parte del siglo XVIII, pero no se produjo una reducción real de su incidencia hasta que la vacunación se convirtió en una práctica común hacia finales del siglo XIX. Las vacunas mejoradas y la práctica de la revacunación llevaron a una reducción sustancial de los casos en Europa y América del Norte, pero la viruela permaneció casi sin control en el resto del mundo. A mediados del siglo XX, la viruela menor se manifestó junto con la viruela mayor, en proporciones variables, en muchas partes de África. Los pacientes con viruela menor experimentan solo una enfermedad sistémica leve, a menudo pueden caminar durante el curso de la enfermedad y, por lo tanto, pueden transmitir la enfermedad más fácilmente. La infección con el virus de la viruela menor induce inmunidad contra la forma más mortal de la viruela mayor. Por lo tanto, a medida que la viruela menor se extendió por todo Estados Unidos, Canadá, los países sudamericanos y Gran Bretaña, se convirtió en la forma dominante de viruela, lo que redujo aún más las tasas de mortalidad. [3]
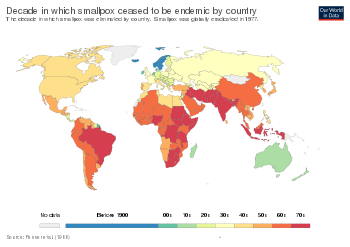
La primera referencia clara a la inoculación de la viruela la hizo el autor chino Wan Quan (1499-1582) en su Dòuzhěn xīnfǎ (痘疹心法, "Enseñanzas sobre la erupción de la viruela") publicada en 1549, [105] con los primeros indicios de la práctica en China durante el siglo X. [106] En China, se soplaban costras de viruela en polvo en las narices de las personas sanas. Las personas desarrollaban entonces un caso leve de la enfermedad y a partir de entonces eran inmunes a ella. La técnica tenía una tasa de mortalidad del 0,5 al 2,0 %, pero era considerablemente menor que la tasa de mortalidad del 20 al 30 % de la enfermedad en sí. La Royal Society de Londres recibió dos informes sobre la práctica china de la inoculación en 1700: uno del Dr. Martin Lister , que recibió un informe de un empleado de la Compañía de las Indias Orientales destinado en China, y otro de Clopton Havers . [107] Voltaire (1742) informa que los chinos habían practicado la inoculación de la viruela "durante estos cien años". [75] La variolización también había sido presenciada en Turquía por Lady Mary Wortley Montagu , quien más tarde la introdujo en el Reino Unido. [108]
Una de las primeras menciones a la posibilidad de erradicar la viruela se hizo en referencia al trabajo de Johnnie Notions , un inoculador autodidacta de Shetland , Escocia. Notions tuvo éxito en el tratamiento de personas desde al menos finales de la década de 1780 a través de un método ideado por él mismo a pesar de no tener formación médica formal. [109] [110] Su método implicaba exponer el pus de la viruela al humo de turba , enterrándolo en el suelo con alcanfor durante hasta 8 años y luego insertando la materia en la piel de una persona con un cuchillo y cubriendo la incisión con una hoja de col. [111] Se decía que no había perdido ni un solo paciente. [111] Arthur Edmondston , en escritos sobre la técnica de Notions que se publicaron en 1809, afirmó: "Si todos los practicantes hubieran tenido tanto éxito en la enfermedad como él, la viruela podría haber sido desterrada de la faz de la tierra, sin dañar el sistema ni dejar ninguna duda sobre el hecho". [112]

El médico inglés Edward Jenner demostró la eficacia de la viruela bovina para proteger a los humanos de la viruela en 1796, tras lo cual se hicieron varios intentos para eliminar la viruela a escala regional. En Rusia, en 1796, el primer niño que recibió este tratamiento recibió el nombre de "Vaccinov" de manos de Catalina la Grande y fue educado a expensas de la nación. [113]
La introducción de la vacuna al Nuevo Mundo tuvo lugar en Trinity, Terranova en 1800 por el Dr. John Clinch , amigo de la infancia y colega médico de Jenner. [114] Ya en 1803, la Corona española organizó la expedición Balmis para transportar la vacuna a las colonias españolas en América y Filipinas, y establecer allí programas de vacunación masiva. [115] El Congreso de los Estados Unidos aprobó la Ley de Vacunas de 1813 para garantizar que la vacuna segura contra la viruela estuviera disponible para el público estadounidense. Hacia 1817, existía un sólido programa estatal de vacunación en las Indias Orientales Holandesas . [116]
El 26 de agosto de 1807, Baviera se convirtió en el primer país del mundo en introducir la vacunación obligatoria. Le siguió Baden en 1809, Prusia en 1815, Württemberg en 1818, Suecia en 1816 y el Imperio alemán en 1874 a través de la Ley de Vacunación del Reich. [117] [118] En la Suecia luterana, el clero protestante desempeñó un papel pionero en la vacunación voluntaria contra la viruela ya en 1800. [119] La primera vacunación se llevó a cabo en Liechtenstein en 1801, y a partir de 1812 fue obligatoria. [120]
En la India británica se puso en marcha un programa para propagar la vacunación contra la viruela, a través de vacunadores indios, bajo la supervisión de funcionarios europeos. [121] Sin embargo, los esfuerzos de vacunación británicos en la India, y en Birmania en particular, se vieron obstaculizados por la preferencia indígena por la inoculación y la desconfianza en la vacunación, a pesar de una legislación estricta, las mejoras en la eficacia local de la vacuna y el conservante de la vacuna, y los esfuerzos de educación. [122] En 1832, el gobierno federal de los Estados Unidos estableció un programa de vacunación contra la viruela para los nativos americanos . [123] En 1842, el Reino Unido prohibió la inoculación, progresando más tarde a la vacunación obligatoria . El gobierno británico introdujo la vacunación obligatoria contra la viruela mediante una ley del Parlamento en 1853. [124]
En los Estados Unidos, entre 1843 y 1855, primero Massachusetts y luego otros estados exigieron la vacunación contra la viruela. Aunque a algunos no les gustaban estas medidas, [92] se siguieron realizando esfuerzos coordinados contra la viruela y la enfermedad siguió disminuyendo en los países ricos. En el norte de Europa, varios países habían eliminado la viruela en 1900 y, en 1914, la incidencia en la mayoría de los países industrializados había disminuido a niveles comparativamente bajos.
La vacunación continuó en los países industrializados como protección contra la reintroducción hasta mediados y fines de la década de 1970. Australia y Nueva Zelanda son dos excepciones notables: ninguno de ellos experimentó viruela endémica y nunca se vacunó ampliamente, recurriendo en cambio a la protección por distancia y a cuarentenas estrictas. [125]

El primer esfuerzo hemisférico para erradicar la viruela fue realizado en 1950 por la Organización Panamericana de la Salud . [126] La campaña tuvo éxito en eliminar la viruela de todos los países de las Américas excepto Argentina, Brasil, Colombia y Ecuador. [125] En 1958, el profesor Viktor Zhdanov , viceministro de Salud de la URSS , pidió a la Asamblea Mundial de la Salud que emprendiera una iniciativa mundial para erradicar la viruela. [127] La propuesta (Resolución WHA11.54) fue aceptada en 1959. [127] En este punto, 2 millones de personas morían de viruela cada año. En general, el progreso hacia la erradicación fue decepcionante, especialmente en África y en el subcontinente indio . En 1966 se formó un equipo internacional, la Unidad de Erradicación de la Viruela, bajo el liderazgo de un estadounidense, Donald Henderson . [127] En 1967, la Organización Mundial de la Salud intensificó la erradicación mundial de la viruela aportando 2,4 millones de dólares anuales al esfuerzo y adoptó el nuevo método de vigilancia de la enfermedad promovido por el epidemiólogo checo Karel Raška . [128]
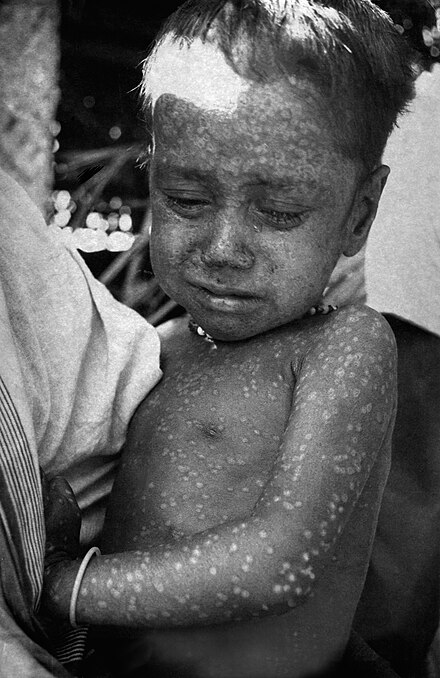
A principios de la década de 1950, se calculaba que se producían en el mundo unos 50 millones de casos de viruela al año. [10] Para erradicar la viruela, había que detener la propagación de cada brote mediante el aislamiento de los casos y la vacunación de todas las personas que vivían cerca. [129] Este proceso se conoce como "vacunación en anillo". La clave de esta estrategia era el seguimiento de los casos en una comunidad (conocido como vigilancia) y la contención.
El problema inicial al que se enfrentó el equipo de la OMS fue la notificación inadecuada de los casos de viruela, ya que muchos casos no llegaban a conocimiento de las autoridades. El hecho de que los seres humanos sean el único reservorio de la infección de viruela (el virus sólo infecta a los seres humanos y no a otros animales) y que no existieran portadores desempeñó un papel importante en la erradicación de la viruela. La OMS estableció una red de consultores que ayudaron a los países a establecer actividades de vigilancia y contención. Al principio, las donaciones de vacunas procedían principalmente de la Unión Soviética y los Estados Unidos, pero en 1973, más del 80 por ciento de todas las vacunas se producían en países en desarrollo. [125] La Unión Soviética proporcionó mil quinientos millones de dosis entre 1958 y 1979, así como el personal médico. [130]
El último brote importante de viruela en Europa se produjo en 1972 en Yugoslavia , después de que un peregrino de Kosovo regresara de Oriente Medio, donde había contraído el virus. La epidemia infectó a 175 personas y causó 35 muertes. Las autoridades declararon la ley marcial , impusieron cuarentena y emprendieron una revacunación generalizada de la población, con la ayuda de la OMS. En dos meses, el brote había terminado. [131] Antes de esto, había habido un brote de viruela en mayo-julio de 1963 en Estocolmo , Suecia, traído del Lejano Oriente por un marinero sueco; esto se había abordado con medidas de cuarentena y vacunación de la población local. [132]

A finales de 1975, la viruela persistía sólo en el Cuerno de África . Las condiciones eran muy difíciles en Etiopía y Somalia , donde había pocas carreteras. La guerra civil, la hambruna y los refugiados hicieron que la tarea fuera aún más difícil. A principios y mediados de 1977 se emprendió en estos países un programa intensivo de vigilancia, contención y vacunación, bajo la dirección del microbiólogo australiano Frank Fenner . A medida que la campaña se acercaba a su objetivo, Fenner y su equipo desempeñaron un papel importante en la verificación de la erradicación. [134] El último caso natural de viruela autóctona ( Variola minor ) se diagnosticó en Ali Maow Maalin , un cocinero de hospital en Merca, Somalia , el 26 de octubre de 1977. [33] El último caso natural de la más mortal Variola major se había detectado en octubre de 1975 en una niña bangladesí de tres años , Rahima Banu . [40]
La erradicación mundial de la viruela fue certificada, sobre la base de intensas actividades de verificación, por una comisión de científicos eminentes el 9 de diciembre de 1979 y posteriormente refrendada por la Asamblea Mundial de la Salud el 8 de mayo de 1980. [10] [135] Las dos primeras frases de la resolución dicen:
Habiendo examinado el desarrollo y los resultados del programa mundial de erradicación de la viruela iniciado por la OMS en 1958 e intensificado desde 1967… Declara solemnemente que el mundo y sus pueblos han conseguido liberarse de la viruela, que fue una enfermedad sumamente devastadora que se extendió en forma epidémica por muchos países desde los tiempos más remotos, dejando tras sí muerte, ceguera y desfiguración y que hace sólo un decenio estaba muy extendida en África, Asia y Sudamérica. [136]
El costo de las iniciativas de erradicación, de 1967 a 1979, fue de aproximadamente 300 millones de dólares. Aproximadamente un tercio provino del mundo desarrollado, que había erradicado en gran medida la viruela décadas antes. Se dice que Estados Unidos, el mayor contribuyente al programa, ha recuperado esa inversión cada 26 días desde entonces, con dinero que no se gastó en vacunas y en los costos de la incidencia. [137]

El último caso de viruela en el mundo ocurrió en un brote en el Reino Unido en 1978. [ 138] Una fotógrafa médica, Janet Parker, contrajo la enfermedad en la Facultad de Medicina de la Universidad de Birmingham y murió el 11 de septiembre de 1978. Aunque no ha quedado claro cómo se infectó Parker, se estableció que la fuente de la infección fue el virus variola cultivado con fines de investigación en el laboratorio de la Facultad de Medicina. [139] [140] Todas las existencias conocidas de viruela en todo el mundo fueron posteriormente destruidas o transferidas a dos laboratorios de referencia designados por la OMS con instalaciones BSL-4 : los Centros para el Control y la Prevención de Enfermedades (CDC) de los Estados Unidos y el Centro de Investigación Estatal de Virología y Biotecnología VECTOR de la Unión Soviética (ahora Rusia) . [141]
La OMS recomendó por primera vez la destrucción del virus en 1986 y más tarde fijó la fecha de destrucción para el 30 de diciembre de 1993. Esto se pospuso al 30 de junio de 1999. [142] Debido a la resistencia de los EE. UU. y Rusia, en 2002 la Asamblea Mundial de la Salud acordó permitir la retención temporal de las reservas de virus para fines de investigación específicos. [143] La destrucción de las reservas existentes reduciría el riesgo que implica la investigación en curso sobre la viruela; las reservas no son necesarias para responder a un brote de viruela. [144] Algunos científicos han argumentado que las reservas pueden ser útiles para desarrollar nuevas vacunas, medicamentos antivirales y pruebas de diagnóstico; [145] una revisión de 2010 por un equipo de expertos en salud pública designados por la OMS concluyó que no se cumple ningún propósito esencial de salud pública si los EE. UU. y Rusia continúan reteniendo reservas de virus. [146] Esta última opinión es apoyada con frecuencia en la comunidad científica, en particular entre los veteranos del Programa de Erradicación de la Viruela de la OMS. [147]
El 31 de marzo de 2003, se encontraron costras de viruela dentro de un sobre en un libro de 1888 sobre medicina de la Guerra Civil en Santa Fe, Nuevo México . [148] El sobre estaba etiquetado como que contenía costras de una vacuna y dio a los científicos del CDC la oportunidad de estudiar la historia de la vacunación contra la viruela en los Estados Unidos.
El 1 de julio de 2014, se descubrieron seis frascos de vidrio sellados con viruela fechados en 1954, junto con frascos de muestra de otros patógenos, en una cámara de almacenamiento en frío en un laboratorio de la FDA en los Institutos Nacionales de Salud en Bethesda, Maryland . Los frascos de viruela fueron posteriormente transferidos a la custodia de los CDC en Atlanta, donde el virus tomado de al menos dos frascos resultó viable en cultivo. [149] [150] Después de que se realizaron los estudios, los CDC destruyeron el virus bajo observación de la OMS el 24 de febrero de 2015. [151]
En 2017, científicos de la Universidad de Alberta recrearon un virus extinto de la viruela equina para demostrar que el virus variólico puede ser recreado en un pequeño laboratorio a un costo de aproximadamente $100,000, por un equipo de científicos sin conocimientos especializados. [152] Esto hace que la controversia sobre la retención sea irrelevante ya que el virus puede ser recreado fácilmente incluso si se destruyen todas las muestras. Aunque los científicos realizaron la investigación para ayudar al desarrollo de nuevas vacunas, así como para rastrear la historia de la viruela, la posibilidad de que las técnicas se utilizaran con fines nefastos se reconoció de inmediato, lo que planteó preguntas sobre la investigación y las regulaciones de doble uso . [153] [154]
En septiembre de 2019, el laboratorio ruso que albergaba muestras de viruela sufrió una explosión de gas que hirió a un trabajador. No ocurrió cerca del área de almacenamiento del virus y no se comprometió ninguna muestra, pero el incidente motivó una revisión de los riesgos para la contención. [155]
In 1763, Pontiac's War broke out as a Native American confederacy led by Pontiac attempted to counter British control over the Great Lakes region.[156][157][158] A group of Native American warriors laid siege to British-held Fort Pitt on June 22.[159] In response, Henry Bouquet, the commander of the fort, ordered his subordinate Simeon Ecuyer to give smallpox-infested blankets from the infirmary to a Delaware delegation outside the fort. Bouquet had discussed this with his superior, Sir Jeffrey Amherst, who wrote to Bouquet stating: "Could it not be contrived to send the small pox among the disaffected tribes of Indians? We must on this occasion use every stratagem in our power to reduce them." Bouquet agreed with the proposal, writing back that "I will try to inocculate [sic] the Indians by means of Blankets that may fall in their hands".[160] On 24 June 1763, William Trent, a local trader and commander of the Fort Pitt militia, wrote, "Out of our regard for them, we gave them two Blankets and an Handkerchief out of the Small Pox Hospital. I hope it will have the desired effect."[161][156] The effectiveness of this effort to broadcast the disease is unknown. There are also accounts that smallpox was used as a weapon during the American Revolutionary War (1775–1783).[162][163]
According to a theory put forward in Journal of Australian Studies (JAS) by independent researcher Christopher Warren, Royal Marines used smallpox in 1789 against indigenous tribes in New South Wales.[164] This theory was also considered earlier in Bulletin of the History of Medicine[165] and by David Day.[166] However it is disputed by some medical academics, including Professor Jack Carmody, who in 2010 claimed that the rapid spread of the outbreak in question was more likely indicative of chickenpox – a more infectious disease which, at the time, was often confused, even by surgeons, with smallpox, and may have been comparably deadly to Aborigines and other peoples without natural immunity to it.[167] Carmody noted that in the 8-month voyage of the First Fleet and the following 14 months there were no reports of smallpox amongst the colonists and that, since smallpox has an incubation period of 10–12 days, it is unlikely it was present in the First Fleet; however, Warren argued in the JAS article that the likely source was bottles of variola virus possessed by First Fleet surgeons. Ian and Jennifer Glynn, in The life and death of smallpox, confirm that bottles of "variolous matter" were carried to Australia for use as a vaccine, but think it unlikely the virus could have survived till 1789.[103] In 2007, Christopher Warren offered evidence that the British smallpox may have been still viable.[168] However, the only non-Aborigine reported to have died in this outbreak was a seaman called Joseph Jeffries, who was recorded as being of "American Indian" origin.[169]
W. S. Carus, an expert in biological weapons, has written that there is circumstantial evidence that smallpox was deliberately introduced to the Aboriginal population.[170] However Carmody and the Australian National University's Boyd Hunter continue to support the chickenpox hypothesis.[171] In a 2013 lecture at the Australian National University,[172] Carmody pointed out that chickenpox, unlike smallpox, was known to be present in the Sydney Cove colony. He also suggested that all c. 18th century (and earlier) identifications of smallpox outbreaks were dubious because: "surgeons … would have been unaware of the distinction between smallpox and chickenpox – the latter having traditionally been considered a milder form of smallpox."[173]
During World War II, scientists from the United Kingdom, United States, and Japan (Unit 731 of the Imperial Japanese Army) were involved in research into producing a biological weapon from smallpox.[174] Plans of large scale production were never carried through as they considered that the weapon would not be very effective due to the wide-scale availability of a vaccine.[162]
In 1947, the Soviet Union established a smallpox weapons factory in the city of Zagorsk, 75 km to the northeast of Moscow.[175] An outbreak of weaponized smallpox occurred during testing at a facility on an island in the Aral Sea in 1971. General Prof. Peter Burgasov, former Chief Sanitary Physician of the Soviet Army and a senior researcher within the Soviet program of biological weapons, described the incident:
On Vozrozhdeniya Island in the Aral Sea, the strongest recipes of smallpox were tested. Suddenly I was informed that there were mysterious cases of mortalities in Aralsk. A research ship of the Aral fleet came to within 15 km of the island (it was forbidden to come any closer than 40 km). The lab technician of this ship took samples of plankton twice a day from the top deck. The smallpox formulation – 400 gr. of which was exploded on the island – "got her" and she became infected. After returning home to Aralsk, she infected several people including children. All of them died. I suspected the reason for this and called the Chief of General Staff of the Ministry of Defense and requested to forbid the stop of the Alma-Ata–Moscow train in Aralsk. As a result, the epidemic around the country was prevented. I called Andropov, who at that time was Chief of KGB, and informed him of the exclusive recipe of smallpox obtained on Vozrazhdenie Island.[176][177]
Others contend that the first patient may have contracted the disease while visiting Uyaly or Komsomolsk-on-Ustyurt, two cities where the boat docked.[178][179]
Responding to international pressures, in 1991 the Soviet government allowed a joint U.S.–British inspection team to tour four of its main weapons facilities at Biopreparat. The inspectors were met with evasion and denials from the Soviet scientists and were eventually ordered out of the facility.[180] In 1992, Soviet defector Ken Alibek alleged that the Soviet bioweapons program at Zagorsk had produced a large stockpile – as much as twenty tons – of weaponized smallpox (possibly engineered to resist vaccines, Alibek further alleged), along with refrigerated warheads to deliver it. Alibek's stories about the former Soviet program's smallpox activities have never been independently verified.
In 1997, the Russian government announced that all of its remaining smallpox samples would be moved to the Vector Institute in Koltsovo.[180] With the breakup of the Soviet Union and unemployment of many of the weapons program's scientists, U.S. government officials have expressed concern that smallpox and the expertise to weaponize it may have become available to other governments or terrorist groups who might wish to use virus as means of biological warfare.[181] Specific allegations made against Iraq in this respect proved to be false.[182]

Famous historical figures who contracted smallpox include Lakota Chief Sitting Bull, Ramses V,[183] the Kangxi Emperor (survived), Shunzhi Emperor and Tongzhi Emperor of China, Emperor Komei of Japan (died of smallpox in 1867), and Date Masamune of Japan (who lost an eye to the disease). Cuitláhuac, the 10th tlatoani (ruler) of the Aztec city of Tenochtitlan, died of smallpox in 1520, shortly after its introduction to the Americas, and the Incan emperor Huayna Capac died of it in 1527 (causing a civil war of succession in the Inca empire and the eventual conquest by the Spaniards). More recent public figures include Guru Har Krishan, 8th Guru of the Sikhs, in 1664, Louis I of Spain in 1724 (died), Peter II of Russia in 1730 (died),[184] George Washington (survived), Louis XV of France in 1774 (died) and Maximilian III Joseph of Bavaria in 1777 (died).
Prominent families throughout the world often had several people infected by and/or perish from the disease. For example, several relatives of Henry VIII of England survived the disease but were scarred by it. These include his sister Margaret, his wife Anne of Cleves, and his two daughters: Mary I in 1527 and Elizabeth I in 1562. Elizabeth tried to disguise the pockmarks with heavy makeup. Mary, Queen of Scots, contracted the disease as a child but had no visible scarring.
In Europe, deaths from smallpox often changed dynastic succession. Louis XV of France succeeded his great-grandfather Louis XIV through a series of deaths of smallpox or measles among those higher in the succession line. He himself died of the disease in 1774. Peter II of Russia died of the disease at 14 years of age. Also, before becoming emperor, Peter III of Russia caught the virus and suffered greatly from it.[citation needed] He was left scarred and disfigured. His wife, Catherine the Great, was spared but fear of the virus clearly had its effects on her. She feared for the safety of her son, Paul, so much that she made sure that large crowds were kept at bay and sought to isolate him. Eventually, she decided to have herself inoculated by a British doctor, Thomas Dimsdale. While this was considered a controversial method at the time, she succeeded. Paul was later inoculated as well. Catherine then sought to have inoculations throughout her empire stating: "My objective was, through my example, to save from death the multitude of my subjects who, not knowing the value of this technique, and frightened of it, were left in danger." By 1800, approximately two million inoculations had been administered in the Russian Empire.[185]
In China, the Qing dynasty had extensive protocols to protect Manchus from Peking's endemic smallpox.
U.S. Presidents George Washington, Andrew Jackson, and Abraham Lincoln all contracted and recovered from the disease. Washington became infected with smallpox on a visit to Barbados in 1751.[186] Jackson developed the illness after being taken prisoner by the British during the American Revolution, and though he recovered, his brother Robert did not.[186] Lincoln contracted the disease during his presidency, possibly from his son Tad, and was quarantined shortly after giving the Gettysburg address in 1863.[186]
The famous theologian Jonathan Edwards died of smallpox in 1758 following an inoculation.[187]
Soviet leader Joseph Stalin fell ill with smallpox at the age of seven. His face was badly scarred by the disease. He later had photographs retouched to make his pockmarks less apparent.[188]
Hungarian poet Ferenc Kölcsey, who wrote the Hungarian national anthem, lost his right eye to smallpox.[189]

In the face of the devastation of smallpox, various smallpox gods and goddesses have been worshipped throughout parts of the Old World, for example in China and India. In China, the smallpox goddess was referred to as T'ou-Shen Niang-Niang (Chinese: 痘疹娘娘).[190] Chinese believers actively worked to appease the goddess and pray for her mercy, by such measures as referring to smallpox pustules as "beautiful flowers" as a euphemism intended to avert offending the goddess, for example (the Chinese word for smallpox is 天花, literally "heaven flower").[191] In a related New Year's Eve custom it was prescribed that the children of the house wear ugly masks while sleeping, so as to conceal any beauty and thereby avoid attracting the goddess, who would be passing through sometime that night.[191] If a case of smallpox did occur, shrines would be set up in the homes of the victims, to be worshipped and offered to as the disease ran its course. If the victim recovered, the shrines were removed and carried away in a special paper chair or boat for burning. If the patient did not recover, the shrine was destroyed and cursed, to expel the goddess from the house.[190]
In the Yoruba language smallpox is known as ṣọpọná, but it was also written as shakpanna, shopona, ṣhapana, and ṣọpọnọ. The word is a combination of 3 words, the verb ṣán, meaning to cover or plaster (referring to the pustules characteristic of smallpox), kpa or pa, meaning to kill, and enia, meaning human. Roughly translated, it means One who kills a person by covering them with pustules.[192] Among the Yorùbá people of West Africa, and also in Dahomean religion, Trinidad, and in Brazil, The deity Sopona, also known as Obaluaye, is the deity of smallpox and other deadly diseases (like leprosy, HIV/AIDS, and fevers). One of the most feared deities of the orisha pantheon, smallpox was seen as a form of punishment from Shopona.[193] Worship of Shopona was highly controlled by his priests, and it was believed that priests could also spread smallpox when angered.[193] However, Shopona was also seen as a healer who could cure the diseases he inflicted, and he was often called upon by his victims to heal them.[194] The British government banned the worship of the god because it was believed his priests were purposely spreading smallpox to their opponents.[194][193]
India's first records of smallpox can be found in a medical book that dates back to 400 CE. This book describes a disease that sounds exceptionally like smallpox.[191] India, like China and the Yorùbá, created a goddess in response to its exposure to smallpox. The Hindu goddess Shitala was both worshipped and feared during her reign. It was believed that this goddess was both evil and kind and had the ability to inflict victims when angered, as well as calm the fevers of the already affected.[195][92] Portraits of the goddess show her holding a broom in her right hand to continue to move the disease and a pot of cool water in the other hand in an attempt to soothe patients.[191] Shrines were created where many Indian natives, both healthy and not, went to worship and attempt to protect themselves from this disease. Some Indian women, in an attempt to ward off Shitala, placed plates of cooling foods and pots of water on the roofs of their homes.[196]
In cultures that did not recognize a smallpox deity, there was often nonetheless a belief in smallpox demons, who were accordingly blamed for the disease. Such beliefs were prominent in Japan, Europe, Africa, and other parts of the world. Nearly all cultures who believed in the demon also believed that it was afraid of the color red. This led to the invention of the so-called red treatment, where patients and their rooms would be decorated in red. The practice spread to Europe in the 12th century and was practiced by (among others) Charles V of France and Elizabeth I of England.[3] Afforded scientific credibility through the studies by Niels Ryberg Finsen showing that red light reduced scarring,[3] this belief persisted even until the 1930s.
the rarity of smallpox transmission via fomites suggests that mucosal exposure was not the primary means of transmission and is consistent with a preference for infection via the lower respiratory tract. The rarity of transmission on crowded buses and trains could be evidence that airborne transmission was not important. However, Fenner et al. (1988) state that transmission on public transport was rare because patients seldom traveled after becoming ill.
{{cite journal}}: Cite journal requires |journal= (help){{cite journal}}: Cite journal requires |journal= (help){{cite book}}: CS1 maint: others (link)With a foreword by Joseph Needham
{{citation}}: CS1 maint: multiple names: authors list (link){{cite book}}: CS1 maint: location (link)Slide 16–17