En química de coordinación , un enlace covalente coordinado , [1] también conocido como enlace dativo , [2] enlace dipolar , [1] o enlace coordinado [3] es un tipo de enlace covalente de dos centros y dos electrones en el que los dos electrones derivan del mismo átomo . La unión de iones metálicos a ligandos implica este tipo de interacción. [4] Este tipo de interacción es fundamental para la teoría ácido-base de Lewis .
Los enlaces coordinados se encuentran comúnmente en compuestos de coordinación . [5]

El enlace covalente coordinado es omnipresente. [6] En todos los complejos acuosos metálicos [M(H 2 O) n ] m + , el enlace entre el agua y el catión metálico se describe como un enlace covalente coordinado. Las interacciones metal-ligando en la mayoría de los compuestos organometálicos y la mayoría de los compuestos de coordinación se describen de manera similar.
El término enlace dipolar se utiliza en química orgánica para compuestos como los óxidos de amina , cuya estructura electrónica se puede describir en términos de la amina básica que dona dos electrones a un átomo de oxígeno.
La flecha → indica que ambos electrones en el enlace se originan de la porción amina . En un enlace covalente estándar, cada átomo aporta un electrón. Por lo tanto, una descripción alternativa es que la amina cede un electrón al átomo de oxígeno, que luego se utiliza, con el electrón desapareado restante en el átomo de nitrógeno, para formar un enlace covalente estándar. El proceso de transferencia del electrón del nitrógeno al oxígeno crea cargas formales , por lo que la estructura electrónica también puede representarse como
Esta estructura electrónica tiene un dipolo eléctrico , de ahí el nombre de enlace polar. En realidad, los átomos llevan cargas parciales ; el átomo más electronegativo de los dos involucrados en el enlace normalmente llevará una carga negativa parcial. Una excepción a esto es el monóxido de carbono . En este caso, el átomo de carbono lleva la carga negativa parcial aunque es menos electronegativo que el oxígeno.
Un ejemplo de enlace covalente dativo lo constituye la interacción entre una molécula de amoniaco , una base de Lewis con un par solitario de electrones en el átomo de nitrógeno, y el trifluoruro de boro , un ácido de Lewis en virtud de que el átomo de boro tiene un octeto incompleto de electrones. Al formar el aducto, el átomo de boro alcanza una configuración de octeto.
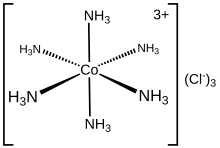
La estructura electrónica de un complejo de coordinación se puede describir en términos del conjunto de ligandos , cada uno de los cuales dona un par de electrones a un centro metálico. Por ejemplo, en el cloruro de hexamminocobalto(III) , cada ligando de amoníaco dona su par solitario de electrones al ion cobalto(III). En este caso, los enlaces formados se describen como enlaces coordinados. En el método de clasificación de enlaces covalentes (CBC), los ligandos que forman enlaces covalentes coordinados con un átomo central se clasifican como de tipo L, mientras que los que forman enlaces covalentes normales se clasifican como de tipo X.
En todos los casos, el enlace, ya sea dativo o de intercambio de electrones "normal", es un enlace covalente. En el uso común, el prefijo dipolar, dativo o coordinado simplemente sirve para indicar el origen de los electrones utilizados en la creación del enlace. Por ejemplo, F 3 B ← O(C 2 H 5 ) 2 (" eterato de trifluoruro de boro (dietil) ") se prepara a partir de BF 3 y : O(C 2 H 5 ) 2 , en oposición a las especies radicales [•BF 3 ] – y [•O(C 2 H 5 ) 2 ] + . El enlace dativo también es una conveniencia en términos de notación, ya que se evitan las cargas formales: podemos escribir D : + []A ⇌ D → A en lugar de D + –A – (aquí : y [] representan el par solitario y el orbital vacío en el donante de pares de electrones D y el aceptor A, respectivamente). La notación se utiliza a veces incluso cuando la reacción ácido-base de Lewis implicada es solo nocional (por ejemplo, el sulfóxido R 2 S → O rara vez se forma haciendo reaccionar el sulfuro R 2 S con oxígeno atómico O). Por lo tanto, la mayoría de los químicos no hacen ninguna afirmación con respecto a las propiedades del enlace cuando eligen una notación sobre la otra (cargas formales vs. enlace de flecha).
Sin embargo, es generalmente cierto que los enlaces representados de esta manera son covalentes polares, a veces fuertemente covalentes, y algunos autores afirman que existen diferencias genuinas en las propiedades de un enlace dativo y un enlace que comparte electrones y sugieren que mostrar un enlace dativo es más apropiado en situaciones particulares. Ya en 1989, Haaland caracterizó los enlaces dativos como enlaces que son (i) débiles y largos; (ii) con solo un pequeño grado de transferencia de carga que tiene lugar durante la formación del enlace; y (iii) cuyo modo preferido de disociación en la fase gaseosa (o disolvente inerte de bajo ε) es heterolítico en lugar de homolítico. [7] El aducto amoniaco-borano (H 3 N → BH 3 ) se da como un ejemplo clásico: el enlace es débil, con una energía de disociación de 31 kcal/mol (cf. 90 kcal/mol para el etano), y largo, a 166 pm (cf. 153 pm para el etano), y la molécula posee un momento dipolar de 5,2 D que implica una transferencia de solo 0,2 e– del nitrógeno al boro. Se estima que la disociación heterolítica de H 3 N → BH 3 requiere 27 kcal/mol, lo que confirma que la heterólisis en amoniaco y borano es más favorable que la homólisis en catión radical y anión radical. Sin embargo, además de ejemplos claros, existe una considerable disputa en cuanto a cuándo un compuesto en particular califica y, por lo tanto, la prevalencia general del enlace dativo (con respecto a la definición preferida de un autor). Los químicos computacionales han sugerido criterios cuantitativos para distinguir entre los dos "tipos" de enlace. [8] [9] [10]
Algunos ejemplos no obvios en los que se afirma que el enlace dativo es importante incluyen el subóxido de carbono (O≡C → C 0 ← C≡O), los tetraaminoalenos (descritos utilizando el lenguaje del enlace dativo como "carbodicarbenos"; (R 2 N) 2 C → C 0 ← C(NR 2 ) 2 ), el carbodifosforano de Ramírez (Ph 3 P → C 0 ← PPh 3 ), y el catión bis(trifenilfosfina)iminio (Ph 3 P → N + ← PPh 3 ), todos los cuales exhiben geometrías de equilibrio considerablemente dobladas, aunque con una barrera superficial a la flexión. La simple aplicación de las reglas normales para dibujar estructuras de Lewis maximizando el enlace (utilizando enlaces que comparten electrones) y minimizando las cargas formales predeciría estructuras de heterocumuleno , y por lo tanto geometrías lineales, para cada uno de estos compuestos. Por lo tanto, se afirma que estas moléculas se modelan mejor como complejos de coordinación de : C : (carbono (0) o carbone ) o : N : + (catión mononitrógeno) con CO, PPh 3 o N- heterocíclicocarbenos como ligandos, siendo los pares solitarios en el átomo central los que explican la geometría doblada. Sin embargo, la utilidad de este punto de vista es discutida. [9] [10]