La reacción de descarbonilación de Tsuji-Wilkinson es un método para la descarbonilación de aldehídos y algunos cloruros de acilo . El nombre de la reacción reconoce a Jirō Tsuji , cuyo equipo informó por primera vez sobre el uso del catalizador de Wilkinson (RhCl(PPh 3 ) 3 ) para estas reacciones:
Aunque la descarbonilación puede efectuarse mediante varios complejos de metales de transición , el catalizador de Wilkinson ha demostrado ser el más eficaz. [1]
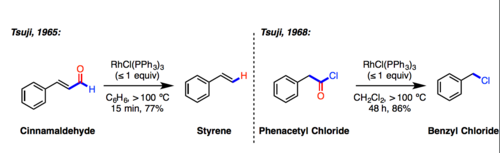
Estrictamente hablando, esta reacción da como resultado la formación de un complejo de carbonilo de rodio en lugar de monóxido de carbono libre.
Se supone que el ciclo catalítico implica la adición oxidativa del aldehído (o cloruro de ácido) para dar un intermedio de hidruro de Rh(III) de acilo 16e, que sufre una extrusión migratoria de CO y procede a formar un complejo de carbonilo de Rh(III) d6 de 18 electrones. La eliminación reductora produce el producto descarbonilado. En la variante catalítica de la descarbonilación de Tsuji-Wilkinson, RhCl(CO)(PPh 3 ) 2 desprende CO por encima de los 200 °C, regenerando así RhCl(PPh 3 ) n . De lo contrario, el mecanismo de reacción se detiene por la formación de este complejo de carbonilo termodinámicamente estable. [2]
La descarbonilación de Tsuji-Wilkinson se produce en condiciones suaves y es altamente estereoespecífica . Además de los aldehídos alifáticos, aromáticos y α,β-insaturados, los acilnitrilos y las 1,2-dicetonas también son sustratos adecuados. Existen pocos métodos para la descarbonilación.
Una aplicación ilustrativa es la síntesis del núcleo central de FR-900482. [3] Nótese que el éster no se ve afectado por el reactivo de rodio.

La descarbonilación de Tsuji-Wilkinson se emplea en el penúltimo paso de la síntesis de (–)-presilphiperfolan-8-ol. [4] Comentan: “Cabe destacar que en estos pasos finales, los pasos separados de reducción y oxidación se llevaron a cabo con un rendimiento inferior en la generación de 38 (70% versus 93%), mientras que la operación Rh(PPh3 ) 3Cl se llevó a cabo sin problemas cuando se realizó a pequeña escala (~15 mg). En total, la síntesis requirió 13 pasos a partir de material de partida comercial, y se prepararon ~15 mg de [(–)-presilphiperfolan-8-ol] con propiedades espectrales y rotaciones ópticas que coinciden con las del aislado natural”.

Desafortunadamente, la descarbonilación de Tsuji-Wilkinson es estequiométrica. El producto cloruro de carbonilo de bis(trifenilfosfina)rodio no se convierte fácilmente en un reactivo libre de CO. Por encima de los 200 °C, el monóxido de carbono RhCl(CO)(PPh 3 ) 2 se descarbonila, [2] sin embargo, estas altas temperaturas suelen ser prohibitivas. La descarbonilación ideal de Tsuji-Wilkinson sería mediante catalítica a temperaturas cercanas a la temperatura ambiente.
La reacción se ha llevado a cabo en condiciones de flujo a bajas temperaturas en las que se desarrolló una descarbonilación en flujo bifásico líquido-gas empleando N 2 como gas portador. [5] Sin embargo, la temperatura requerida para esta reacción es de 200 °C.

Se han logrado mejoras significativas en la descarbonilación de Tsuji-Wilkinson mediante el uso de complejos catiónicos de rodio con bisfosfinas quelantes. [6]