El proceso Raschig-Hooker es un proceso químico para la producción de clorobenceno y fenol . [1] [2]
El proceso Raschig-Hooker fue patentado por Friedrich Raschig , un químico y político alemán también conocido por el proceso Raschig , el proceso Olin Raschig y el anillo Raschig . [3] Comenzó a utilizar esta reacción en 1891 para fabricar fenol.
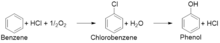
Los pasos principales de este proceso son la producción de clorobenceno a partir de benceno , ácido clorhídrico y oxígeno , y la posterior hidrólisis de clorobenceno a fenol. [4] El primer paso utiliza un catalizador de cloruro de cobre o hierro y expone los materiales al aire a 200–250 °C. [5] [6] [7] [8] En el segundo paso, el clorobenceno resultante se introduce en vapor a 450 °C sobre un catalizador de silicio que hidroliza el clorobenceno, dando fenol y cloruro de hidrógeno que luego se pueden reciclar al primer paso. [6] [7] Debido a la naturaleza de dos pasos, el proceso Raschig-Hooker se puede utilizar para producir clorobenceno o fenol.

La capacidad del proceso Raschig-Hooker para producir fenol lo hace comparable a otros métodos, como el proceso Dow y Bayer , que también convierte el benceno en fenol. De hecho, la capacidad de reciclar el cloruro de hidrógeno hizo que el proceso Raschig-Hooker fuera preferible al proceso Dow y Bayer, que requiere que su producto de cloruro de sodio se convierta en cloro e hidróxido de sodio. La reacción, sin embargo, tiene lugar a temperaturas muy altas en un entorno muy ácido con vapor de cloruro de hidrógeno y, por lo tanto, el entorno industrial debe utilizar equipos altamente resistentes a la corrosión para la reacción. Si bien el proceso Raschig-Hooker recicla el cloruro de hidrógeno que produce, su catalizador experimenta deposición de carbono y debe regenerarse con frecuencia. El duro entorno químico, el uso de catalizadores y el gran consumo de energía lo han convertido en un objetivo para las alternativas de química verde . [6]
El proceso Raschig-Hooker presenta problemas de selectividad en ambos pasos. En el primer paso, la reacción se ejecuta solo hasta una conversión del 10% al 15% para evitar la segunda adición de un átomo de cloro al clorobenceno deseado. A pesar de esto, la selectividad general de la reacción es del 70% al 85%. Esta segunda adición se puede revertir utilizando la modificación de Hooker, aunque también es costosa. El segundo paso comparte la baja tasa de conversión y la alta selectividad del primer paso. La pequeña cantidad de conversión por reacción compensa el beneficio monetario de reciclar el cloruro de hidrógeno debido al alto costo inicial de la reacción. Por lo tanto, el proceso Raschig-Hooker necesitaba ejecutarse a altas concentraciones en grandes reactores para que fuera industrialmente económico. [6]
Debido a su baja productividad, este proceso prácticamente no se utiliza en la actualidad. A partir de 1997 [actualizar], todas las plantas de los Estados Unidos que utilizaban el proceso Raschig-Hooker se cerraron, aunque todavía lo utilizaban algunas plantas en países como Argentina, India, Italia y Polonia. En lugar de utilizar el proceso Raschig-Hooker, algunas empresas utilizan el proceso Hock o cumeno , que sintetiza acetona y fenol a partir de benceno y propileno. Este proceso preferido ha dominado el mercado, especialmente porque la acetona también es una sustancia muy solicitada. [6]