
Un enlace quíntuple en química es un tipo inusual de enlace químico , reportado por primera vez en 2005 para un compuesto de dicromo . Los enlaces simples , dobles y triples son comunes en química. Los enlaces cuádruples son más raros y actualmente se conocen solo entre los metales de transición, especialmente para Cr , Mo , W y Re , por ejemplo, [Mo 2 Cl 8 ] 4− y [Re 2 Cl 8 ] 2− . En un enlace quíntuple, diez electrones participan en la unión entre los dos centros metálicos, asignados como σ 2 π 4 δ 4 .
En algunos casos de enlaces de alto orden entre átomos metálicos, el enlace metal-metal se ve facilitado por ligandos que unen los dos centros metálicos y reducen la distancia interatómica. Por el contrario, el dímero de cromo con enlace quíntuple se estabiliza mediante un voluminoso ligando de terfenilo (2,6-[(2,6-diisopropil)fenil]fenilo) . La especie es estable hasta 200 °C. [1] [2] El enlace quíntuple cromo-cromo se ha analizado con métodos ab initio multirreferencia y DFT , [3] que también se utilizaron para dilucidar el papel del ligando de terfenilo, en el que se demostró que los arilos flanqueantes interactuaban muy débilmente con los átomos de cromo, causando solo un pequeño debilitamiento del enlace quíntuple. [4] Un estudio teórico de 2007 identificó dos mínimos globales para compuestos RMMR con enlaces quíntuples: una geometría molecular trans -doblada y, sorprendentemente, otra geometría trans -doblada con el sustituyente R en una posición de puente. [5]
En 2005, se postuló la existencia de un enlace quíntuple en la molécula hipotética de uranio U 2 basándose en la química computacional . [6] [7] Los compuestos de diuranio son raros, pero existen; por ejemplo, el U
2Cl2−
8anión.
En 2007 se informó que el enlace metal-metal más corto de la historia (180,28 pm) también existía en un compuesto que contenía un enlace cromo-cromo quíntuple con ligandos puente de diazadieno. [8] Otros complejos que contienen enlaces quíntuples metal-metal que se han informado incluyen dicromo quíntuplemente enlazado con ligandos puente de [6-(2,4,6-triisopropilfenil)piridin-2-il](2,4,6-trimetilfenil)amina [9] y un complejo de dicromo con ligandos puente de amidinato . [10]
La síntesis de enlaces quíntuples se logra generalmente mediante la reducción de una especie dimetálica utilizando grafito de potasio . Esto agrega electrones de valencia a los centros metálicos, lo que les otorga la cantidad necesaria de electrones para participar en el enlace quíntuple. A continuación se muestra una figura de una síntesis de enlace quíntuple típica.
En 2009 se informó sobre un compuesto de dimolibdeno con un enlace quíntuple y dos ligandos puente di amido con una longitud de enlace Mo-Mo de 202 pm. [11] El compuesto se sintetizó a partir de octaclorodimolibdato de potasio (que ya contiene un enlace cuádruple Mo 2 ) y un amidinato de litio, seguido de una reducción con grafito de potasio:
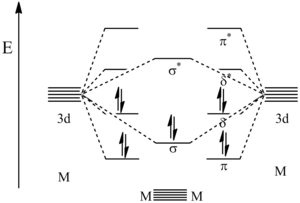
Como se indicó anteriormente, los enlaces quíntuples metal-metal tienen una configuración σ 2 π 4 δ 4 . Entre los cinco enlaces presentes entre los centros metálicos, uno es un enlace sigma , dos son enlaces pi y dos son enlaces delta . El enlace σ es el resultado de la mezcla entre los orbitales d z 2 en cada centro metálico. El primer enlace π proviene de la mezcla de los orbitales d yz de cada metal, mientras que el otro enlace π proviene de la mezcla de los orbitales d xz en cada metal. Finalmente, los enlaces δ provienen de la mezcla de los orbitales d xy , así como de la mezcla entre los orbitales d x 2 − y 2 de cada metal.
Los cálculos de orbitales moleculares han dilucidado las energías relativas de los orbitales creados por estas interacciones de enlace. Como se muestra en la figura siguiente, los orbitales de energía más baja son los orbitales de enlace π seguidos por el orbital de enlace σ. Los siguientes más altos son los orbitales de enlace δ que representan el HOMO . Debido a que los 10 electrones de valencia de los metales se utilizan para llenar estos primeros 5 orbitales, el siguiente orbital más alto se convierte en el LUMO que es el orbital antienlazante δ*. Aunque los orbitales π y δ se representan como degenerados , de hecho no lo son. Esto se debe a que el modelo que se muestra aquí es una simplificación y se cree que tiene lugar la hibridación de los orbitales s, p y d, lo que provoca un cambio en los niveles de energía orbital. [ cita requerida ]
Las longitudes de los enlaces quíntuples dependen en gran medida de los ligandos unidos a los centros metálicos. Casi todos los complejos que contienen un enlace quíntuplo metal-metal tienen ligandos puente bidentados , e incluso aquellos que no lo contienen, como el complejo de terfenilo mencionado anteriormente, tienen alguna característica de puente a través de interacciones metal- ipsocarbono .
El ligando bidentado puede actuar como una especie de pinza, ya que para que se produzca la quelación , los átomos de metal deben acercarse entre sí, acortando así la longitud del enlace quíntuple. Las dos formas de obtener distancias metal-metal más cortas son reducir la distancia entre los átomos quelantes en el ligando modificando la estructura o utilizar efectos estéricos para forzar un cambio conformacional en el ligando que doble la molécula de forma que fuerce a los átomos quelantes a acercarse. A continuación se muestra un ejemplo de esto último:
El ejemplo anterior muestra el ligando utilizado en el complejo de dimolibdeno mostrado anteriormente. Cuando el carbono entre los dos nitrógenos en el ligando tiene un hidrógeno unido a él, la repulsión estérica es pequeña. Sin embargo, cuando el hidrógeno se reemplaza con un anillo de fenilo mucho más voluminoso, la repulsión estérica aumenta drásticamente y el ligando se "arquea", lo que provoca un cambio en la orientación de los pares solitarios de electrones en los átomos de nitrógeno. Estos pares solitarios son los responsables de formar enlaces con los centros metálicos, por lo que al obligarlos a acercarse también se obliga a los centros metálicos a posicionarse más cerca unos de otros. Por lo tanto, disminuye la longitud del enlace quíntuple. En el caso en que este ligando está unido a dimolibdeno con enlace quíntuple, la longitud del enlace quíntuple pasa de 201,87 pm a 201,57 pm cuando el hidrógeno se reemplaza con un grupo fenilo. También se han demostrado resultados similares en complejos de enlace quíntuple de dicromo. [12]
Continúan los esfuerzos para preparar enlaces quíntuples más cortos. [13] [14]
Los complejos de dicromo con enlaces quíntuples parecen actuar como el magnesio para producir reactivos de Grignard . [15]