En química , el peroxidicarbonato (a veces peroxodicarbonato ) es un anión divalente con la fórmula química C
2Oh2−
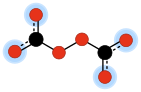
6Es uno de los aniones oxocarbonados , que están formados únicamente por carbono y oxígeno . Su estructura molecular puede verse como dos aniones carbonato unidos de manera que forman un puente peróxido –O–O–.
El anión se forma junto con el peroxocarbonato CO2−
4, en el electrodo negativo durante la electrólisis del carbonato de litio fundido . [1] El anión también se puede obtener por electrólisis de una solución saturada de carbonato de rubidio en agua. [2]
Además, el anión peroxodicarbonato se puede obtener por electrosíntesis en diamante dopado con boro (BDD) durante la oxidación del agua. [3] [4] La oxidación formal de dos iones carbonato tiene lugar en el ánodo. Debido al alto potencial de oxidación del anión peroxodicarbonato, es necesario un alto sobrepotencial anódico. Esto es aún más importante si los radicales hidroxilo están involucrados en el proceso de formación. Publicaciones recientes muestran que se puede alcanzar una concentración de 282 mmol/L de peroxodicarbonato en una celda no dividida con carbonato de sodio como material de partida a densidades de corriente de 720 mA/cm 2 . [5] El proceso descrito es adecuado para la producción a escala piloto de peroxodicarbonato de sodio.
El peroxidicarbonato de potasio K 2 C 2 O 6 fue obtenido por Constam y von Hansen en 1895; [6] su estructura cristalina fue determinada recién en 2002. [7] También puede obtenerse por electrólisis de una solución saturada de carbonato de potasio a −20 °C. Es un sólido cristalino de color azul claro que se descompone a 141 °C, liberando oxígeno y dióxido de carbono, y se descompone lentamente a temperaturas más bajas. [7]
El peroxodicarbonato de rubidio es un sólido cristalino de color azul claro que se descompone a 424 K (151 °C). Su estructura se publicó en 2003. [2] En ambas sales, cada una de las dos unidades de carbonato es plana. En la sal de rubidio , toda la molécula es plana, mientras que en la sal de potasio las dos unidades se encuentran en planos diferentes y casi perpendiculares, y ambos contienen el enlace O–O. [2]