El tereftalato de polietileno (o poli(tereftalato de etileno) , PET , PETE o el obsoleto PETP o PET-P ) es la resina polimérica termoplástica más común de la familia del poliéster y se utiliza en fibras para ropa, contenedores para líquidos y alimentos y termoformado para fabricación, y en combinación con fibra de vidrio para resinas de ingeniería . [5]
En 2016, la producción anual de PET fue de 56 millones de toneladas. [6] La mayor aplicación es en fibras (más del 60%), y la producción de botellas representa aproximadamente el 30% de la demanda mundial. [7] En el contexto de las aplicaciones textiles, se hace referencia al PET por su nombre común, poliéster , mientras que el acrónimo PET se usa generalmente en relación con el embalaje. [ cita requerida ] El poliéster representa aproximadamente el 18% de la producción mundial de polímeros y es el cuarto polímero más producido después del polietileno (PE), el polipropileno (PP) y el cloruro de polivinilo (PVC). [ cita requerida ]
El PET está formado por unidades repetidas (C 10 H 8 O 4 ). El PET se recicla habitualmente y tiene el dígito 1 (♳) como su código de identificación de resina (RIC). La Asociación Nacional de Recursos de Envases de PET (NAPCOR) define el PET como: "Los artículos de tereftalato de polietileno a los que se hace referencia se derivan del ácido tereftálico (o tereftalato de dimetilo ) y el monoetilenglicol , donde la suma del ácido tereftálico (o tereftalato de dimetilo) y el monoetilenglicol reaccionados constituye al menos el 90 por ciento de la masa del monómero reaccionado para formar el polímero, y debe exhibir una temperatura máxima de fusión entre 225 °C y 255 °C, como se identifica durante el segundo escaneo térmico en el procedimiento 10.1 en ASTM D3418, al calentar la muestra a una velocidad de 10 °C/minuto". [8]
Dependiendo de su procesamiento y su historial térmico, el tereftalato de polietileno puede existir como polímero amorfo (transparente) y como polímero semicristalino . El material semicristalino puede parecer transparente (tamaño de partícula inferior a 500 nm ) u opaco y blanco (tamaño de partícula de hasta unos pocos micrómetros ) dependiendo de su estructura cristalina y tamaño de partícula.
Un proceso para fabricar PET utiliza tereftalato de bis(2-hidroxietilo) , [ cita requerida ] que puede sintetizarse mediante la reacción de esterificación entre ácido tereftálico y etilenglicol con agua como subproducto (esto también se conoce como reacción de condensación), o mediante una reacción de transesterificación entre etilenglicol y tereftalato de dimetilo (DMT) con metanol como subproducto. La polimerización se realiza mediante una reacción de policondensación de los monómeros (realizada inmediatamente después de la esterificación/transesterificación) con agua como subproducto. [5]
Las fibras de poliéster se utilizan ampliamente en la industria textil. La invención de la fibra de poliéster se atribuye a JR Whinfield. [9] Fue comercializada por primera vez en la década de 1940 por ICI , bajo la marca 'Terylene'. [10] Posteriormente, EI DuPont lanzó la marca 'Dacron'. A partir de 2022, existen muchas marcas en todo el mundo, en su mayoría asiáticas.
Las fibras de poliéster se utilizan en prendas de moda, a menudo mezcladas con algodón, como capas de aislamiento térmico en ropa térmica, ropa deportiva, ropa de trabajo y tapicería de automóviles.
Las botellas de plástico fabricadas con PET se utilizan ampliamente para refrescos , tanto con y sin gas . Para las bebidas que se degradan con el oxígeno, como la cerveza, se utiliza una estructura multicapa. El PET incorpora una capa adicional de alcohol polivinílico (PVOH) o poliamida (PA) para reducir aún más su permeabilidad al oxígeno.
Las láminas de PET no orientadas se pueden termoformar para fabricar bandejas de embalaje y blísters . [11] El PET cristalizable resiste las temperaturas de congelación y cocción en horno. [12] : 1378 Tanto el PET amorfo como el BoPET son transparentes a simple vista. Los tintes que confieren color se pueden formular fácilmente en láminas de PET.
El PET es permeable al oxígeno y al dióxido de carbono y esto impone limitaciones en la vida útil de los contenidos envasados en PET. [13] : 104
A principios de la década de 2000, el mercado mundial de envases de PET creció a una tasa de crecimiento anual compuesta del 9% hasta alcanzar los 17.000 millones de euros en 2006. [14]
La película de PET biaxialmente orientada (BOPET) (conocida a menudo por uno de sus nombres comerciales, "Mylar") se puede aluminizar evaporando una película fina de metal sobre ella para reducir su permeabilidad y hacerla reflectante y opaca ( MPET ). Estas propiedades son útiles en muchas aplicaciones, incluidos los envases flexibles de alimentos y el aislamiento térmico (como las mantas térmicas ).
El BOPET se utiliza en la lámina posterior de los módulos fotovoltaicos . La mayoría de las láminas posteriores constan de una capa de BOPET laminada a un fluoropolímero o una capa de BOPET estabilizado contra los rayos UV. [15]
El PET también se utiliza como sustrato en células solares de película fina.
El PET se puede combinar con fibra de vidrio y aceleradores de cristalización para fabricar resinas termoplásticas que se pueden moldear por inyección para fabricar piezas como carcasas, tapas, componentes de electrodomésticos y elementos del sistema de encendido. [16]
El PET es una mezcla estequiométrica de carbono y H2O , por lo que se ha utilizado en un experimento que implicaba una compresión por choque impulsada por láser que creó nanodiamantes y agua superiónica . Esta podría ser una forma posible de producir nanodiamantes comercialmente. [17] [18]
El PET fue patentado en 1941 por John Rex Whinfield , James Tennant Dickson y su empleador, la Calico Printers' Association de Manchester , Inglaterra. EI DuPont de Nemours en Delaware, Estados Unidos, utilizó por primera vez la marca Mylar en junio de 1951 y recibió el registro de la misma en 1952. [27] Sigue siendo el nombre más conocido utilizado para la película de poliéster. El propietario actual de la marca es DuPont Teijin Films. [28]
En la Unión Soviética, el PET se fabricó por primera vez en los laboratorios del Instituto de Compuestos de Alto Peso Molecular de la Academia de Ciencias de la URSS en 1949, y su nombre "Lavsan" es un acrónimo del mismo ( ла боратории Института в ысокомолекулярных с оединений A А кадемии н аук СССР). [29]
La botella PET fue inventada en 1973 por Nathaniel Wyeth [30] y patentada por DuPont. [31]

El PET en su estado más estable es una resina semicristalina incolora . Sin embargo, su cristalización es intrínsecamente lenta en comparación con otros polímeros semicristalinos . Según las condiciones de procesamiento, se puede formar en artículos no cristalinos ( amorfos ) o cristalinos. Su facilidad para estirarse en la fabricación hace que el PET sea útil en aplicaciones de fibra y película. Como la mayoría de los polímeros aromáticos , tiene mejores propiedades de barrera [ aclaración necesaria ] que los polímeros alifáticos . Es fuerte y resistente al impacto. El PET es higroscópico y absorbe agua. [32]
Alrededor del 60% de cristalización es el límite superior para los productos comerciales, con la excepción de las fibras de poliéster . [ aclaración necesaria ] Los productos transparentes se pueden producir enfriando rápidamente el polímero fundido por debajo de la temperatura de transición vítrea (T g ) para formar un sólido amorfo no cristalino . [ 33 ] Al igual que el vidrio, el PET amorfo se forma cuando sus moléculas no tienen suficiente tiempo para organizarse de manera ordenada y cristalina a medida que se enfría la masa fundida. Mientras que a temperatura ambiente las moléculas están congeladas en su lugar, si se les devuelve suficiente energía térmica después calentando el material por encima de T g , pueden comenzar a moverse nuevamente, lo que permite que los cristales se nuclearicen y crezcan. Este procedimiento se conoce como cristalización en estado sólido. [ cita requerida ] El PET amorfo también cristaliza y se vuelve opaco cuando se expone a solventes , como cloroformo o tolueno . [ 34 ]
Se puede producir un producto más cristalino dejando que el polímero fundido se enfríe lentamente. En lugar de formar un gran monocristal, este material tiene una serie de esferulitas (áreas cristalizadas) que contienen cada una muchos pequeños cristalitos (granos). La luz tiende a dispersarse a medida que cruza los límites entre los cristalitos y las regiones amorfas entre ellos, lo que hace que el sólido resultante sea translúcido. [ cita requerida ] La orientación también hace que los polímeros sean más transparentes. [ aclaración necesaria ] Es por eso que la película y las botellas BOPET son cristalinas, hasta cierto punto, y transparentes. [ cita requerida ]
El PET tiene una afinidad por los sabores hidrofóbicos , y a veces es necesario formular bebidas con una dosis de sabor más alta, en comparación con las que se utilizan en el vidrio, para compensar el sabor absorbido por el envase. [35] : 115 Si bien las botellas de PET de gran calibre se devuelven para su reutilización, como en algunos países de la UE, la propensión del PET a absorber sabores hace que sea necesario realizar una "prueba de olfateo" en las botellas devueltas para evitar la contaminación cruzada de sabores. [35] : 115
Las diferentes aplicaciones del PET requieren distintos grados de polimerización, que se pueden obtener modificando las condiciones del proceso. El peso molecular del PET se mide por la viscosidad de la solución. [ Aclaración necesaria ] El método preferido para medir esta viscosidad es la viscosidad intrínseca (IV) del polímero. [36] La viscosidad intrínseca es una medida adimensional que se obtiene extrapolando la viscosidad relativa (medida en (dℓ/g)) a una concentración cero. A continuación se muestran los rangos de IV para aplicaciones comunes: [37]
El PET se copolimeriza a menudo con otros dioles o diácidos para optimizar las propiedades para aplicaciones particulares. Por ejemplo, se puede añadir ciclohexanodimetanol (CHDM) a la cadena principal del polímero en lugar de etilenglicol . Dado que este bloque de construcción es mucho más grande (seis átomos de carbono adicionales) que la unidad de etilenglicol que reemplaza, no encaja con las cadenas vecinas de la forma en que lo haría una unidad de etilenglicol. Esto interfiere con la cristalización y reduce la temperatura de fusión del polímero. En general, este PET se conoce como PETG o PET-G (polietilenglicol tereftalato modificado). Es un termoplástico amorfo transparente que se puede moldear por inyección, extruir en láminas o extruir como filamento para impresión 3D . El PETG se puede colorear durante el procesamiento. Otro modificador común es el ácido isoftálico , que reemplaza algunas de las unidades de tereftalato enlazadas 1,4-( para- ). El enlace 1,2-( orto- ) o 1,3-( meta -) produce un ángulo en la cadena, que también altera la cristalinidad.
Estos copolímeros son ventajosos para ciertas aplicaciones de moldeo, como el termoformado , que se utiliza, por ejemplo, para fabricar envases en bandeja o blíster a partir de películas de co-PET, láminas de PET amorfo (A-PET/PETA) o láminas de PETG. Por otro lado, la cristalización es importante en otras aplicaciones en las que la estabilidad mecánica y dimensional son importantes, como los cinturones de seguridad. Para las botellas de PET, el uso de pequeñas cantidades de ácido isoftálico, CHDM, dietilenglicol (DEG) u otros comonómeros puede ser útil: si solo se utilizan pequeñas cantidades de comonómeros, la cristalización se ralentiza, pero no se evita por completo. Como resultado, se pueden obtener botellas mediante moldeo por soplado y estirado ("SBM"), que son lo suficientemente transparentes y cristalinas como para ser una barrera adecuada para los aromas e incluso los gases, como el dióxido de carbono en las bebidas carbonatadas.
El tereftalato de polietileno se produce principalmente a partir de ácido tereftálico purificado (PTA), así como en menor medida a partir de (mono-)etilenglicol (MEG) y tereftalato de dimetilo (DMT). [38] [5] A partir de 2022, el etilenglicol se fabrica a partir de eteno que se encuentra en el gas natural , mientras que el ácido tereftálico proviene del p-xileno elaborado a partir del petróleo crudo . Por lo general, se utiliza un compuesto de antimonio o titanio como catalizador, se agrega un fosfito como estabilizador y se agrega un agente azulante como la sal de cobalto para enmascarar cualquier amarilleo. [39]
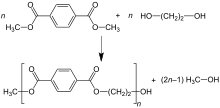
En el proceso de tereftalato de dimetilo (DMT), el DMT y el exceso de etilenglicol (MEG) se transesterifican en la masa fundida a 150–200 °C con un catalizador básico . El metanol ( CH3OH ) se elimina por destilación para impulsar la reacción. El exceso de MEG se destila a una temperatura más alta con la ayuda del vacío. El segundo paso de transesterificación se lleva a cabo a 270–280 °C, con destilación continua también de MEG. [38]
Las reacciones se pueden resumir de la siguiente manera:

En el proceso del ácido tereftálico , el MEG y el PTA se esterifican directamente a presión moderada (2,7–5,5 bar) y temperatura elevada (220–260 °C). El agua se elimina en la reacción y también se elimina continuamente por destilación : [38]
El Bio-PET es la contraparte de origen biológico del PET. [40] [41] Básicamente, en el Bio-PET, el MEG se fabrica a partir de etileno derivado del etanol de caña de azúcar . Se ha propuesto un proceso mejor basado en la oxidación del etanol, [42] y también es técnicamente posible fabricar PTA a partir de furfural de origen biológico fácilmente disponible . [43]

Existen dos métodos básicos de moldeo para botellas PET: el de un solo paso y el de dos pasos. En el moldeo de dos pasos, se utilizan dos máquinas independientes. La primera máquina moldea por inyección la preforma, que se parece a un tubo de ensayo, con las roscas de la tapa de la botella ya moldeadas en su lugar. El cuerpo del tubo es significativamente más grueso, ya que se inflará hasta alcanzar su forma final en el segundo paso mediante el moldeo por soplado y estirado .
En el segundo paso, las preformas se calientan rápidamente y luego se inflan contra un molde de dos partes para darles la forma final de la botella. Las preformas (botellas sin inflar) ahora también se utilizan como contenedores robustos y únicos; además de caramelos novedosos, algunas secciones de la Cruz Roja las distribuyen como parte del programa Vial of Life a los propietarios de viviendas para almacenar el historial médico para los servicios de emergencia. El proceso de dos pasos se presta a la producción de terceros a distancia del sitio del usuario. Las preformas se pueden transportar y almacenar por miles en un espacio mucho más pequeño que los contenedores terminados, para que la segunda etapa se lleve a cabo en el sitio del usuario en una base "justo a tiempo". En las máquinas de un solo paso, todo el proceso desde la materia prima hasta el contenedor terminado se lleva a cabo dentro de una máquina, lo que lo hace especialmente adecuado para moldear formas no estándar (moldeo personalizado), incluidos frascos, formas ovaladas planas, frascos, etc. Su mayor mérito es la reducción de espacio, manipulación del producto y energía, y una calidad visual mucho mayor que la que se puede lograr con el sistema de dos pasos. [ cita requerida ]
El PET está sujeto a degradación durante el procesamiento. Si el nivel de humedad es demasiado alto, la hidrólisis reducirá el peso molecular por escisión de la cadena , lo que resultará en fragilidad. Si el tiempo de residencia y/o la temperatura de fusión (temperatura en la fusión) son demasiado altos, entonces se producirá degradación térmica o degradación termooxidativa que resultará en decoloración y peso molecular reducido, así como la formación de acetaldehído y la formación de formaciones de "gel" u "ojo de pez" a través de la reticulación . Las medidas de mitigación incluyen la copolimerización con otros monómeros como CHDM o ácido isoftálico , que reducen el punto de fusión y, por lo tanto, la temperatura de fusión de la resina, así como la adición de estabilizadores de polímeros como fosfitos . [44]
El acetaldehído , que puede formarse por degradación del PET tras una manipulación incorrecta del material, es una sustancia incolora y volátil con un olor afrutado. Aunque se forma de forma natural en algunas frutas, puede provocar un sabor desagradable en el agua embotellada. Además de las altas temperaturas (el PET se descompone por encima de los 300 °C o 570 °F) y los largos tiempos de residencia en el barril, las altas presiones y las altas velocidades de extrusión (que provocan un aumento de la temperatura por cizallamiento) también pueden contribuir a la producción de acetaldehído. La fotooxidación también puede provocar la formación gradual de acetaldehído a lo largo de la vida útil del objeto. Esto se produce a través de una reacción de Norrish de tipo II . [45]
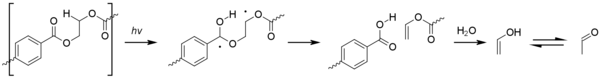
Cuando se produce acetaldehído, una parte del mismo permanece disuelto en las paredes de un recipiente y luego se difunde en el producto almacenado en su interior, alterando el sabor y el aroma. Esto no es un problema para los productos no consumibles (como el champú), para los jugos de frutas (que ya contienen acetaldehído) o para las bebidas de sabor fuerte como los refrescos. Sin embargo, para el agua embotellada, un bajo contenido de acetaldehído es bastante importante, porque si nada enmascara el aroma, incluso concentraciones extremadamente bajas de acetaldehído (10-20 partes por mil millones en el agua) pueden producir un sabor desagradable. [46]
Un comentario publicado en Environmental Health Perspectives en abril de 2010 sugirió que el PET podría producir disruptores endocrinos en condiciones de uso común y recomendó que se investigara sobre este tema. [47] Los mecanismos propuestos incluyen la lixiviación de ftalatos , así como la lixiviación de antimonio . Un artículo publicado en Journal of Environmental Monitoring en abril de 2012 concluye que la concentración de antimonio en el agua desionizada almacenada en botellas de PET se mantiene dentro del límite aceptable de la UE incluso si se almacena brevemente a temperaturas de hasta 60 °C (140 °F), mientras que el contenido embotellado (agua o refrescos) puede ocasionalmente superar el límite de la UE después de menos de un año de almacenamiento a temperatura ambiente. [48]
El antimonio (Sb) es un elemento metaloide que se utiliza como catalizador en forma de compuestos como el trióxido de antimonio ( Sb2O3 ) o el triacetato de antimonio en la producción de PET. Después de la fabricación, se puede encontrar una cantidad detectable de antimonio en la superficie del producto. Este residuo se puede eliminar con el lavado. El antimonio también permanece en el propio material y, por lo tanto, puede migrar a los alimentos y bebidas. La exposición del PET a la ebullición o al microondas puede aumentar significativamente los niveles de antimonio, posiblemente por encima de los niveles máximos de contaminación de la EPA de EE. UU. [49] El límite de agua potable evaluado por la OMS es de 20 partes por mil millones (OMS, 2003), y el límite de agua potable en los Estados Unidos es de 6 partes por mil millones. [50] Aunque el trióxido de antimonio tiene una baja toxicidad cuando se ingiere por vía oral, [51] su presencia sigue siendo preocupante. La Oficina Federal Suiza de Salud Pública investigó la cantidad de migración de antimonio, comparando aguas embotelladas en PET y vidrio: las concentraciones de antimonio del agua en botellas de PET eran más altas, pero aún muy por debajo de la concentración máxima permitida. La Oficina Federal Suiza de Salud Pública concluyó que pequeñas cantidades de antimonio migran del PET al agua embotellada, pero que el riesgo para la salud de las bajas concentraciones resultantes es insignificante (1% de la " ingesta diaria tolerable " determinada por la OMS ). Un estudio posterior (2006) pero más publicitado encontró cantidades similares de antimonio en agua en botellas de PET. [52] La OMS ha publicado una evaluación de riesgos para el antimonio en el agua potable. [51]
Sin embargo, se encontró que los concentrados de jugo de frutas (para los cuales no se han establecido pautas) que se produjeron y embotellaron en PET en el Reino Unido contenían hasta 44,7 μg/L de antimonio, muy por encima de los límites de la UE para el agua del grifo de 5 μg/L. [53]
La ropa desprende microfibras durante el uso, el lavado y el secado a máquina. Los desechos plásticos forman lentamente pequeñas partículas. Los microplásticos que se encuentran en el fondo de los ríos o del mar pueden ser ingeridos por pequeñas criaturas marinas, entrando así en la cadena alimentaria. Como el PET tiene una densidad mayor que el agua, una cantidad significativa de micropartículas de PET puede precipitarse en las plantas de tratamiento de aguas residuales. Las microfibras de PET generadas por el uso, el lavado o el secado a máquina de la ropa pueden transportarse por el aire y dispersarse en los campos, donde son ingeridas por el ganado o las plantas y terminan en el suministro de alimentos humanos. SAPEA ha declarado que dichas partículas "no representan un riesgo generalizado". [54] Se sabe que el PET se degrada cuando se expone a la luz solar y al oxígeno. [55] A fecha de 2016, existe poca información sobre la vida útil de los polímeros sintéticos en el medio ambiente. [56]



Si bien la mayoría de los termoplásticos se pueden reciclar, en principio, el reciclaje de botellas de PET es más práctico que muchas otras aplicaciones de plástico debido al alto valor de la resina y al uso casi exclusivo de PET para el embotellado de agua y bebidas gaseosas de uso generalizado. [57] [58] Las botellas de PET se prestan bien al reciclaje (véase más adelante). En muchos países, las botellas de PET se reciclan en un grado sustancial, [57] por ejemplo, alrededor del 75% en Suiza. [59] El término rPET se utiliza comúnmente para describir el material reciclado, aunque también se lo conoce como R-PET o PET posconsumo (POSTC-PET). [60] [61]
Los principales usos del PET reciclado son la fibra de poliéster, los flejes y los contenedores no alimentarios. [ cita requerida ] Debido a la reciclabilidad del PET y la abundancia relativa de desechos posconsumo en forma de botellas, el PET también está ganando rápidamente participación en el mercado como fibra para alfombras. [ 62 ] El PET, como muchos plásticos, también es un excelente candidato para la eliminación térmica ( incineración ), ya que está compuesto de carbono, hidrógeno y oxígeno, con solo trazas de elementos catalizadores (pero sin azufre). [ cita requerida ] En general, el PET puede reciclarse químicamente en sus materias primas originales (PTA, DMT y EG), destruyendo completamente la estructura del polímero; [ cita requerida ] reciclarse mecánicamente en una forma diferente, sin destruir el polímero; [ cita requerida ] o reciclarse en un proceso que incluye la transesterificación y la adición de otros glicoles, polioles o glicerol para formar un nuevo poliol. El poliol del tercer método se puede utilizar en la producción de poliuretano (espuma de PU), [63] [64] [65] [66] o productos a base de epoxi, incluidas pinturas. [67]
En 2023 se anunció un proceso para utilizar PET como base para la producción de supercondensadores . El PET, al estar compuesto estequiométricamente de carbono y H 2 O , se puede convertir en una forma de láminas y nanoesferas que contienen carbono, con una superficie muy alta. El proceso implica mantener una mezcla de PET, agua, ácido nítrico y etanol a alta temperatura y presión durante ocho horas, seguido de centrifugación y secado. [68] [69]
En 2021 y 2022 se anunciaron importantes inversiones para el reciclado químico de PET mediante glicólisis, metanólisis [70] [71] y reciclado enzimático [72] para recuperar monómeros. Inicialmente, también se utilizarán botellas como materia prima, pero se espera que en el futuro también se reciclen fibras de esta manera. [73]
El PET también es un combustible deseable para las plantas de conversión de residuos en energía , ya que tiene un alto valor calorífico que ayuda a reducir el uso de recursos primarios para la generación de energía. [74]
Al menos una especie de bacteria del género Nocardia puede degradar PET con una enzima esterasa. [75] Las esterasas son enzimas capaces de escindir el enlace éster entre dos oxígenos que unen subunidades de PET. [75] La degradación inicial de PET también puede lograrse mediante esterasas expresadas por Bacillus , así como por Nocardia . [76] Los científicos japoneses han aislado otra bacteria, Ideonella sakaiensis , que posee dos enzimas que pueden descomponer el PET en trozos más pequeños digeribles por las bacterias. Una colonia de I. sakaiensis puede desintegrar una película de plástico en aproximadamente seis semanas. [77] [78] Investigadores franceses informan que han desarrollado una hidrolasa de PET mejorada que puede despolimerizar (romper) al menos el 90 por ciento del PET en 10 horas, descomponiéndolo en monómeros individuales . [79] [80] [81] Además, la Universidad de Texas en Austin diseñó una enzima basada en una PET-asa natural con la ayuda de un algoritmo de aprendizaje automático para que pudiera tolerar cambios de pH y temperatura . Se descubrió que la PET-asa podía degradar varios productos y podía descomponerlos en tan solo 24 horas. [82] [83]