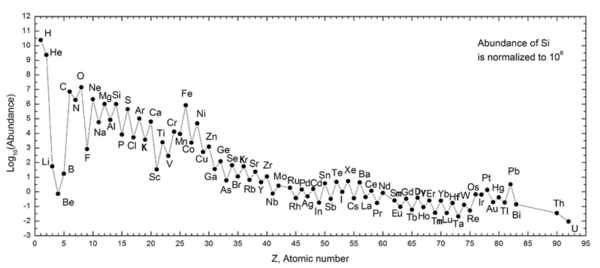
La regla de Oddo-Harkins sostiene que un elemento con número atómico par es más abundante que los elementos con números atómicos inmediatamente adyacentes . Por ejemplo, el carbono , de número atómico 6, es más abundante que el boro (5) y el nitrógeno (7). Generalmente, la abundancia relativa de un elemento con número atómico par es aproximadamente dos órdenes de magnitud mayor que las abundancias relativas de los elementos con número atómico impar inmediatamente adyacentes a cada lado. Este patrón fue informado por primera vez por Giuseppe Oddo [1] en 1914 y William Draper Harkins [2] en 1917. [3] [4] La regla de Oddo-Harkins es cierta para todos los elementos que comienzan con el carbono producido por la nucleosíntesis estelar , pero no es cierta para todos los elementos que comienzan con el carbono producido por la nucleosíntesis estelar. los elementos más ligeros debajo del carbono producidos por la nucleosíntesis del big bang y la espalación de rayos cósmicos . [ cita necesaria ]

Todos los átomos más grandes que el hidrógeno se forman en las estrellas o supernovas mediante nucleosíntesis , cuando la gravedad , la temperatura y la presión alcanzan niveles lo suficientemente altos como para fusionar protones y neutrones . Los protones y neutrones forman el núcleo atómico , que acumula electrones para formar átomos. El número de protones en el núcleo, llamado número atómico, identifica de forma única un elemento químico.
La forma inicial de la regla derivó del estudio de meteoritos de Harkin en 1917. Razonó, como otros en su momento, que los meteoritos son más representativos de la abundancia cosmológica de los elementos. Harkins observó que los elementos de número atómico par (Z) eran aproximadamente 70 veces más abundantes que aquellos con Z impar. Los primeros siete elementos, que constituían casi el 99% del material de un meteorito, tenían todos el número par Z. Además, observó que el 90% del material estaba formado por sólo 15 isótopos diferentes, con pesos atómicos en múltiplos de cuatro, el peso aproximado de las partículas alfa . Tres años antes, Oddo hizo una observación similar para los elementos de la corteza terrestre, especulando que los elementos son productos de condensación del helio . El núcleo nuclear del helio es igual al de una partícula alfa. [5] : 385 Este trabajo temprano que conecta la geoquímica con la física nuclear y la cosmología fue ampliado en gran medida por el grupo noruego creado por Victor Goldschmidt [5] : 389

La regla de Oddo-Harkins para elementos del 12 C al 56 Fe se explica mediante el proceso alfa de la nucleosíntesis estelar . [6] : 42 El proceso implica la fusión de partículas alfa (núcleos de helio 4) a alta temperatura y presión dentro del entorno estelar. Cada paso del proceso alfa añade dos protones (y dos neutrones) favoreciendo la síntesis de elementos pares. El carbono en sí es un producto de un proceso triple alfa del helio, un proceso que omite Li, Be y B. Estos nucleidos (incluido el helio-3) se producen por espalación de rayos cósmicos, un tipo de fisión nuclear en la que los rayos cósmicos impactan isótopos más grandes. y fragmentarlos. La espalación no requiere altas temperaturas y presiones del entorno estelar, pero puede ocurrir en la Tierra. Aunque los productos más ligeros de la espalación son relativamente raros, los isótopos de número de masa impar de esta clase se producen en mayor abundancia relativa en comparación con los isótopos de número par, en contravención de la regla de Oddo-Harkins.
Este postulado, sin embargo, no se aplica al elemento más abundante y simple del universo: el hidrógeno , con un número atómico de 1. Esto puede deberse a que, en su forma ionizada, un átomo de hidrógeno se convierte en un solo protón, del cual se teoriza que Han sido uno de los primeros grandes conglomerados de quarks durante el segundo inicial del período de inflación del Universo , tras el Big Bang . En este período, cuando la inflación del universo lo había llevado desde un punto infinitesimal hasta aproximadamente el tamaño de una galaxia moderna, las temperaturas en la sopa de partículas cayeron de más de un billón de grados a varios millones de grados.
Este período permitió la fusión de protones individuales y núcleos de deuterio para formar núcleos de helio y litio , pero fue demasiado corto para que cada ion H + se reconstituyera en elementos más pesados. En este caso, el helio, de número atómico 2, sigue siendo la contraparte par del hidrógeno. Así, el hidrógeno neutro (o hidrógeno emparejado con un electrón , el único leptón estable ) constituía la gran mayoría de las porciones de materia restantes no aniquiladas tras la conclusión de la inflación.
Otra excepción a la regla es el berilio que, a pesar de tener un número atómico par (4), es más raro que los elementos adyacentes ( litio y boro ). Esto se debe a que la mayor parte del litio, el berilio y el boro del universo se producen mediante espalación de rayos cósmicos , no por nucleosíntesis estelar ordinaria , y el berilio tiene sólo un isótopo estable, lo que hace que tenga un retraso en abundancia con respecto a sus vecinos, cada uno de los cuales tiene dos. isótopos estables.

La base elemental de Oddo-Harkins tiene raíces directas en las composiciones isotópicas de los elementos. [7] Si bien los elementos pares con número atómico son más abundantes que los impares, el espíritu de Oddo-Harkins se extiende también a los isótopos más abundantes. Los isótopos que contienen igual número de protones y neutrones son los más abundantes. Estos incluyen , , , , , , y . Siete de los ocho son alfa nucleidos que contienen múltiplos enteros de núcleos de He-4 ( es la excepción). Dos de los ocho ( y ) contienen números mágicos de protones o neutrones (2, 8, 20, 28, 50, 82 y 126) y, por lo tanto, el modelo de capa nuclear predice que serán inusualmente abundantes. El modelo de capa no predice las altas abundancias de los seis restantes ( , , , , y ). "El hecho de que núcleos de este tipo sean inusualmente abundantes indica que el exceso de estabilidad debe haber jugado un papel en el proceso de creación de elementos", afirmó Maria Goeppert Mayer en su discurso de aceptación del Premio Nobel de Física en 1963 por sus descubrimientos sobre la capa nuclear. estructura. [8]
La regla de Oddo-Harkins puede sugerir que los elementos con números atómicos impares tienen un único protón desapareado y pueden capturar rápidamente otro para lograr un número atómico par y una paridad de protones. Los protones están emparejados en elementos con números atómicos pares, y cada miembro del par equilibra el espín del otro, mejorando así la estabilidad del nucleón. Un desafío a esta explicación lo plantea , que es muy abundante a pesar de tener un protón desapareado. Además, incluso los isótopos de paridad que tienen exactamente dos neutrones más que protones no son particularmente abundantes a pesar de su paridad uniforme. Cada uno de los elementos ligeros, oxígeno, neón, magnesio, silicio y azufre, tiene dos isótopos con paridad uniforme de isospin (nucleón). Como se muestra en el gráfico anterior, el isótopo con igual número de protones y neutrones es uno o dos órdenes de magnitud más abundante que el isótopo con paridad uniforme pero dos neutrones adicionales. Esto puede dejar abierto el papel de la paridad en la abundancia. La base estructural o subatómica de las inusuales abundancias de isótopos equinucleónicos en la materia bariónica es uno de los misterios sin resolver más simples y profundos del núcleo atómico.
Dependiendo de la masa de una estrella, el patrón Oddo-Harkins surge de la quema de elementos progresivamente más masivos dentro de una estrella moribunda en colapso mediante procesos de fusión como la cadena protón-protón , el ciclo CNO y el proceso triple alfa . Los elementos recién formados son expulsados lentamente a través del viento estelar , o en la explosión de una supernova , y eventualmente se unirán al resto del medio interestelar de la galaxia .