
Un virus ARN es un virus —distinto de un retrovirus— que tiene ácido ribonucleico ( ARN ) como material genético . [1] El ácido nucleico suele ser ARN monocatenario ( ssRNA ), pero puede ser bicatenario (dsRNA). [2] Las enfermedades humanas notables causadas por virus ARN incluyen el resfriado común , la influenza , el SARS , el MERS , la COVID-19 , el virus del dengue , la hepatitis C , la hepatitis E , la fiebre del Nilo Occidental , la enfermedad por el virus del Ébola , la rabia , la poliomielitis , las paperas y el sarampión .
El Comité Internacional de Taxonomía de Virus (ICTV) clasifica a los virus ARN como aquellos que pertenecen al Grupo III , Grupo IV o Grupo V del sistema de clasificación de Baltimore . Esta categoría excluye al Grupo VI , virus con material genético ARN pero que utilizan intermediarios de ADN en su ciclo de vida : estos son los llamados retrovirus , [3] incluyendo el VIH-1 y el VIH-2 que causan el SIDA .
A partir de mayo de 2020, se cree que todos los virus de ARN conocidos que codifican una ARN polimerasa dirigida por ARN forman un grupo monofilético, conocido como el reino Riboviria . [4] La mayoría de estos virus de ARN caen en el reino Orthornavirae y el resto tiene un posicionamiento aún no definido . [5] El reino no contiene todos los virus de ARN: Deltavirus , Asunviroidae y Pospiviroidae son taxones de virus de ARN que se incluyeron por error en 2019, [a] pero se corrigieron en 2020. [6]
Los virus de ARN pueden clasificarse además según el sentido o polaridad de su ARN en virus de ARN de sentido negativo y de sentido positivo , o ambisentidos. El ARN viral de sentido positivo es similar al ARNm y, por lo tanto, puede ser traducido inmediatamente por la célula huésped. El ARN viral de sentido negativo es complementario al ARNm y, por lo tanto, debe convertirse en ARN de sentido positivo mediante una ARN polimerasa dependiente de ARN antes de la traducción. El ARN purificado de un virus de sentido positivo puede causar infección directamente, aunque puede ser menos infeccioso que la partícula viral completa. Por el contrario, el ARN purificado de un virus de sentido negativo no es infeccioso por sí mismo, ya que necesita ser transcrito en ARN de sentido positivo; cada virión puede transcribirse en varios ARN de sentido positivo. Los virus de ARN ambisentidos se parecen a los virus de ARN de sentido negativo, excepto que traducen genes de sus cadenas negativa y positiva. [7]
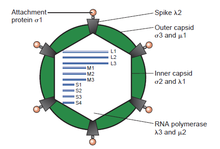
Los virus de doble cadena (ds)ARN representan un grupo diverso de virus que varían ampliamente en el rango de hospedadores (humanos, animales, plantas, hongos [ b] y bacterias ), número de segmentos del genoma (uno a doce) y organización del virión ( número de triangulación , capas de la cápside , picos, torretas, etc.). Los miembros de este grupo incluyen los rotavirus , que son la causa más común de gastroenteritis en niños pequeños, y los picobirnavirus , que son los virus más comunes en muestras fecales de humanos y animales con o sin signos de diarrea. El virus de la lengua azul es un patógeno económicamente importante que infecta al ganado vacuno y ovino. En los últimos años, se ha avanzado en la determinación de las estructuras de resolución atómica y subnanómetro de varias proteínas virales clave y cápsides de virión de varios virus dsARN, lo que destaca los paralelos significativos en la estructura y los procesos replicativos de muchos de estos virus. [2] [ página necesaria ]
Los virus de ARN generalmente tienen tasas de mutación muy altas en comparación con los virus de ADN , [9] porque las polimerasas de ARN virales carecen de la capacidad de corrección de las polimerasas de ADN . [10] La diversidad genética de los virus de ARN es una de las razones por las que es difícil fabricar vacunas efectivas contra ellos. [11] Los retrovirus también tienen una alta tasa de mutación a pesar de que su intermedio de ADN se integra en el genoma del huésped (y, por lo tanto, está sujeto a la corrección de ADN del huésped una vez integrado), porque los errores durante la transcripción inversa se incrustan en ambas cadenas de ADN antes de la integración. [12] Algunos genes del virus de ARN son importantes para los ciclos de replicación viral y no se toleran las mutaciones. Por ejemplo, la región del genoma del virus de la hepatitis C que codifica la proteína central está altamente conservada , [13] porque contiene una estructura de ARN involucrada en un sitio de entrada interno al ribosoma . [14]
En promedio, los virus dsRNA muestran una redundancia de secuencia menor en relación con los virus ssRNA. Por el contrario, los virus dsDNA contienen las secuencias genómicas más redundantes, mientras que los virus ssDNA tienen la menor cantidad. [15] Se ha demostrado que la complejidad de la secuencia de los virus es una característica clave para una clasificación viral precisa sin referencias. [15]
Los virus ARN animales están clasificados por el ICTV. Existen tres grupos distintos de virus ARN según su genoma y modo de replicación:
Los retrovirus (Grupo VI) tienen un genoma de ARN monocatenario pero, en general, no se consideran virus de ARN porque utilizan intermediarios de ADN para replicarse. La transcriptasa inversa , una enzima viral que proviene del propio virus después de que este se desenrolla, convierte el ARN viral en una cadena complementaria de ADN, que se copia para producir una molécula de ADN viral de doble cadena. Después de que este ADN se integra en el genoma del huésped utilizando la enzima viral integrasa , la expresión de los genes codificados puede conducir a la formación de nuevos viriones.
Numerosos virus de ARN son capaces de recombinación genética cuando al menos dos genomas virales están presentes en la misma célula huésped. [16] Muy raramente el ARN viral puede recombinarse con el ARN del huésped. [17] La recombinación de ARN parece ser una fuerza impulsora importante en la determinación de la arquitectura del genoma y el curso de la evolución viral entre Picornaviridae ( (+)ssRNA ), p. ej. poliovirus . [18] En Retroviridae ((+)ssRNA), p. ej. VIH , el daño en el genoma de ARN parece evitarse durante la transcripción inversa mediante el cambio de cadena, una forma de recombinación. [19] [20] [21] La recombinación también ocurre en Reoviridae (dsRNA), p. ej. reovirus; Orthomyxoviridae ((-)ssRNA), p. ej. virus de la influenza ; [21] y Coronaviridae ((+)ssRNA), p. ej. SARS . [22] La recombinación en virus de ARN parece ser una adaptación para hacer frente al daño del genoma. [16] La recombinación puede ocurrir con poca frecuencia entre virus animales de la misma especie pero de linajes divergentes. Los virus recombinantes resultantes pueden causar a veces un brote de infección en humanos. [22]
La clasificación se basa principalmente en el tipo de genoma (bicatenario, monocatenario negativo o positivo) y en el número y organización de los genes. Actualmente, se reconocen 5 órdenes y 47 familias de virus ARN. También hay muchas especies y géneros sin asignar.
Los viroides y los virus satélite de ARN están relacionados con los virus de ARN, pero son distintos de ellos . Estos no están clasificados actualmente como virus de ARN y se describen en sus propias páginas.
Un estudio de varios miles de virus ARN ha demostrado la presencia de al menos cinco taxones principales: un grupo de levivirus y parientes; un supergrupo de picornavirus; un supergrupo de alfavirus más un supergrupo de flavivirus; los virus dsRNA; y los virus de cadena -ve. [23] El grupo de lentivirus parece ser basal para todos los virus ARN restantes. La siguiente división principal se encuentra entre el supragrupo picorna y los virus restantes. Los virus dsRNA parecen haber evolucionado a partir de un ancestro de ARN +ve y los virus de ARN -ve de dentro de los virus dsRNA. La relación más cercana a los virus de ARN de cadena -ve es Reoviridae .
Este es el grupo más grande de virus ARN [24] y ha sido organizado por el ICTV en los filos Kitrinoviricota , Lenarviricota y Pisuviricota en el reino Orthornavirae y el reino Riboviria . [25]
Los virus de ARN de cadena positiva también pueden clasificarse en función de la ARN polimerasa dependiente de ARN. Se han reconocido tres grupos: [26]
Se ha propuesto una división del supergrupo de tipo alfa (similar a Sindbis) sobre la base de un nuevo dominio ubicado cerca de los extremos N de las proteínas involucradas en la replicación viral. [27] Los dos grupos propuestos son: el grupo de los "altovirus" (alfavirus, furovirus, virus de la hepatitis E, hordeivirus, tobamovirus, tobravirus, tricornavirus y probablemente rubivirus); y el grupo de los "tipovirus" (virus de la mancha clorotica de la hoja del manzano, carlavirus, potexvirus y timovirus).
El supergrupo tipo alfa se puede dividir en tres clados : los virus tipo rubí, tipo tobamo y tipo tymo. [28]
Trabajos adicionales han identificado cinco grupos de virus de ARN de cadena positiva que contienen cuatro, tres, tres, tres y un orden(es), respectivamente. [29] Estos catorce órdenes contienen 31 familias de virus (incluidas 17 familias de virus de plantas) y 48 géneros (incluidos 30 géneros de virus de plantas). Este análisis sugiere que los alfavirus y flavivirus pueden separarse en dos familias (Togaviridae y Flaviridae, respectivamente), pero sugiere que otras asignaciones taxonómicas, como los pestivirus, el virus de la hepatitis C, los rubivirus, el virus de la hepatitis E y los arterivirus, pueden ser incorrectas. Los coronavirus y los torovirus parecen ser familias distintas en órdenes distintos y no géneros distintos de la misma familia como se clasifica actualmente. Los luteovirus parecen ser dos familias en lugar de una, y el virus de la mancha foliar clorótica del manzano parece no ser un closterovirus sino un nuevo género de Potexviridae.
La evolución de los picornavirus basada en un análisis de sus ARN polimerasas y helicasas parece remontarse a la divergencia de los eucariotas . [30] Sus supuestos ancestros incluyen los retroelementos del grupo II bacteriano , la familia de proteasas HtrA y los bacteriófagos de ADN .
Los partitivirus están relacionados con un ancestro totivirus y pueden haber evolucionado a partir de él. [31]
Los hipovirus y los barnavirus parecen compartir una ascendencia con los linajes potyvirus y sobemovirus respectivamente. [31]
Este análisis también sugiere que los virus dsRNA no están estrechamente relacionados entre sí, sino que pertenecen a cuatro clases adicionales (Birnaviridae, Cystoviridae, Partitiviridae y Reoviridae) y a un orden adicional (Totiviridae) de una de las clases de virus ssRNA positivos en el mismo subfilo que los virus de ARN de cadena positiva.
Un estudio ha sugerido que hay dos grandes clados: uno incluye las familias Caliciviridae , Flaviviridae y Picornaviridae y un segundo que incluye las familias Alphatetraviridae , Birnaviridae , Cystoviridae , Nodaviridae y Permutotretraviridae . [32]
Estos virus tienen múltiples tipos de genomas que van desde una única molécula de ARN hasta ocho segmentos. A pesar de su diversidad, parece que pueden haberse originado en artrópodos y haberse diversificado a partir de allí. [33]
También se conocen varios virus satélite (virus que requieren la asistencia de otro virus para completar su ciclo de vida). Su taxonomía aún no se ha establecido. Se han propuesto los siguientes cuatro géneros para los virus satélite de ARN monocatenario de sentido positivo que infectan plantas: Albetovirus , Aumaivirus , Papanivirus y Virtovirus . [34] Se ha propuesto una familia, Sarthroviridae , que incluye el género Macronovirus , para los virus satélite de ARN monocatenario de sentido positivo que infectan a los artrópodos .
Hay doce familias y varios géneros y especies no asignados reconocidos en este grupo. [10]
En este grupo se reconocen tres órdenes y 34 familias. Además, hay varias especies y géneros sin clasificar.
Virus satelitales
También se ha descrito un virus similar a un astrovirus/hepevirus no clasificado. [36]
Con excepción del virus de la hepatitis D , este grupo de virus se ha incluido en un único filo: Negarnaviricota . Este filo se ha dividido en dos subfilos: Haploviricotina y Polyploviricotina . Dentro del subfilo Haploviricotina se reconocen actualmente cuatro clases: Chunqiuviricetes , Milneviricetes , Monjiviricetes y Yunchangviricetes . En el subfilo Polyploviricotina se reconocen dos clases: Ellioviricetes e Insthoviricetes .
Actualmente se reconocen en este grupo seis clases, siete órdenes y veinticuatro familias. Aún quedan por clasificar varias especies y géneros no asignados. [10]