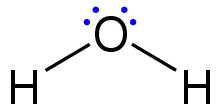
Las estructuras de Lewis , también llamadas fórmulas de puntos de Lewis , estructuras de puntos de Lewis , estructuras de puntos de electrones o estructuras de puntos de electrones de Lewis ( LED ), son diagramas que muestran el enlace entre átomos de una molécula , así como los pares solitarios de electrones que pueden existir en la molécula. [1] [2] [3] Se puede dibujar una estructura de Lewis para cualquier molécula unida covalentemente , así como para compuestos de coordinación . La estructura de Lewis recibió su nombre en honor a Gilbert N. Lewis , quien la introdujo en su artículo de 1916 El átomo y la molécula. [4] Las estructuras de Lewis amplían el concepto del diagrama de puntos de electrones al agregar líneas entre átomos para representar pares compartidos en un enlace químico.
Las estructuras de Lewis muestran cada átomo y su posición en la estructura de la molécula mediante su símbolo químico. Se dibujan líneas entre los átomos que están unidos entre sí (se pueden utilizar pares de puntos en lugar de líneas). Los electrones sobrantes que forman pares solitarios se representan como pares de puntos y se colocan junto a los átomos.
Aunque los elementos del grupo principal del segundo período y posteriores generalmente reaccionan ganando, perdiendo o compartiendo electrones hasta que alcanzan una configuración electrónica de capa de valencia con un octeto completo de (8) electrones, el hidrógeno (H) solo puede formar enlaces que comparten solo dos electrones.
La cantidad total de electrones representados en una estructura de Lewis es igual a la suma de la cantidad de electrones de valencia en cada átomo individual. Los electrones que no son de valencia no están representados en las estructuras de Lewis.
Una vez determinado el número total de electrones de valencia, se colocan en la estructura según estos pasos:
Las estructuras de Lewis de iones poliatómicos se pueden dibujar con el mismo método. Al contar los electrones, los iones negativos deben tener electrones adicionales en sus estructuras de Lewis; los iones positivos deben tener menos electrones que una molécula sin carga. Cuando se escribe la estructura de Lewis de un ion, la estructura completa se coloca entre corchetes y la carga se escribe como un superíndice en la parte superior derecha, fuera de los corchetes.
Se ha propuesto un método más simple para construir estructuras de Lewis, eliminando la necesidad de contar electrones: los átomos se dibujan mostrando los electrones de valencia; luego, los enlaces se forman apareando los electrones de valencia de los átomos involucrados en el proceso de formación del enlace, y los aniones y cationes se forman agregando o quitando electrones a/de los átomos apropiados. [5]
Un truco consiste en contar los electrones de valencia, luego contar el número de electrones necesarios para completar la regla del octeto (o con el hidrógeno, solo 2 electrones) y luego tomar la diferencia de estos dos números. La respuesta es el número de electrones que forman los enlaces. El resto de los electrones simplemente se utilizan para llenar los octetos de todos los demás átomos.
Se ha propuesto otro procedimiento simple y general para escribir estructuras de Lewis y formas de resonancia. [6]
Este sistema funciona en casi todos los casos, pero hay tres casos en los que no funcionará [ cita requerida ] . Estas excepciones se describen en la siguiente tabla.
En términos de estructuras de Lewis, la carga formal se utiliza en la descripción, comparación y evaluación de las posibles estructuras topológicas y de resonancia [7] al determinar la carga electrónica aparente de cada átomo en su interior, basándose en su estructura de puntos electrónicos, asumiendo covalencia exclusiva o enlace no polar . Tiene usos para determinar la posible reconfiguración electrónica cuando se hace referencia a los mecanismos de reacción y, a menudo, da como resultado el mismo signo que la carga parcial del átomo, con excepciones. En general, la carga formal de un átomo se puede calcular utilizando la siguiente fórmula, asumiendo definiciones no estándar para el marcado utilizado:
dónde:
La carga formal de un átomo se calcula como la diferencia entre el número de electrones de valencia que tendría un átomo neutro y el número de electrones que le pertenecen en la estructura de Lewis. Los electrones en los enlaces covalentes se dividen equitativamente entre los átomos que participan en el enlace. La suma total de las cargas formales de un ion debe ser igual a la carga del ion, y la suma total de las cargas formales de una molécula neutra debe ser igual a cero.
En el caso de algunas moléculas e iones, es difícil determinar qué pares solitarios deben moverse para formar enlaces dobles o triples, y se pueden escribir dos o más estructuras de resonancia diferentes para la misma molécula o ion. En tales casos, es habitual escribirlas todas con flechas bidireccionales en el medio . Este es a veces el caso cuando varios átomos del mismo tipo rodean al átomo central, y es especialmente común en el caso de iones poliatómicos.
Cuando se da esta situación, se dice que la estructura de Lewis de la molécula es una estructura de resonancia y la molécula existe como un híbrido de resonancia. Cada una de las diferentes posibilidades se superpone a las demás y se considera que la molécula tiene una estructura de Lewis equivalente a alguna combinación de estos estados.
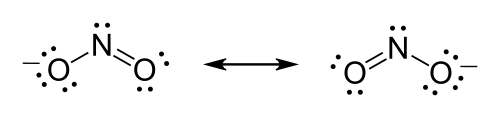
El ion nitrato ( NO−3), por ejemplo, debe formar un doble enlace entre el nitrógeno y uno de los oxígenos para satisfacer la regla del octeto para el nitrógeno. Sin embargo, debido a que la molécula es simétrica, no importa cuál de los oxígenos forme el doble enlace. En este caso, hay tres posibles estructuras de resonancia. La resonancia se puede expresar al dibujar estructuras de Lewis dibujando cada una de las posibles formas de resonancia y colocando flechas de dos puntas entre ellas o utilizando líneas discontinuas para representar los enlaces parciales (aunque esta última es una buena representación del híbrido de resonancia que no es, formalmente hablando, una estructura de Lewis).
Al comparar las estructuras de resonancia de una misma molécula, normalmente las que tienen menos cargas formales contribuyen más al híbrido de resonancia global. Cuando son necesarias las cargas formales, se prefieren las estructuras de resonancia que tienen cargas negativas en los elementos más electronegativos y cargas positivas en los elementos menos electronegativos.
Los enlaces simples también se pueden mover de la misma manera para crear estructuras de resonancia para moléculas hipervalentes como el hexafluoruro de azufre , que es la descripción correcta según los cálculos químicos cuánticos en lugar del modelo común de octeto expandido.
La estructura de resonancia no debe interpretarse como una indicación de que la molécula cambia entre formas, sino que la molécula actúa como el promedio de múltiples formas.
La fórmula del ion nitrito es NO−2.

Las estructuras químicas pueden escribirse en formas más compactas, en particular cuando se muestran moléculas orgánicas . En las fórmulas estructurales condensadas, se pueden omitir muchos o incluso todos los enlaces covalentes, y los subíndices indican el número de grupos idénticos unidos a un átomo en particular. Otro diagrama estructural abreviado es la fórmula esquelética (también conocida como fórmula de línea de enlace o diagrama de esqueleto de carbono). En una fórmula esquelética, los átomos de carbono no se indican con el símbolo C sino con los vértices de las líneas. Los átomos de hidrógeno unidos al carbono no se muestran (se pueden inferir contando el número de enlaces a un átomo de carbono en particular); se supone que cada carbono tiene cuatro enlaces en total, por lo que cualquier enlace que no se muestre es, por implicación, a átomos de hidrógeno.
Otros diagramas pueden ser más complejos que las estructuras de Lewis, mostrando enlaces en 3D utilizando diversas formas, como diagramas de relleno de espacio .
A pesar de su simplicidad y desarrollo a principios del siglo XX, cuando la comprensión del enlace químico era todavía rudimentaria, las estructuras de Lewis capturan muchas de las características clave de la estructura electrónica de una variedad de sistemas moleculares, incluidas las relevantes para la reactividad química. Por lo tanto, continúan disfrutando de un uso generalizado por parte de químicos y educadores de química. Esto es especialmente cierto en el campo de la química orgánica , donde el modelo tradicional de enlace de valencia de enlace aún domina, y los mecanismos a menudo se entienden en términos de notación de curva-flecha superpuesta a fórmulas esqueléticas , que son versiones abreviadas de las estructuras de Lewis. Debido a la mayor variedad de esquemas de enlace encontrados en la química inorgánica y organometálica , muchas de las moléculas encontradas requieren el uso de orbitales moleculares completamente deslocalizados para describir adecuadamente su enlace, lo que hace que las estructuras de Lewis sean comparativamente menos importantes (aunque todavía son comunes).
Existen sistemas moleculares simples y arquetípicos para los cuales una descripción de Lewis, al menos en forma no modificada, es engañosa o inexacta. En particular, el dibujo ingenuo de estructuras de Lewis para moléculas que se sabe experimentalmente que contienen electrones desapareados (por ejemplo, O 2 , NO y ClO 2 ) conduce a inferencias incorrectas de órdenes de enlace, longitudes de enlace y/o propiedades magnéticas. Un modelo de Lewis simple tampoco da cuenta del fenómeno de la aromaticidad . Por ejemplo, las estructuras de Lewis no ofrecen una explicación de por qué el C 6 H 6 cíclico (benceno) experimenta una estabilización especial más allá de los efectos de deslocalización normales, mientras que el C 4 H 4 (ciclobutadieno) experimenta en realidad una desestabilización especial . [ cita requerida ] La teoría de orbitales moleculares proporciona la explicación más directa para estos fenómenos. [ investigación original? ]