Una fuerza intramolecular (o fuerzas primarias) es cualquier fuerza que une a los átomos que forman una molécula o compuesto, que no debe confundirse con las fuerzas intermoleculares , que son las fuerzas presentes entre las moléculas. [1] La sutil diferencia en el nombre proviene de las raíces latinas del inglés inter que significa entre o entre e intra que significa dentro . [2] Los enlaces químicos se consideran fuerzas intramoleculares que a menudo son más fuertes que las fuerzas intermoleculares presentes entre átomos o moléculas no enlazantes.
El modelo clásico identifica tres tipos principales de enlaces químicos: iónico, covalente y metálico, que se distinguen por el grado de separación de cargas entre los átomos participantes. [3] Las características del enlace formado se pueden predecir mediante las propiedades de los átomos constituyentes, a saber, la electronegatividad. Se diferencian en la magnitud de sus entalpías de enlace , una medida de la fuerza del enlace, y por lo tanto afectan las propiedades físicas y químicas de los compuestos de diferentes maneras. El % de carácter iónico es directamente proporcional a la diferencia en la electronegatividad del átomo enlazado. [ aclaración necesaria ]

Un enlace iónico puede aproximarse como una transferencia completa de uno o más electrones de valencia de los átomos que participan en la formación del enlace, lo que resulta en un ion positivo y un ion negativo unidos por fuerzas electrostáticas. [4] Los electrones en un enlace iónico tienden a encontrarse principalmente alrededor de uno de los dos átomos constituyentes debido a la gran diferencia de electronegatividad entre los dos átomos, generalmente más de 1,9 (una mayor diferencia en electronegatividad da como resultado un enlace más fuerte); esto a menudo se describe como un átomo que da electrones al otro. [5] Este tipo de enlace generalmente se forma entre un metal y un no metal , como el sodio y el cloro en NaCl . El sodio daría un electrón al cloro, formando un ion sodio cargado positivamente y un ion cloruro cargado negativamente.
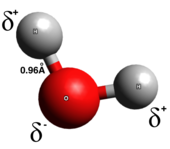
En un enlace covalente verdadero , los electrones se comparten de manera uniforme entre los dos átomos del enlace; hay poca o ninguna separación de carga. Los enlaces covalentes generalmente se forman entre dos no metales. Hay varios tipos de enlaces covalentes: en los enlaces covalentes polares , es más probable que los electrones se encuentren alrededor de uno de los dos átomos, mientras que en los enlaces covalentes no polares, los electrones se comparten de manera uniforme. Las moléculas diatómicas homonucleares son puramente covalentes. La polaridad de un enlace covalente está determinada por las electronegatividades de cada átomo y, por lo tanto, un enlace covalente polar tiene un momento dipolar que apunta desde el extremo parcialmente positivo al extremo parcialmente negativo. [6] Los enlaces covalentes polares representan un tipo intermedio en el que los electrones no se transfieren completamente de un átomo a otro ni se comparten de manera uniforme.
Los enlaces metálicos se forman generalmente dentro de un metal puro o una aleación de metales . Los electrones metálicos suelen estar deslocalizados ; el resultado es una gran cantidad de electrones libres alrededor de núcleos positivos , a veces llamados mares de electrones.
Los átomos forman enlaces para poder alcanzar un estado de energía más bajo. Los átomos libres tendrán más energía que un átomo enlazado. Esto se debe a que se libera algo de energía durante la formación del enlace, lo que permite que todo el sistema alcance un estado de energía más bajo. La longitud del enlace, o la distancia mínima de separación entre dos átomos que participan en la formación del enlace, está determinada por sus fuerzas de repulsión y atracción a lo largo de la dirección internuclear. [3] A medida que los dos átomos se acercan cada vez más, los núcleos cargados positivamente se repelen, creando una fuerza que intenta separar los átomos. A medida que los dos átomos se alejan más, las fuerzas de atracción trabajan para volver a unirlos. De este modo, se logra una longitud de enlace de equilibrio y es una buena medida de la estabilidad del enlace.

Las fuerzas intramoleculares son extremadamente importantes en el campo de la bioquímica, donde entran en juego en los niveles más básicos de las estructuras biológicas. Las fuerzas intramoleculares como los enlaces disulfuro dan a las proteínas y al ADN su estructura. Las proteínas derivan su estructura de las fuerzas intramoleculares que las dan forma y las mantienen unidas. La principal fuente de estructura en estas moléculas es la interacción entre los residuos de aminoácidos que forman la base de las proteínas. [7] Las interacciones entre residuos de las mismas proteínas forman la estructura secundaria de la proteína, lo que permite la formación de láminas beta y hélices alfa , que son estructuras importantes para las proteínas y en el caso de las hélices alfa, para el ADN.