Los escarabajos son insectos que forman el orden Coleoptera ( / k oʊ l iː ˈ ɒ p t ər ə / ), en el superorden Holometabola . Su par de alas delanteras están endurecidas en estuches alares, élitros , lo que los distingue de la mayoría de los demás insectos. Los coleópteros, con alrededor de 400.000 especies descritas, son el más grande de todos los órdenes, constituyendo casi el 40% de los insectos descritos y el 25% de todas las especies animales conocidas; [2] se descubren nuevas especies con frecuencia, con estimaciones que sugieren que hay entre 0,9 y 2,1 millones de especies en total. Se encuentran en casi todos los hábitats excepto el mar y las regiones polares , e interactúan con sus ecosistemas de varias maneras: los escarabajos a menudo se alimentan de plantas y hongos , descomponen restos animales y vegetales y comen otros invertebrados . Algunas especies son plagas agrícolas graves, como el escarabajo de la patata , mientras que otras, como los coccinélidos (mariquitas o mariquitas), se alimentan de pulgones , cochinillas , trips y otros insectos chupadores de plantas que dañan los cultivos. Algunas otras también tienen características inusuales, como las luciérnagas , que utilizan un órgano emisor de luz para aparearse y comunicarse.
Los escarabajos suelen tener un exoesqueleto particularmente duro que incluye los élitros , aunque algunos, como los escarabajos vagabundos, tienen élitros muy cortos, mientras que los escarabajos ampolla tienen élitros más blandos. La anatomía general de un escarabajo es bastante uniforme y típica de los insectos, aunque hay varios ejemplos de novedad, como las adaptaciones en los escarabajos de agua que atrapan burbujas de aire debajo de los élitros para usarlas mientras bucean. Los escarabajos son holometábolos , lo que significa que experimentan una metamorfosis completa , con una serie de cambios notables y relativamente abruptos en la estructura corporal entre la eclosión y la adultez después de una etapa de pupa relativamente inmóvil . Algunos, como los escarabajos ciervos , tienen un marcado dimorfismo sexual , los machos poseen mandíbulas enormemente agrandadas que usan para luchar contra otros machos. Muchos escarabajos son aposemáticos , con colores y patrones brillantes que advierten de su toxicidad, mientras que otros son imitadores batesianos inofensivos de tales insectos. Muchos escarabajos, incluidos los que viven en lugares arenosos, tienen un camuflaje eficaz .
Los escarabajos son prominentes en la cultura humana , desde los escarabajos sagrados del antiguo Egipto hasta el arte de las alas de escarabajo y su uso como mascotas o insectos de lucha para el entretenimiento y el juego. Muchos grupos de escarabajos tienen colores brillantes y atractivos, lo que los convierte en objetos de colección y exhibiciones decorativas. Más de 300 especies se utilizan como alimento , principalmente como larvas ; las especies ampliamente consumidas incluyen gusanos de la harina y larvas de escarabajos rinocerontes . Sin embargo, el mayor impacto de los escarabajos en la vida humana es como plagas agrícolas, forestales y hortícolas . Las especies de plagas graves incluyen el gorgojo del algodón, el escarabajo de la patata , el escarabajo hispino del coco , el escarabajo del pino de montaña y muchos otros. La mayoría de los escarabajos, sin embargo, no causan daños económicos y algunos, como numerosas especies de mariquitas , son beneficiosos al ayudar a controlar las plagas de insectos.

El nombre del orden taxonómico, Coleoptera, proviene del griego koleopteros (κολεόπτερος), dado al grupo por Aristóteles por sus élitros , alas anteriores endurecidas en forma de escudo, de koleos , vaina, y pteron , ala. El nombre inglés beetle proviene de la palabra inglesa antigua bitela , pequeño mordedor, relacionada con bītan (morder), [3] [4] dando lugar al inglés medio betylle . [5] Otro nombre inglés antiguo para escarabajo es ċeafor , abejorro, usado en nombres como abejorro , del protogermánico * kebrô ("escarabajo"; compárese con el alemán Käfer , el holandés kever , el afrikáans kewer ). [6]
Los escarabajos son, con diferencia, el orden más grande de insectos: las aproximadamente 400.000 especies representan aproximadamente el 40% de todas las especies de insectos descritas hasta ahora, y aproximadamente el 25% de todas las especies animales. [1] [7] [8] [9] [10] [11] Un estudio de 2015 proporcionó cuatro estimaciones independientes del número total de especies de escarabajos, dando una estimación media de unos 1,5 millones con un "rango sorprendentemente estrecho" [12] que abarca las cuatro estimaciones desde un mínimo de 0,9 hasta un máximo de 2,1 millones de especies de escarabajos. Las cuatro estimaciones hicieron uso de relaciones de especificidad de hospedador (1,5 a 1,9 millones), proporciones con otros taxones (0,9 a 1,2 millones), proporciones planta:escarabajo (1,2 a 1,3) y extrapolaciones basadas en el tamaño corporal por año de descripción (1,7 a 2,1 millones). [12] [13]
Esta inmensa diversidad llevó al biólogo evolucionista JBS Haldane a bromear, cuando algunos teólogos le preguntaron qué se podía inferir sobre la mente del Dios cristiano a partir de las obras de su creación, diciendo: "Una afición desmesurada por los escarabajos". [14]
Sin embargo, la clasificación de los escarabajos como los más diversos ha sido cuestionada. Múltiples estudios postulan que los dípteros (moscas) y/o los himenópteros (moscas sierra, avispas, hormigas y abejas) pueden tener más especies. [15] [16] [17]
Los escarabajos se encuentran en casi todos los hábitats, incluidos los hábitats de agua dulce y costeros, dondequiera que se encuentre follaje vegetativo, desde árboles y su corteza hasta flores, hojas y bajo tierra cerca de las raíces, incluso dentro de las plantas en las agallas, en cada tejido vegetal, incluidos los muertos o en descomposición. [18] Las copas de los bosques tropicales tienen una fauna grande y diversa de escarabajos, [19] incluyendo Carabidae, [20] Chrysomelidae, [21] y Scarabaeidae. [22]
El escarabajo más pesado, de hecho el más pesado en la etapa de insecto, es la larva del escarabajo goliat , Goliathus goliatus , que puede alcanzar una masa de al menos 115 g (4,1 oz) y una longitud de 11,5 cm (4,5 in). Los escarabajos goliat machos adultos son los escarabajos más pesados en su etapa adulta, con un peso de 70-100 g (2,5-3,5 oz) y una medida de hasta 11 cm (4,3 in). [23] Los escarabajos elefantes adultos , Megasoma elephas y Megasoma actaeon , a menudo alcanzan los 50 g (1,8 oz) y los 10 cm (3,9 in). [24]
El escarabajo más largo es el escarabajo Hércules Dynastes hercules , con una longitud total máxima de al menos 16,7 cm (6,6 pulgadas) incluyendo el cuerno pronotal muy largo . El escarabajo más pequeño registrado y el insecto de vida libre más pequeño (a partir de 2015 [update]), es el escarabajo de alas emplumadas Scydosella musawasensis que puede medir tan poco como 325 μm de longitud. [25]

El escarabajo más antiguo conocido es Coleopsis , del Pérmico temprano ( Asseliano ) de Alemania, hace unos 295 millones de años. [26] Se cree que los primeros escarabajos del Pérmico, que se agrupan colectivamente en los " Protocolopepteros ", eran xilófagos (comían madera) y perforaban la madera . Se han encontrado fósiles de esta época en Siberia y Europa, por ejemplo en los yacimientos fósiles de pizarra roja de Niedermoschel cerca de Maguncia, Alemania. [27] Se han encontrado más fósiles en Obora, República Checa y Tshekarda en los montes Urales, Rusia. [28] Sin embargo, solo hay unos pocos fósiles de América del Norte antes del Pérmico medio , aunque tanto Asia como América del Norte se habían unido a Euramérica . Los primeros descubrimientos de América del Norte realizados en la Formación Wellington de Oklahoma se publicaron en 2005 y 2008. [29] [30] Los primeros miembros de los linajes de escarabajos modernos aparecieron durante el Pérmico Tardío . En el evento de extinción del Pérmico-Triásico a fines del Pérmico, la mayoría de los linajes de "protocoleópteros" se extinguieron. La diversidad de escarabajos no se recuperó a los niveles previos a la extinción hasta el Triásico Medio . [31]

Durante el Jurásico ( 210 a 145 millones de años atrás ), hubo un aumento dramático en la diversidad de familias de escarabajos, [29] incluyendo el desarrollo y crecimiento de especies carnívoras y herbívoras. Los Chrysomeloidea se diversificaron en la misma época, alimentándose de una amplia gama de plantas hospedantes, desde cícadas y coníferas hasta angiospermas . [32] Cerca del Jurásico Superior, los Cupedidae disminuyeron, pero la diversidad de las primeras especies herbívoras aumentó. Los escarabajos herbívoros más recientes se alimentan de plantas con flores o angiospermas, cuyo éxito contribuyó a duplicar las especies herbívoras durante el Jurásico Medio . Sin embargo, el aumento del número de familias de escarabajos durante el Cretácico no se correlaciona con el aumento del número de especies de angiospermas. [33] Casi al mismo tiempo, aparecieron numerosos gorgojos primitivos (por ejemplo, Curculionoidea ) y escarabajos de clic (por ejemplo, Elateroidea ). Los primeros escarabajos joya (por ejemplo, Buprestidae ) están presentes, pero siguieron siendo raros hasta el Cretácico. [34] [35] [36] Los primeros escarabajos no eran coprófagos, sino que presumiblemente se alimentaban de madera podrida con la ayuda de hongos; son un ejemplo temprano de una relación mutualista.
Existen más de 150 yacimientos fósiles importantes del Jurásico, la mayoría en Europa del Este y el norte de Asia. Entre los yacimientos más destacados se encuentran Solnhofen en la Alta Baviera , Alemania, [37] Karatau en el sur de Kazajstán , [38] la formación Yixian en Liaoning , norte de China, [39] así como la formación Jiulongshan y otros yacimientos fósiles en Mongolia . En América del Norte sólo hay unos pocos yacimientos con registros fósiles de insectos del Jurásico, concretamente los depósitos de caliza de concha en la cuenca de Hartford, la cuenca de Deerfield y la cuenca de Newark. [29] [40]
El Cretácico vio la fragmentación de la masa continental austral, con la apertura del Océano Atlántico sur y el aislamiento de Nueva Zelanda, mientras que América del Sur, la Antártida y Australia se distanciaron más. [32] La diversidad de Cupedidae y Archostemata disminuyó considerablemente. Los escarabajos terrestres depredadores (Carabidae) y los escarabajos vagabundos (Staphylinidae) comenzaron a distribuirse en diferentes patrones; los Carabidae se encontraban predominantemente en las regiones cálidas, mientras que los Staphylinidae y los escarabajos chasqueadores (Elateridae) preferían los climas templados. Del mismo modo, las especies depredadoras de Cleroidea y Cucujoidea cazaban a sus presas bajo la corteza de los árboles junto con los escarabajos joya (Buprestidae). La diversidad de escarabajos joya aumentó rápidamente, ya que eran los principales consumidores de madera, [41] mientras que los escarabajos de cuernos largos ( Cerambycidae ) eran bastante raros: su diversidad aumentó solo hacia el final del Cretácico Superior. [29] Los primeros escarabajos coprófagos son del Cretácico Superior [42] y pueden haber vivido en los excrementos de dinosaurios herbívoros. [43] Se encuentran las primeras especies donde tanto las larvas como los adultos están adaptados a un estilo de vida acuático. Los escarabajos remolinos (Gyrinidae) fueron moderadamente diversos, aunque otros escarabajos tempranos (por ejemplo, Dytiscidae) fueron menos, siendo el más extendido la especie de Coptoclavidae , que se alimentaba de larvas de moscas acuáticas. [29] Una revisión de 2020 de las interpretaciones paleoecológicas de los escarabajos fósiles de los ámbares del Cretácico ha sugerido que la saproxilicidad era la estrategia de alimentación más común, y que las especies fungívoras en particular parecían dominar. [44]
Muchos yacimientos fósiles en todo el mundo contienen escarabajos del Cretácico. La mayoría se encuentran en Europa y Asia y pertenecen a la zona de clima templado durante el Cretácico. [39] Los yacimientos del Cretácico Inferior incluyen los yacimientos fósiles de Crato en la cuenca de Araripe en Ceará , al norte de Brasil, así como la formación Santana suprayacente; esta última estaba cerca del ecuador en ese momento. En España, yacimientos importantes están cerca de Montsec y Las Hoyas . En Australia, los yacimientos fósiles de Koonwarra del grupo Korumburra, South Gippsland , Victoria, son dignos de mención. Los principales yacimientos del Cretácico Superior incluyen Kzyl-Dzhar en el sur de Kazajstán y Arkagala en Rusia. [29]

Los fósiles de escarabajos son abundantes en el Cenozoico; en el Cuaternario (hace hasta 1,6 millones de años), las especies fósiles son idénticas a las actuales, mientras que a partir del Mioceno tardío (hace 5,7 millones de años) los fósiles siguen siendo tan parecidos a las formas modernas que es muy probable que sean los ancestros de las especies actuales. Las grandes oscilaciones del clima durante el Cuaternario hicieron que los escarabajos cambiaran tanto su distribución geográfica que la ubicación actual da pocas pistas sobre la historia biogeográfica de una especie. Es evidente que el aislamiento geográfico de las poblaciones a menudo debe haberse roto a medida que los insectos se desplazaban bajo la influencia del cambio climático, lo que provocó una mezcla de acervos genéticos, una rápida evolución y extinciones, especialmente en latitudes medias. [46]
El gran número de especies de escarabajos plantea problemas especiales para la clasificación . Algunas familias contienen decenas de miles de especies y necesitan ser divididas en subfamilias y tribus. Polyphaga es el suborden más grande, que contiene más de 300.000 especies descritas en más de 170 familias, incluyendo escarabajos vagabundos (Staphylinidae), escarabajos escarabajos ( Scarabaeidae ), escarabajos ampolla (Meloidae), escarabajos ciervos (Lucanidae) y gorgojos verdaderos ( Curculionidae ). [10] [47] Estos grupos de escarabajos polífagos pueden identificarse por la presencia de escleritos cervicales (partes endurecidas de la cabeza utilizadas como puntos de unión para los músculos) ausentes en los otros subórdenes. [48] Adephaga contiene alrededor de 10 familias de escarabajos en gran parte depredadores, incluye escarabajos de tierra (Carabidae), escarabajos de agua ( Dytiscidae ) y escarabajos perinola (Gyrinidae). En estos insectos, los testículos son tubulares y el primer esternón abdominal (una placa del exoesqueleto ) está dividido por las coxas traseras (las articulaciones basales de las patas del escarabajo). [49] Archostemata contiene cuatro familias de escarabajos que se alimentan principalmente de madera, incluidos los escarabajos reticulados (Cupedidae) y el escarabajo de los postes telefónicos . [50] Los Archostemata tienen una placa expuesta llamada metatrocantina frente al segmento basal o coxa de la pata trasera. [51] Myxophaga contiene alrededor de 65 especies descritas en cuatro familias, en su mayoría muy pequeñas, incluyendo Hydroscaphidae y el género Sphaerius . [52] Los escarabajos mixófagos son pequeños y en su mayoría se alimentan de algas. Sus piezas bucales son características por carecer de galeas y tener un diente móvil en su mandíbula izquierda. [53]
La consistencia de la morfología de los escarabajos , en particular su posesión de élitros , ha sugerido durante mucho tiempo que Coleoptera es monofilético , aunque ha habido dudas sobre la disposición de los subórdenes , a saber, Adephaga , Archostemata , Myxophaga y Polyphaga dentro de ese clado . [54] [32] [55] [56] [57] Se cree que los parásitos de alas retorcidas, Strepsiptera , son un grupo hermano de los escarabajos, habiéndose separado de ellos en el Pérmico Temprano . [56] [58] [59] [60]
El análisis filogenético molecular confirma que los coleópteros son monofiléticos. Duane McKenna et al. (2015) utilizaron ocho genes nucleares para 367 especies de 172 de 183 familias de coleópteros. Dividieron a los Adephaga en 2 clados, Hydradephaga y Geadephaga, dividieron a los Cucujoidea en 3 clados y colocaron a los Lymexyloidea dentro de los Tenebrionoidea. Los Polyphaga parecen datar del Triásico. La mayoría de las familias de escarabajos existentes parecen haber surgido en el Cretácico. [60] El cladograma se basa en McKenna (2015). [60] El número de especies en cada grupo (principalmente superfamilias) se muestra entre paréntesis y en negrita si son más de 10 000. [61] Se dan los nombres comunes en inglés cuando es posible. Las fechas de origen de los grupos principales se muestran en cursiva en millones de años (mya). [61]

Los escarabajos se caracterizan generalmente por un exoesqueleto particularmente duro y alas anteriores duras ( élitros ) no utilizables para volar. Casi todos los escarabajos tienen mandíbulas que se mueven en un plano horizontal. Las piezas bucales rara vez son succionadoras, aunque a veces son reducidas; los maxilares siempre tienen palpos. Las antenas suelen tener 11 segmentos o menos, excepto en algunos grupos como los Cerambycidae (escarabajos de cuernos largos) y los Rhipiceridae (escarabajos parásitos de las cigarras). Las coxas de las patas suelen estar ubicadas hundidas dentro de una cavidad coxal. Las estructuras genitales están telescópicas en el último segmento abdominal en todos los escarabajos existentes. Las larvas de escarabajo a menudo se pueden confundir con las de otros grupos holometábolos. [51] El exoesqueleto del escarabajo está formado por numerosas placas, llamadas escleritos , separadas por suturas finas. Este diseño proporciona defensas blindadas al tiempo que mantiene la flexibilidad. La anatomía general de un escarabajo es bastante uniforme, aunque los órganos y apéndices específicos varían mucho en apariencia y función entre las muchas familias que lo componen. Como todos los insectos, el cuerpo de los escarabajos se divide en tres secciones: la cabeza, el tórax y el abdomen. [8] Debido a que hay tantas especies, la identificación es bastante difícil y se basa en atributos que incluyen la forma de las antenas, las fórmulas tarsales [a] y las formas de estos pequeños segmentos en las patas, las piezas bucales y las placas ventrales (esternones, pleura, coxas). En muchas especies, la identificación precisa solo se puede realizar mediante el examen de las estructuras genitales masculinas únicas. [62]
.jpg/440px-Head_of_the_Weaver_Beetle_(Lamia_textor).jpg)
La cabeza, con piezas bucales que se proyectan hacia adelante o a veces hacia abajo, suele estar muy esclerotizada y a veces es muy grande. [7] Los ojos son compuestos y pueden mostrar una adaptabilidad notable, como en el caso de los escarabajos acuáticos ( Gyrinidae ), donde están divididos para permitir una vista tanto por encima como por debajo de la línea de flotación. Algunos escarabajos longicornio ( Cerambycidae ) y gorgojos, así como algunas luciérnagas ( Rhagophthalmidae ) [63] tienen ojos divididos, mientras que muchos tienen ojos con muescas, y unos pocos tienen ocelos , ojos pequeños y simples generalmente más atrás en la cabeza (en el vértice ); estos son más comunes en larvas que en adultos. [64] La organización anatómica de los ojos compuestos puede modificarse y depende de si una especie es principalmente crepuscular, o diurna o nocturnamente activa. [65] Los ocelos se encuentran en el escarabajo de alfombra adulto (como un ocelo central único en Dermestidae ), algunos escarabajos errantes ( Omaliinae ) y los Derodontidae . [64]

Las antenas de los escarabajos son principalmente órganos de percepción sensorial y pueden detectar movimiento, olores y sustancias químicas, [66] pero también pueden usarse para sentir físicamente el entorno de un escarabajo. Las familias de escarabajos pueden usar las antenas de diferentes maneras. Por ejemplo, cuando se mueven rápidamente, los escarabajos tigre pueden no poder ver muy bien y, en cambio, sostienen sus antenas rígidamente frente a ellos para evitar obstáculos. [67] Ciertos Cerambycidae usan antenas para equilibrarse, y los escarabajos ampolla pueden usarlas para agarrar. Algunas especies de escarabajos acuáticos pueden usar antenas para recolectar aire y pasarlo debajo del cuerpo mientras están sumergidos. Igualmente, algunas familias usan antenas durante el apareamiento, y algunas especies las usan para defenderse. En el cerambícido Onychocerus albitarsis , las antenas tienen estructuras de inyección de veneno que se usan en defensa, lo cual es único entre los artrópodos . [68] Las antenas varían mucho en forma, a veces entre los sexos, pero a menudo son similares dentro de una familia determinada. Las antenas pueden ser en forma de maza, filiformes, anguladas, con forma de collar de cuentas, con forma de peine (ya sea de un lado o de ambos, bipectinadas) o dentadas. La variación física de las antenas es importante para la identificación de muchos grupos de escarabajos. Los curculiónidos tienen antenas acodadas o geniculadas. Las antenas flabeladas con forma de pluma son una forma restringida que se encuentra en los rhipicéridos y algunas otras familias. Los silfidos tienen una antena capitada con una cabeza esférica en la punta. Los escarabajos suelen tener antenas laminadas con los segmentos terminales extendidos en estructuras largas y planas apiladas entre sí. Los carábidos suelen tener antenas con forma de hilo. Las antenas surgen entre el ojo y las mandíbulas y en los tenebriónidos, las antenas se elevan delante de una muesca que rompe el contorno habitualmente circular del ojo compuesto. Están segmentadas y suelen constar de 11 partes, la primera parte se llama escapo y la segunda parte es el pedicelo. Los otros segmentos se denominan conjuntamente flagelo. [66] [69] [70]
Los escarabajos tienen piezas bucales como las de los saltamontes . Las mandíbulas parecen pinzas grandes en la parte delantera de algunos escarabajos. Las mandíbulas son un par de estructuras duras, a menudo similares a dientes, que se mueven horizontalmente para agarrar, aplastar o cortar comida o enemigos (ver defensa, más abajo). Dos pares de apéndices similares a dedos, los palpos maxilares y labiales, se encuentran alrededor de la boca en la mayoría de los escarabajos, que sirven para mover la comida hacia la boca. En muchas especies, las mandíbulas son sexualmente dimórficas, y las de los machos son enormemente agrandadas en comparación con las de las hembras de la misma especie. [7]
El tórax está segmentado en dos partes discernibles, el protórax y el pterotórax. El pterotórax es el mesotórax y el metatórax fusionados, que comúnmente están separados en otras especies de insectos, aunque se articulan de manera flexible a partir del protórax. Cuando se ve desde abajo, el tórax es la parte de la que surgen los tres pares de patas y ambos pares de alas. El abdomen es todo lo posterior al tórax. [8] Cuando se ve desde arriba, la mayoría de los escarabajos parecen tener tres secciones claras, pero esto es engañoso: en la superficie superior del escarabajo, la sección media es una placa dura llamada pronoto , que es solo la parte frontal del tórax; la parte posterior del tórax está oculta por las alas del escarabajo . Esta segmentación adicional generalmente se ve mejor en el abdomen. [ cita requerida ]

Las patas multisegmentadas terminan en dos a cinco segmentos pequeños llamados tarsos. Como muchos otros órdenes de insectos, los escarabajos tienen garras, generalmente un par, en el extremo del último segmento tarsal de cada pata. Si bien la mayoría de los escarabajos usan sus patas para caminar, las patas se han adaptado de diversas formas para otros usos. Los escarabajos acuáticos, incluidos los Dytiscidae (escarabajos buceadores) , Haliplidae y muchas especies de Hydrophilidae , tienen las patas, a menudo el último par, modificadas para nadar, generalmente con filas de pelos largos. Los escarabajos buceadores machos tienen copas succionadoras en sus patas delanteras que usan para agarrar a las hembras. [71] Otros escarabajos tienen patas fosoriales ensanchadas y a menudo espinosas para cavar. Las especies con tales adaptaciones se encuentran entre los escarabajos, escarabajos de tierra y escarabajos payaso ( Histeridae ). Las patas traseras de algunos escarabajos, como los escarabajos pulga (dentro de los Chrysomelidae) y los gorgojos pulga (dentro de los Curculionidae), tienen fémures agrandados que los ayudan a saltar. [72]
.jpg/440px-Soldier_Beetle_Trichodes_alvearius_taking_off_from_Knapweed_(cropped).jpg)
Las alas anteriores de los escarabajos no se utilizan para volar , sino que forman élitros que cubren la parte trasera del cuerpo y protegen las alas traseras. Los élitros son generalmente estructuras duras similares a conchas que deben levantarse para permitir que las alas traseras se muevan para volar. [73] Sin embargo, en los escarabajos soldados ( Cantharidae ), los élitros son blandos, lo que le valió a esta familia el nombre de alas de cuero. [74] Otros escarabajos de alas blandas incluyen el escarabajo de alas de red Calopteron discrepans , que tiene alas frágiles que se rompen fácilmente para liberar sustancias químicas para la defensa. [75]
Las alas de vuelo de los escarabajos están cruzadas por venas y se pliegan después del aterrizaje, a menudo a lo largo de estas venas, y se almacenan debajo de los élitros. Un pliegue ( jugum ) de la membrana en la base de cada ala es característico. [73] Algunos escarabajos han perdido la capacidad de volar. Estos incluyen algunos escarabajos terrestres (Carabidae) y algunos gorgojos verdaderos (Curculionidae), así como especies que habitan en el desierto y en cuevas de otras familias. Muchos tienen los dos élitros fusionados, formando un escudo sólido sobre el abdomen. En algunas familias, se ha perdido tanto la capacidad de volar como los élitros, como en los gusanos luminosos ( Phengodidae ), donde las hembras se parecen a las larvas durante toda su vida. [76] La presencia de élitros y alas no siempre indica que el escarabajo volará. Por ejemplo, el escarabajo tanaceto camina entre hábitats a pesar de ser físicamente capaz de volar. [77]
El abdomen es la sección detrás del metatórax, formada por una serie de anillos, cada uno con un orificio para respirar y respirar, llamado espiráculo , que compone tres escleritos segmentados diferentes: el tergito, la pleura y el esternón. El tergito en casi todas las especies es membranoso, o generalmente blando y oculto por las alas y los élitros cuando no está en vuelo. Las pleuras suelen ser pequeñas o estar ocultas en algunas especies, y cada pleuron tiene un solo espiráculo. El esternón es la parte más ampliamente visible del abdomen, siendo un segmento más o menos esclerotizado. El abdomen en sí no tiene ningún apéndice, pero algunos (por ejemplo, Mordellidae ) tienen lóbulos esternales articulados. [78]
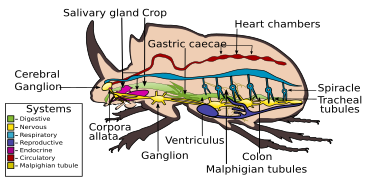
El sistema digestivo de los escarabajos está adaptado principalmente a una dieta herbívora. La digestión tiene lugar principalmente en el intestino medio anterior , aunque en grupos depredadores como los Carabidae , la mayor parte de la digestión ocurre en el buche por medio de enzimas del intestino medio. En los Elateridae , las larvas se alimentan de líquidos y digieren su alimento extraoralmente mediante la secreción de enzimas. [8] El tubo digestivo consiste básicamente en una faringe corta y estrecha , una expansión ensanchada, el buche y una molleja poco desarrollada . A esto le sigue el intestino medio, que varía en dimensiones entre especies, con una gran cantidad de ciego , y el intestino posterior, con longitudes variables. Por lo general, hay de cuatro a seis túbulos de Malpighi . [7]
El sistema nervioso de los escarabajos contiene todos los tipos que se encuentran en los insectos, variando entre las diferentes especies, desde tres ganglios torácicos y siete u ocho ganglios abdominales que se pueden distinguir hasta aquel en el que todos los ganglios torácicos y abdominales están fusionados para formar una estructura compuesta. [8]

Como la mayoría de los insectos, los escarabajos inhalan aire, por el oxígeno que contiene, y exhalan dióxido de carbono , a través de un sistema traqueal . El aire entra al cuerpo a través de espiráculos , y circula dentro del hemocele en un sistema de tráqueas y traqueolas, a través de cuyas paredes los gases pueden difundirse. [8]
Los escarabajos buceadores, como los Dytiscidae , llevan consigo una burbuja de aire cuando bucean. Dicha burbuja puede estar contenida bajo los élitros o contra el cuerpo por pelos hidrófobos especializados . La burbuja cubre al menos algunos de los espiráculos, lo que permite que el aire entre en las tráqueas. [8] La función de la burbuja no es solo contener una reserva de aire, sino actuar como una branquia física . El aire que atrapa está en contacto con agua oxigenada, por lo que, a medida que el consumo del animal agota el oxígeno en la burbuja, puede difundirse más oxígeno para reponerlo. [79] El dióxido de carbono es más soluble en agua que el oxígeno o el nitrógeno, por lo que se difunde más rápido que hacia adentro. El nitrógeno es el gas más abundante en la burbuja y el menos soluble, por lo que constituye un componente relativamente estático de la burbuja y actúa como un medio estable para que los gases respiratorios se acumulen y pasen a través de ella. Las visitas ocasionales a la superficie son suficientes para que el escarabajo restablezca la constitución de la burbuja. [80]
Al igual que otros insectos, los escarabajos tienen sistemas circulatorios abiertos , basados en hemolinfa en lugar de sangre. Al igual que en otros insectos, un corazón segmentado en forma de tubo está unido a la pared dorsal del hemocele . Tiene entradas u ostias pareadas a intervalos a lo largo de su longitud, y hace circular la hemolinfa desde la cavidad principal del hemocele hasta la cavidad anterior en la cabeza. [81]
Diferentes glándulas están especializadas para diferentes feromonas para atraer parejas. Las feromonas de las especies de Rutelinae se producen a partir de células epiteliales que recubren la superficie interna de los segmentos abdominales apicales; las feromonas basadas en aminoácidos de Melolonthinae se producen a partir de glándulas eversibles en el ápice abdominal. Otras especies producen diferentes tipos de feromonas. Los derméstidos producen ésteres y las especies de Elateridae producen aldehídos y acetatos derivados de ácidos grasos . [8] Para atraer a una pareja, las luciérnagas ( Lampyridae ) utilizan células del cuerpo graso modificadas con superficies transparentes respaldadas con cristales reflectantes de ácido úrico para producir luz por bioluminiscencia . La producción de luz es altamente eficiente, por oxidación de luciferina catalizada por enzimas ( luciferasas ) en presencia de trifosfato de adenosina (ATP) y oxígeno, produciendo oxiluciferina , dióxido de carbono y luz. [8]
Los órganos timpánicos u órganos auditivos consisten en una membrana (tímpano) estirada a lo largo de un marco respaldado por un saco aéreo y neuronas sensoriales asociadas, y se encuentran en dos familias. [82] Varias especies del género Cicindela (Carabidae) tienen órganos auditivos en las superficies dorsales de sus primeros segmentos abdominales debajo de las alas; dos tribus de Dynastinae (dentro de Scarabaeidae ) tienen órganos auditivos justo debajo de sus escudos pronotales o membranas del cuello. Ambas familias son sensibles a las frecuencias ultrasónicas, y hay evidencia sólida que indica que funcionan para detectar la presencia de murciélagos mediante su ecolocalización ultrasónica. [8]
Los escarabajos son miembros del superorden Holometabola y, en consecuencia, la mayoría de ellos experimentan una metamorfosis completa . La forma típica de metamorfosis en los escarabajos pasa por cuatro etapas principales: el huevo , la larva , la pupa y el imago o adulto. [83] Las larvas se denominan comúnmente larvas y la pupa a veces se llama crisálida. En algunas especies, la pupa puede estar encerrada en un capullo construido por la larva hacia el final de su último estadio . Algunos escarabajos, como los miembros típicos de las familias Meloidae y Rhipiphoridae , van más allá y experimentan una hipermetamorfosis en la que el primer estadio toma la forma de una triungulina . [84]

Algunos escarabajos tienen un comportamiento de apareamiento intrincado. La comunicación mediante feromonas suele ser importante para localizar a una pareja. Distintas especies utilizan diferentes feromonas. Los escarabajos peloteros , como los Rutelinae, utilizan feromonas derivadas de la síntesis de ácidos grasos y otros utilizan feromonas de compuestos orgánicos, mientras que otros escarabajos, como los Melolonthinae , utilizan aminoácidos y terpenoides. Otra forma en que los escarabajos encuentran pareja se observa en las luciérnagas (Lampyridae), que son bioluminiscentes y tienen órganos abdominales productores de luz. Los machos y las hembras entablan un diálogo complejo antes del apareamiento; cada especie tiene una combinación única de patrones de vuelo, duración, composición e intensidad de la luz producida. [8]
Antes del apareamiento, los machos y las hembras pueden estridular, o hacer vibrar los objetos sobre los que se encuentran. En Meloidae, el macho trepa al dorso de la hembra y acaricia con sus antenas la cabeza, los palpos y las antenas de la misma. En Eupompha , el macho arrastra sus antenas a lo largo de su vértice longitudinal. Es posible que no se apareen en absoluto si no realizan el ritual precopulatorio. [8] Este comportamiento de apareamiento puede ser diferente entre poblaciones dispersas de la misma especie. Por ejemplo, el apareamiento de una población rusa de escarabajo tanaceto ( Chrysolina graminis ) está precedido por un elaborado ritual en el que el macho golpea los ojos, el pronoto y las antenas de la hembra con sus antenas, lo que no es evidente en la población de esta especie en el Reino Unido . [85]
En otro ejemplo, el órgano intromitente de los escarabajos cardo tortuga macho es una estructura larga, similar a un tubo, llamada flagelo, que es delgada y curvada. Cuando no se utiliza, el flagelo se almacena dentro del abdomen del macho y puede extenderse hasta ser más largo que el macho cuando es necesario. Durante el apareamiento, este órgano se dobla hasta adoptar la forma compleja del órgano reproductor femenino , que incluye un conducto en espiral que el macho debe penetrar con el órgano. Además, se han estudiado estas propiedades físicas del escarabajo cardo tortuga porque la capacidad de una estructura delgada y flexible para endurecerse sin doblarse ni romperse es un desafío mecánico y puede tener implicaciones importantes para el desarrollo de catéteres microscópicos en la medicina moderna. [86]
La competencia puede desempeñar un papel en los rituales de apareamiento de especies como los escarabajos enterradores ( Nicrophorus ), insectos que luchan para determinar cuál puede aparearse. Muchos escarabajos machos son territoriales y defienden ferozmente sus territorios de los machos intrusos. En estas especies, el macho a menudo tiene cuernos en la cabeza o el tórax, lo que hace que su longitud corporal sea mayor que la de una hembra. La cópula es generalmente rápida, pero en algunos casos dura varias horas. Durante la cópula, se transfieren espermatozoides a la hembra para fertilizar el óvulo. [7]

En esencia, todos los escarabajos ponen huevos, aunque algunos Aleocharinae mirmecófilos y algunos Chrysomelinae que viven en las montañas o en el subártico son ovovivíparos y ponen huevos que eclosionan casi inmediatamente. [83] Los huevos de los escarabajos generalmente tienen superficies lisas y son blandos, aunque los Cupedidae tienen huevos duros. Los huevos varían ampliamente entre especies: los huevos tienden a ser pequeños en especies con muchos estadios (estadios larvarios) y en aquellas que ponen grandes cantidades de huevos. Una hembra puede poner desde varias docenas hasta varios miles de huevos durante su vida, dependiendo del grado de cuidado parental. Esto va desde la simple puesta de huevos debajo de una hoja hasta el cuidado parental proporcionado por los escarabajos , que albergan, alimentan y protegen a sus crías. Los Attelabidae enrollan las hojas y ponen sus huevos dentro del rollo para protegerse. [8] [87]
La larva es generalmente la etapa principal de alimentación del ciclo de vida del escarabajo . Las larvas tienden a alimentarse vorazmente una vez que emergen de sus huevos. Algunas se alimentan externamente en plantas, como las de ciertos escarabajos de las hojas, mientras que otras se alimentan dentro de sus fuentes de alimento. Ejemplos de alimentadores internos son la mayoría de los Buprestidae y los escarabajos longicornios. Las larvas de muchas familias de escarabajos son depredadoras como los adultos (escarabajos de tierra, mariquitas, escarabajos vagabundos). El período larvario varía entre especies, pero puede durar varios años. Las larvas de los escarabajos de la piel experimentan un grado de desarrollo inverso cuando se privan de alimento, y luego vuelven a crecer hasta el nivel de madurez alcanzado previamente. El ciclo puede repetirse muchas veces (ver Inmortalidad biológica ). [88] La morfología larvaria es muy variada entre especies, con cabezas bien desarrolladas y esclerotizadas, segmentos torácicos y abdominales distinguibles (generalmente el décimo, aunque a veces el octavo o el noveno). [7]
.jpg/440px-Hercules_beetle_(larva).jpg)
Las larvas de escarabajos se pueden diferenciar de otras larvas de insectos por sus cabezas endurecidas, a menudo oscurecidas, la presencia de piezas bucales masticadoras y espiráculos a lo largo de los lados de sus cuerpos. Al igual que los escarabajos adultos, las larvas varían en apariencia, particularmente entre las familias de escarabajos. Los escarabajos con larvas algo aplanadas y muy móviles incluyen los escarabajos terrestres y los escarabajos errantes; sus larvas se describen como campodeiformes. Algunas larvas de escarabajos se parecen a gusanos endurecidos con cápsulas de cabeza oscuras y patas diminutas. Estas son larvas elateriformes y se encuentran en las familias de los escarabajos elatéridos (Elateridae) y los escarabajos oscuros (Tenebrionidae). Algunas larvas elateriformes de los escarabajos elatéridos se conocen como gusanos de alambre. Los escarabajos de Scarabaeoidea tienen larvas cortas y gruesas descritas como escarabajos escarabajos, más comúnmente conocidos como larvas. [89]
Todas las larvas de escarabajo pasan por varios estadios , que son las etapas de desarrollo entre cada muda . En muchas especies, las larvas simplemente aumentan de tamaño con cada estadio sucesivo a medida que se consume más alimento. En algunos casos, sin embargo, ocurren cambios más dramáticos. Entre ciertas familias o géneros de escarabajos, particularmente aquellos que exhiben estilos de vida parásitos, el primer estadio (el planidium ) es altamente móvil para buscar un huésped, mientras que los siguientes estadios son más sedentarios y permanecen sobre o dentro de su huésped. Esto se conoce como hipermetamorfosis ; ocurre en Meloidae , Micromalthidae y Ripiphoridae . [90] El escarabajo ampolla Epicauta vittata (Meloidae), por ejemplo, tiene tres estadios larvarios distintos. Su primer estadio, la triungulina , tiene patas más largas para ir en busca de los huevos de los saltamontes. Después de alimentarse durante una semana, muda al segundo estadio, llamado estadio caraboide, que se asemeja a la larva de un escarabajo carábido . En una semana más, muda y adquiere la apariencia de una larva escarabeida (estadio escarabeidoide). Su penúltimo estadio larvario es la pseudopupa o larva coarcada, que hibernará y se transformará en pupa hasta la primavera siguiente. [91]
El período larvario puede variar ampliamente. Un estafilínido que se alimenta de hongos, Phanerota fasciata, experimenta tres mudas en 3,2 días a temperatura ambiente, mientras que Anisotoma sp. (Leiodidae) completa su etapa larvaria en el cuerpo fructífero de un moho mucilaginoso en 2 días y posiblemente representa el escarabajo de crecimiento más rápido. Los escarabajos derméstidos, Trogoderma inclusum, pueden permanecer en un estado larvario prolongado en condiciones desfavorables, incluso reduciendo su tamaño entre mudas. Se informa que una larva ha sobrevivido durante 3,5 años en un recipiente cerrado. [8]

Al igual que todos los holometábolos, las larvas de los escarabajos se transforman en pupas y de estas pupas emergen escarabajos adultos sexualmente maduros y completamente formados, o imagos . Las pupas nunca tienen mandíbulas (son adécticas ). En la mayoría de las pupas, los apéndices no están unidos al cuerpo y se dice que son exarados ; en algunos escarabajos (Staphylinidae, Ptiliidae, etc.) los apéndices están fusionados con el cuerpo (denominados pupas obtectas ). [7]
Los adultos tienen una longevidad extremadamente variable, desde semanas hasta años, dependiendo de la especie. [7] [51] Algunos escarabajos perforadores de madera pueden tener ciclos de vida extremadamente largos. Se cree que cuando los muebles o la madera de la casa están infestados por larvas de escarabajos, la madera ya contenía las larvas cuando se cortó por primera vez. Una estantería de abedul de 40 años de antigüedad liberó adultos de Eburia quadrigeminata ( Cerambycidae ), mientras que se ha documentado que Buprestis aurulenta y otros Buprestidae emergen hasta 51 años después de la fabricación de artículos de madera. [92]

Los élitros permiten a los escarabajos volar y moverse a través de espacios reducidos, lo que hacen plegando las delicadas alas debajo de los élitros cuando no vuelan y desplegando sus alas justo antes del despegue. El despliegue y plegado de las alas se realiza mediante músculos adheridos a la base del ala; mientras la tensión en las venas radial y cubital permanezca, las alas permanecerán rectas. [8] Algunas especies de escarabajos (muchas Cetoniinae ; algunas Scarabaeinae , Curculionidae y Buprestidae ) vuelan con los élitros cerrados, con las alas metatorácicas extendidas debajo de los márgenes laterales de los élitros. [93] La altitud alcanzada por los escarabajos en vuelo varía. Un estudio que investigó la altitud de vuelo de las especies de mariquita Coccinella septempunctata y Harmonia axyridis utilizando un radar mostró que, mientras que la mayoría en vuelo sobre una sola ubicación estaban a 150-195 m sobre el nivel del suelo, algunos alcanzaron altitudes de más de 1100 m. [94]
Muchos escarabajos errantes tienen élitros muy reducidos y, aunque son capaces de volar, la mayoría de las veces se mueven en el suelo: sus cuerpos blandos y sus fuertes músculos abdominales los hacen flexibles y les permiten meterse fácilmente en pequeñas grietas. [95]
Los escarabajos acuáticos utilizan varias técnicas para retener el aire debajo de la superficie del agua. Los escarabajos buceadores (Dytiscidae) retienen el aire entre el abdomen y los élitros cuando bucean. Los Hydrophilidae tienen pelos en la superficie inferior que retienen una capa de aire contra sus cuerpos. Los escarabajos acuáticos rastreros adultos utilizan tanto sus élitros como sus coxas traseras (el segmento basal de las patas traseras) para retener el aire, mientras que los escarabajos perinola simplemente llevan una burbuja de aire con ellos cuando bucean. [96]
Los escarabajos tienen diversas formas de comunicarse, incluyendo el uso de feromonas . El escarabajo del pino de montaña emite una feromona para atraer a otros escarabajos a un árbol. La masa de escarabajos es capaz de superar las defensas químicas del árbol. Una vez que las defensas del árbol se han agotado, los escarabajos emiten una feromona antiagregación. Esta especie puede estridular para comunicarse, [97] pero otras pueden usar el sonido para defenderse cuando son atacadas. [98]

El cuidado parental se encuentra en unas pocas familias [99] de escarabajos, tal vez para protección contra condiciones adversas y depredadores. [8] El escarabajo vagabundo Bledius spectabilis vive en marismas saladas , por lo que los huevos y las larvas están en peligro por la marea creciente . El escarabajo materno patrulla los huevos y las larvas, excavando para evitar que se inunden y se asfixien , y los protege del escarabajo carábido depredador Dicheirotrichus gustavii y de la avispa parasitoidal Barycnemis blediator , que mata alrededor del 15% de las larvas. [100]
Los escarabajos enterradores son padres atentos y participan en el cuidado y la alimentación cooperativa de sus crías. Ambos padres trabajan enterrando los cadáveres de animales pequeños para que sirvan como fuente de alimento para sus crías y construyen una cámara de cría a su alrededor. Los padres preparan el cadáver y lo protegen de los competidores y de la descomposición temprana. Después de que sus huevos eclosionan, los padres mantienen a las larvas limpias de hongos y bacterias y las ayudan a alimentarse regurgitando el alimento para ellas. [101]
Algunos escarabajos peloteros brindan cuidados parentales, recolectando excrementos de herbívoros y poniendo huevos dentro de ese suministro de alimentos, un ejemplo de aprovisionamiento masivo . Algunas especies no se van después de esta etapa, sino que permanecen para proteger a su descendencia. [102]
La mayoría de las especies de escarabajos no muestran comportamientos de cuidado parental después de que se han puesto los huevos. [103]
La subsocialidad, en la que las hembras protegen a sus crías, está bien documentada en dos familias de Chrysomelidae, Cassidinae y Chrysomelinae. [104] [105] [106] [107] [108]
La eusocialidad implica el cuidado cooperativo de la cría (incluido el cuidado de la cría de otros individuos), la superposición de generaciones dentro de una colonia de adultos y una división del trabajo en grupos reproductivos y no reproductivos. [109] Pocos organismos fuera de los himenópteros exhiben este comportamiento; el único escarabajo que lo hace es el gorgojo Austroplatypus incompertus . [110] Esta especie australiana vive en redes horizontales de túneles, en el duramen de los árboles de eucalipto . Es una de las más de 300 especies de escarabajos ambrosianos perforadores de madera que distribuyen las esporas de los hongos ambrosianos. [111] Los hongos crecen en los túneles de los escarabajos, proporcionando alimento para los escarabajos y sus larvas; las crías hembras permanecen en los túneles y mantienen el crecimiento de los hongos, probablemente nunca se reproducen. [111] [110] El cuidado cooperativo de las crías también se encuentra en los escarabajos de las pampas ( Passalidae ), donde las larvas se alimentan de las heces semidigeridas de los adultos. [112]
_on_Ipomoea_carnea_W_IMG_0593.jpg/440px-Orange_Blister_Beetle_(Mylabris_pustulata)_on_Ipomoea_carnea_W_IMG_0593.jpg)
Los escarabajos pueden explotar una amplia diversidad de fuentes de alimento disponibles en sus muchos hábitats. Algunos son omnívoros y comen tanto plantas como animales. Otros escarabajos están altamente especializados en su dieta. Muchas especies de escarabajos de las hojas, escarabajos longicornios y gorgojos son muy específicos del hospedador y se alimentan de una sola especie de planta. Los escarabajos de tierra y los escarabajos errantes ( Staphylinidae ), entre otros, son principalmente carnívoros y capturan y consumen muchos otros artrópodos y presas pequeñas, como lombrices de tierra y caracoles. Si bien la mayoría de los escarabajos depredadores son generalistas, algunas especies tienen requisitos o preferencias de presas más específicas. [113] En algunas especies, la capacidad digestiva depende de una relación simbiótica con los hongos : algunos escarabajos tienen levaduras viviendo en sus intestinos, incluidas algunas levaduras previamente no descubiertas en ningún otro lugar. [114]
La materia orgánica en descomposición es la dieta principal de muchas especies. Puede ir desde el estiércol , que es consumido por especies coprófagas (como ciertos escarabajos de la familia Scarabaeidae ), hasta los animales muertos, que son comidos por especies necrófagas (como los escarabajos carroñeros , Silphidae ). Algunos escarabajos que se encuentran en el estiércol y la carroña son de hecho depredadores. Estos incluyen miembros de la familia Histeridae y Silphidae , que se alimentan de las larvas de insectos coprófagos y necrófagos . [115] Muchos escarabajos se alimentan bajo la corteza, algunos se alimentan de madera mientras que otros se alimentan de hongos que crecen en la madera o en la hojarasca. Algunos escarabajos tienen micangias especiales , estructuras para el transporte de esporas de hongos. [116]

Los escarabajos, tanto adultos como larvas, son presa de muchos depredadores animales, incluidos mamíferos , desde murciélagos hasta roedores , aves , lagartijas , anfibios , peces , libélulas , moscas ladronas , chinches redúvidas , hormigas , otros escarabajos y arañas . [117] [118] Los escarabajos utilizan una variedad de adaptaciones antidepredadores para defenderse. Estas incluyen camuflaje y mimetismo contra depredadores que cazan por vista, toxicidad y comportamiento defensivo.
El camuflaje es común y está muy extendido entre las familias de escarabajos, especialmente entre aquellos que se alimentan de madera o vegetación, como los escarabajos de las hojas (Chrysomelidae, que suelen ser verdes) y los gorgojos . En algunas especies, la escultura o las escamas o pelos de varios colores hacen que los escarabajos como el gorgojo del aguacate Heilipus apiatus se parezcan al estiércol de las aves u otros objetos no comestibles. [117] Muchos escarabajos que viven en entornos arenosos se mimetizan con la coloración de ese sustrato. [119]

Algunos escarabajos de cuernos largos (Cerambycidae) son imitadores batesianos eficaces de las avispas . Los escarabajos pueden combinar la coloración con el mimetismo conductual, actuando como las avispas a las que ya se parecen mucho. Muchos otros escarabajos, incluidas las mariquitas , los escarabajos ampollados y los escarabajos lícidos , secretan sustancias desagradables o tóxicas para hacerlos desagradables o venenosos, y a menudo son aposemáticos , donde la coloración brillante o contrastante advierte a los depredadores; muchos escarabajos y otros insectos imitan a estas especies protegidas químicamente. [120]
.jpg/440px-Blister_beetle_(26390828032).jpg)

La defensa química es importante en algunas especies, y suele anunciarse mediante colores aposemáticos brillantes. Algunos tenebriónidos utilizan su postura para liberar sustancias químicas nocivas para advertir a los depredadores. Las defensas químicas pueden tener otros propósitos además de la protección contra los vertebrados, como la protección contra una amplia gama de microbios. Algunas especies secuestran sustancias químicas de las plantas de las que se alimentan, incorporándolas a sus propias defensas. [119]
Otras especies tienen glándulas especiales para producir sustancias químicas disuasorias. Las glándulas defensivas de los escarabajos terrestres carábidos producen una variedad de hidrocarburos , aldehídos , fenoles , quinonas , ésteres y ácidos liberados desde una abertura al final del abdomen. Los escarabajos carábidos africanos (por ejemplo, Anthia ) emplean las mismas sustancias químicas que las hormigas: ácido fórmico . [120] Los escarabajos bombarderos tienen glándulas pigidiales bien desarrolladas que se vacían desde los lados de las membranas intersegmentales entre los segmentos abdominales séptimo y octavo. La glándula está formada por dos cámaras contenedoras, una para hidroquinonas y peróxido de hidrógeno , la otra contiene peróxido de hidrógeno y enzimas catalasas . Estos productos químicos se mezclan y dan como resultado una eyección explosiva, que alcanza una temperatura de alrededor de 100 °C (212 °F), con la descomposición de la hidroquinona en hidrógeno, oxígeno y quinona. El oxígeno propulsa el aerosol químico nocivo como un chorro que puede apuntar con precisión a los depredadores. [8]
Los grandes escarabajos que viven en el suelo, como Carabidae , el escarabajo rinoceronte y los escarabajos longicornios, se defienden utilizando mandíbulas fuertes o espinas o cuernos muy esclerotizados (acorazados) para disuadir o luchar contra los depredadores. [119] Muchas especies de gorgojos que se alimentan al aire libre de las hojas de las plantas reaccionan al ataque empleando un reflejo de caída. Algunos lo combinan con la tanatosis , en la que cierran sus apéndices y "se hacen los muertos". [121] Los escarabajos chasqueadores ( Elateridae ) pueden catapultarse repentinamente fuera de peligro liberando la energía almacenada por un mecanismo de clic, que consiste en una espina robusta en el prosterno y un surco correspondiente en el mesoesterno. [117] Algunas especies sobresaltan a un atacante produciendo sonidos a través de un proceso conocido como estridulación . [98]
Unas pocas especies de escarabajos son ectoparásitos de mamíferos. Una de esas especies, Platypsyllus castoris , parasita a los castores ( Castor spp.). Este escarabajo vive como parásito tanto como larva como adulto, alimentándose de tejido epidérmico y posiblemente de secreciones de la piel y exudados de heridas. Son llamativamente aplanados dorsoventralmente, sin duda como una adaptación para deslizarse entre los pelos de los castores. No tienen alas ni ojos, como muchos otros ectoparásitos. [122] Otros son cleptoparásitos de otros invertebrados, como el pequeño escarabajo de la colmena ( Aethina tumida ) que infesta nidos de abejas melíferas , [123] mientras que muchas especies son inquilinas parásitas o comensales en los nidos de hormigas . [124] Unos pocos grupos de escarabajos son parasitoides primarios de otros insectos, alimentándose de sus huéspedes y eventualmente matándolos. [125]

Las flores polinizadas por escarabajos suelen ser grandes, de color verdoso o blanquecino y muy perfumadas. Los aromas pueden ser picantes, afrutados o similares a material orgánico en descomposición. Los escarabajos fueron probablemente los primeros insectos en polinizar flores. [126] La mayoría de las flores polinizadas por escarabajos son aplanadas o en forma de plato, con polen fácilmente accesible, aunque pueden incluir trampas para mantener al escarabajo por más tiempo. Los ovarios de las plantas suelen estar bien protegidos de las piezas bucales mordedoras de sus polinizadores. Las familias de escarabajos que habitualmente polinizan flores son Buprestidae , Cantharidae , Cerambycidae , Cleridae , Dermestidae , Lycidae , Melyridae , Mordellidae , Nitidulidae y Scarabaeidae . [127] Los escarabajos pueden ser particularmente importantes en algunas partes del mundo, como las zonas semiáridas del sur de África y el sur de California [128] y las praderas montañosas de KwaZulu-Natal en Sudáfrica. [129]

El mutualismo es bien conocido en algunos escarabajos, como el escarabajo ambrosía , que se asocia con hongos para digerir la madera de los árboles muertos. Los escarabajos excavan túneles en árboles muertos en los que cultivan jardines de hongos, su única fuente de nutrición. Después de aterrizar en un árbol adecuado, un escarabajo ambrosía excava un túnel en el que libera esporas de su simbionte fúngico . El hongo penetra en el tejido del xilema de la planta, lo digiere y concentra los nutrientes en y cerca de la superficie de la galería del escarabajo, por lo que tanto los gorgojos como el hongo se benefician. Los escarabajos no pueden comer la madera debido a las toxinas, y utilizan su relación con los hongos para ayudar a superar las defensas de su árbol huésped con el fin de proporcionar nutrición a sus larvas. [130] Mediada químicamente por un peróxido poliinsaturado producido por bacterias, [131] esta relación mutualista entre el escarabajo y el hongo es coevolucionada . [130] [132]


Alrededor del 90% de las especies de escarabajos entran en un período de diapausa adulta , una fase tranquila con metabolismo reducido para soportar condiciones ambientales desfavorables. La diapausa adulta es la forma más común de diapausa en Coleoptera. Para soportar el período sin alimento (que a menudo dura muchos meses), los adultos se preparan acumulando reservas de lípidos, glucógeno, proteínas y otras sustancias necesarias para la resistencia a futuros cambios peligrosos de las condiciones ambientales. Esta diapausa es inducida por señales que anuncian la llegada de la estación desfavorable; generalmente la señal es fotoperiódica . La duración corta (decreciente) del día sirve como señal de que se acerca el invierno e induce la diapausa invernal (hibernación). [133] Un estudio de la hibernación en el escarabajo ártico Pterostichus brevicornis mostró que los niveles de grasa corporal de los adultos eran más altos en otoño con el tubo digestivo lleno de alimento, pero vacío a fines de enero. Esta pérdida de grasa corporal fue un proceso gradual, que ocurrió en combinación con la deshidratación. [134]
Todos los insectos son poiquilotérmicos , [135] por lo que la capacidad de algunos escarabajos para vivir en ambientes extremos depende de su resiliencia a temperaturas inusualmente altas o bajas. El escarabajo de corteza Pityogenes chalcographus puede sobrevivir a -39 °C mientras hiberna bajo la corteza de los árboles; [136] el escarabajo de Alaska Cucujus clavipes puniceus es capaz de soportar -58 °C ; sus larvas pueden sobrevivir a -100 °C . [137] A estas bajas temperaturas, la formación de cristales de hielo en los fluidos internos es la mayor amenaza para la supervivencia de los escarabajos, pero esto se previene mediante la producción de proteínas anticongelantes que impiden que las moléculas de agua se agrupen. Las bajas temperaturas experimentadas por Cucujus clavipes se pueden sobrevivir a través de su deshidratación deliberada junto con las proteínas anticongelantes. Esto concentra los anticongelantes varias veces. [138] La hemolinfa del escarabajo gusano de la harina Tenebrio molitor contiene varias proteínas anticongelantes . [139] El escarabajo de Alaska Upis ceramboides puede sobrevivir a -60 °C: sus crioprotectores son el xilomanano , una molécula que consiste en un azúcar unido a un ácido graso , [140] y el alcohol de azúcar, treitol . [141]
Por el contrario, los escarabajos que habitan en el desierto están adaptados para tolerar altas temperaturas. Por ejemplo, el escarabajo tenebriónido Onymacris rugatipennis puede soportar 50 °C . [142] Los escarabajos tigre en áreas cálidas y arenosas suelen ser blanquecinos (por ejemplo, Habroscelimorpha dorsalis ), para reflejar más calor que un color más oscuro. Estos escarabajos también muestran adaptaciones de comportamiento para tolerar el calor: pueden pararse erguidos sobre sus tarsos para mantener sus cuerpos alejados del suelo caliente, buscar sombra y girarse para mirar al sol de modo que solo las partes frontales de sus cabezas estén expuestas directamente. [143]
El escarabajo de la niebla del desierto de Namib , Stenocara gracilipes , es capaz de recoger agua de la niebla , ya que sus élitros tienen una superficie texturizada que combina protuberancias hidrófilas (que aman el agua) y depresiones cerosas e hidrófobas . El escarabajo se enfrenta a la brisa matutina, sosteniendo su abdomen hacia arriba; las gotas se condensan en los élitros y corren a lo largo de las crestas hacia sus piezas bucales. Se encuentran adaptaciones similares en varios otros escarabajos del desierto de Namib, como Onymacris unguicularis . [144]
Algunos escarabajos terrestres que explotan hábitats costeros y de llanuras aluviales tienen adaptaciones fisiológicas para sobrevivir a inundaciones. En caso de inundación, los escarabajos adultos pueden ser lo suficientemente móviles como para alejarse de la inundación, pero las larvas y pupas a menudo no pueden. Los adultos de Cicindela togata no pueden sobrevivir a la inmersión en agua, pero las larvas pueden sobrevivir un período prolongado, hasta 6 días, de anoxia durante las inundaciones. La tolerancia a la anoxia en las larvas puede haberse mantenido cambiando a vías metabólicas anaeróbicas o reduciendo la tasa metabólica. [145] La tolerancia a la anoxia en el escarabajo carábido adulto Pelophilia borealis se probó en condiciones de laboratorio y se encontró que podían sobrevivir un período continuo de hasta 127 días en una atmósfera de 99,9% de nitrógeno a 0 °C. [146]
Muchas especies de escarabajos emprenden movimientos masivos anuales que se denominan migraciones. Entre ellas se encuentran el escarabajo del polen Meligethes aeneus [147] y muchas especies de coccinélidos [148] . Estos movimientos masivos también pueden ser oportunistas, en busca de alimento, en lugar de estacionales. Un estudio de 2008 de un brote inusualmente grande del escarabajo del pino de montaña ( Dendroctonus ponderosae ) en Columbia Británica descubrió que los escarabajos eran capaces de volar de 30 a 110 km por día en densidades de hasta 18.600 escarabajos por hectárea [149] .

Several species of dung beetle, especially the sacred scarab, Scarabaeus sacer, were revered in Ancient Egypt.[150][151] The hieroglyphic image of the beetle may have had existential, fictional, or ontologic significance.[152] Images of the scarab in bone, ivory, stone, Egyptian faience, and precious metals are known from the Sixth Dynasty and up to the period of Roman rule. The scarab was of prime significance in the funerary cult of ancient Egypt.[153] The scarab was linked to Khepri, the god of the rising sun, from the supposed resemblance of the rolling of the dung ball by the beetle to the rolling of the sun by the god.[150] Some of ancient Egypt's neighbors adopted the scarab motif for seals of varying types. The best-known of these are the Judean LMLK seals, where eight of 21 designs contained scarab beetles, which were used exclusively to stamp impressions on storage jars during the reign of Hezekiah.[154] Beetles are mentioned as a symbol of the sun, as in ancient Egypt, in Plutarch's 1st century Moralia.[155] The Greek Magical Papyri of the 2nd century BC to the 5th century AD describe scarabs as an ingredient in a spell.[156]
Pliny the Elder discusses beetles in his Natural History,[157] describing the stag beetle: "Some insects, for the preservation of their wings, are covered with an erust (elytra)—the beetle, for instance, the wing of which is peculiarly fine and frail. To these insects a sting has been denied by Nature; but in one large kind we find horns of a remarkable length, two-pronged at the extremities, and forming pincers, which the animal closes when it is its intention to bite."[158][159] The stag beetle is recorded in a Greek myth by Nicander and recalled by Antoninus Liberalis in which Cerambus[b] is turned into a beetle: "He can be seen on trunks and has hook-teeth, ever moving his jaws together. He is black, long and has hard wings like a great dung beetle".[160] The story concludes with the comment that the beetles were used as toys by young boys, and that the head was removed and worn as a pendant.[159][161]

About 75% of beetle species are phytophagous in both the larval and adult stages. Many feed on economically important plants and stored plant products, including trees, cereals, tobacco, and dried fruits.[7] Some, such as the boll weevil, which feeds on cotton buds and flowers, can cause extremely serious damage to agriculture. The boll weevil crossed the Rio Grande near Brownsville, Texas, to enter the United States from Mexico around 1892,[162] and had reached southeastern Alabama by 1915. By the mid-1920s, it had entered all cotton-growing regions in the US, traveling 40 to 160 miles (60–260 km) per year. It remains the most destructive cotton pest in North America. Mississippi State University has estimated, since the boll weevil entered the United States, it has cost cotton producers about $13 billion, and in recent times about $300 million per year.[162]
The bark beetle, elm leaf beetle and the Asian longhorned beetle (Anoplophora glabripennis)[163] are among the species that attack elm trees. Bark beetles (Scolytidae) carry Dutch elm disease as they move from infected breeding sites to healthy trees. The disease has devastated elm trees across Europe and North America.[164]

Some species of beetle have evolved immunity to insecticides. For example, the Colorado potato beetle, Leptinotarsa decemlineata, is a destructive pest of potato plants. Its hosts include other members of the Solanaceae, such as nightshade, tomato, eggplant and capsicum, as well as the potato. Different populations have between them developed resistance to all major classes of insecticide.[165] The Colorado potato beetle was evaluated as a tool of entomological warfare during World War II, the idea being to use the beetle and its larvae to damage the crops of enemy nations.[166] Germany tested its Colorado potato beetle weaponisation program south of Frankfurt, releasing 54,000 beetles.[167]
The death watch beetle, Xestobium rufovillosum (Ptinidae), is a serious pest of older wooden buildings in Europe. It attacks hardwoods such as oak and chestnut, always where some fungal decay has taken or is taking place. The actual introduction of the pest into buildings is thought to take place at the time of construction.[168]
Other pests include the coconut hispine beetle, Brontispa longissima, which feeds on young leaves, seedlings and mature coconut trees, causing serious economic damage in the Philippines.[169] The mountain pine beetle is a destructive pest of mature or weakened lodgepole pine, sometimes affecting large areas of Canada.[170]

Beetles can be beneficial to human economics by controlling the populations of pests. The larvae and adults of some species of lady beetles (Coccinellidae) feed on aphids that are pests. Other lady beetles feed on scale insects, whitefly and mealybugs.[171] If normal food sources are scarce, they may feed on small caterpillars, young plant bugs, or honeydew and nectar.[172] Ground beetles (Carabidae) are common predators of many insect pests, including fly eggs, caterpillars, and wireworms.[173] Ground beetles can help to control weeds by eating their seeds in the soil, reducing the need for herbicides to protect crops.[174] The effectiveness of some species in reducing certain plant populations has resulted in the deliberate introduction of beetles in order to control weeds. For example, the genus Calligrapha is native to North America but has been used to control Parthenium hysterophorus in India and Ambrosia artemisiifolia in Russia.[175][176]
Dung beetles (Scarabidae) have been successfully used to reduce the populations of pestilent flies, such as Musca vetustissima and Haematobia exigua which are serious pests of cattle in Australia.[177] The beetles make the dung unavailable to breeding pests by quickly rolling and burying it in the soil, with the added effect of improving soil fertility, tilth, and nutrient cycling.[178] The Australian Dung Beetle Project (1965–1985), introduced species of dung beetle to Australia from South Africa and Europe to reduce populations of Musca vetustissima, following successful trials of this technique in Hawaii.[177] The American Institute of Biological Sciences reports that dung beetles, such as Euoniticellus intermedius, save the United States cattle industry an estimated US$380 million annually through burying above-ground livestock feces.[179]
The Dermestidae are often used in taxidermy and in the preparation of scientific specimens, to clean soft tissue from bones.[180] Larvae feed on and remove cartilage along with other soft tissue.[181][182]

Beetles are the most widely eaten insects, with about 344 species used as food, usually at the larval stage.[183] The mealworm (the larva of the darkling beetle) and the rhinoceros beetle are among the species commonly eaten.[184] A wide range of species is also used in folk medicine to treat those suffering from a variety of disorders and illnesses, though this is done without clinical studies supporting the efficacy of such treatments.[185]
Due to their habitat specificity, many species of beetles have been suggested as suitable as indicators, their presence, numbers, or absence providing a measure of habitat quality. Predatory beetles such as the tiger beetles (Cicindelidae) have found scientific use as an indicator taxon for measuring regional patterns of biodiversity. They are suitable for this as their taxonomy is stable; their life history is well described; they are large and simple to observe when visiting a site; they occur around the world in many habitats, with species specialised to particular habitats; and their occurrence by species accurately indicates other species, both vertebrate and invertebrate.[186] According to the habitats, many other groups such as the rove beetles in human-modified habitats, dung beetles in savannas[187] and saproxylic beetles in forests[188] have been suggested as potential indicator species.[189]


Many beetles have durable elytra that has been used as material in art, with beetlewing the best example.[190] Sometimes, they are incorporated into ritual objects for their religious significance. Whole beetles, either as-is or encased in clear plastic, are made into objects ranging from cheap souvenirs such as key chains to expensive fine-art jewellery. In parts of Mexico, beetles of the genus Zopherus are made into living brooches by attaching costume jewelry and golden chains, which is made possible by the incredibly hard elytra and sedentary habits of the genus.[191]
Fighting beetles are used for entertainment and gambling. This sport exploits the territorial behavior and mating competition of certain species of large beetles. In the Chiang Mai district of northern Thailand, male Xylotrupes rhinoceros beetles are caught in the wild and trained for fighting. Females are held inside a log to stimulate the fighting males with their pheromones.[192] These fights may be competitive and involve gambling both money and property.[193] In South Korea the Dytiscidae species Cybister tripunctatus is used in a roulette-like game.[194]
Beetles are sometimes used as instruments: the Onabasulu of Papua New Guinea historically used the "hugu" weevil Rhynchophorus ferrugineus as a musical instrument by letting the human mouth serve as a variable resonance chamber for the wing vibrations of the live adult beetle.[193]
Some species of beetle are kept as pets, for example diving beetles (Dytiscidae) may be kept in a domestic fresh water tank.[195]

In Japan the practice of keeping horned rhinoceros beetles (Dynastinae) and stag beetles (Lucanidae) is particularly popular amongst young boys.[196] Such is the popularity in Japan that vending machines dispensing live beetles were developed in 1999, each holding up to 100 stag beetles.[197][198]
Beetle collecting became extremely popular in the Victorian era.[199] The naturalist Alfred Russel Wallace collected (by his own count) a total of 83,200 beetles during the eight years described in his 1869 book The Malay Archipelago, including 2,000 species new to science.[200]
Several coleopteran adaptations have attracted interest in biomimetics with possible commercial applications. The bombardier beetle's powerful repellent spray has inspired the development of a fine mist spray technology, claimed to have a low carbon impact compared to aerosol sprays.[201] Moisture harvesting behavior by the Namib desert beetle (Stenocara gracilipes) has inspired a self-filling water bottle which utilises hydrophilic and hydrophobic materials to benefit people living in dry regions with no regular rainfall.[202]
Living beetles have been used as cyborgs. A Defense Advanced Research Projects Agency funded project implanted electrodes into Mecynorhina torquata beetles, allowing them to be remotely controlled via a radio receiver held on its back, as proof-of-concept for surveillance work.[203] Similar technology has been applied to enable a human operator to control the free-flight steering and walking gaits of Mecynorhina torquata as well as graded turning and backward walking of Zophobas morio.[204][205][206]
Research published in 2020 sought to create a robotic camera backpack for beetles. Miniature cameras weighing 248 mg were attached to live beetles of the Tenebrionid genera Asbolus and Eleodes. The cameras filmed over a 60° range for up to 6 hours.[207][208]
Since beetles form such a large part of the world's biodiversity, their conservation is important, and equally, loss of habitat and biodiversity is essentially certain to impact on beetles. Many species of beetles have very specific habitats and long life cycles that make them vulnerable. Some species are highly threatened while others are already feared extinct.[209] Island species tend to be more susceptible as in the case of Helictopleurus undatus of Madagascar which is thought to have gone extinct during the late 20th century.[210] Conservationists have attempted to arouse a liking for beetles with flagship species like the stag beetle, Lucanus cervus,[211] and tiger beetles (Cicindelidae). In Japan the Genji firefly, Luciola cruciata, is extremely popular, and in South Africa the Addo elephant dung beetle offers promise for broadening ecotourism beyond the big five tourist mammal species. Popular dislike of pest beetles, too, can be turned into public interest in insects, as can unusual ecological adaptations of species like the fairy shrimp hunting beetle, Cicinis bruchi.[212]
The yellow mealworm beetle, Tenebrio molitor, contains a family of small Cys-rich and Thr-rich thermal hysteresis proteins that depress the hemolymph freezing point below the melting point by as much as 5.58°C(ΔT=thermal hysteresis). Thermal hysteresis protein expression was evaluated throughout development and after exposure to altered environmental conditions.
the Victorian mania for beetle collecting
{{cite journal}}: CS1 maint: numeric names: authors list (link)