La hemeritrina (también escrita hemeritrina ; griego antiguo : αἷμα , romanizado : haîma , iluminado. 'sangre', griego antiguo : ἐρυθρός , romanizado : erythrós , iluminado. 'rojo') es una proteína oligomérica responsable del transporte de oxígeno (O 2 ) en el filos de invertebrados marinos de sipunculidos , priapulidos , braquiópodos y en un solo género de gusanos anélidos , Magelona . La miohemeritrina es una proteína monomérica fijadora de O 2 que se encuentra en los músculos de los invertebrados marinos. La hemeritrina y la miohemeritrina son esencialmente incoloras cuando se desoxigenan, pero se vuelven de color rosa violeta en el estado oxigenado.
La hemeritrina no contiene, como su nombre indica, un hemo . Los nombres de los transportadores de oxígeno en sangre hemoglobina , hemocianina y hemeritrina no se refieren al grupo hemo (solo se encuentra en las globinas). En cambio, estos nombres se derivan de la palabra griega que significa sangre. La hemeritrina también puede contribuir a la inmunidad innata y a la regeneración del tejido anterior en ciertos gusanos. [1]
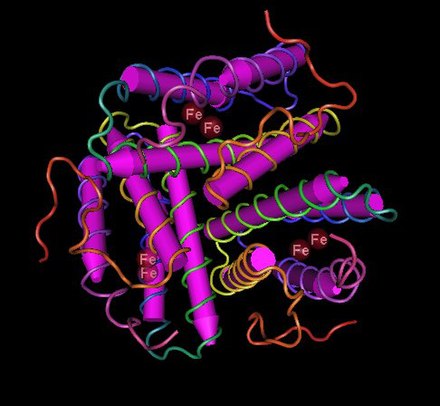
El mecanismo de unión del dioxígeno es inusual. La mayoría de los transportadores de O 2 operan mediante la formación de complejos de dioxígeno , pero la hemeritrina retiene el O 2 como un hidroperóxido (HO 2 o -OOH − ). El sitio que se une al O 2 consta de un par de centros de hierro. Los átomos de hierro están unidos a la proteína a través de las cadenas laterales de carboxilato de un glutamato y aspartato , así como a través de cinco residuos de histidina . La hemeritrina y la miohemeritrina se describen a menudo según los estados de oxidación y ligadura del centro del hierro:
La absorción de O 2 por la hemeritrina va acompañada de una oxidación de dos electrones del centro difuso para producir un complejo de hidroperóxido (OOH − ). La unión del O 2 se describe aproximadamente en este diagrama:
La desoxihemeritrina contiene dos iones ferrosos de alto espín unidos por un grupo hidroxilo ( A ). Un hierro es hexacoordinado y otro es pentacoordinado. Un grupo hidroxilo sirve como ligando puente pero también funciona como donador de protones al sustrato de O2 . Esta transferencia de protones da como resultado la formación de un puente de un solo átomo de oxígeno (μ-oxo) en oxi- y mememeritrina. El O 2 se une al centro pentacoordinado Fe 2+ en el sitio de coordinación vacante ( B ). Luego, los electrones se transfieren desde los iones ferrosos para generar el centro férrico binuclear (Fe 3+ , Fe 3+ ) con peróxido unido ( C ). [2] [3]

La hemeritrina suele existir como un homooctámero o heterooctámero compuesto de subunidades de tipo α y β de 13 a 14 kDa cada una, aunque algunas especies tienen hemeritrinas diméricas, triméricas y tetraméricas. Cada subunidad tiene un pliegue de cuatro hélices α que une un centro de hierro binuclear. Debido a su tamaño, la hemeritrina generalmente se encuentra en células o "corpúsculos" de la sangre en lugar de flotar libremente.
A diferencia de la hemoglobina, la mayoría de las hemeritrinas carecen de unión cooperativa con el oxígeno, lo que las hace aproximadamente 1/4 tan eficientes como la hemoglobina. Sin embargo, en algunos braquiópodos , la hemeritrina muestra unión cooperativa de O 2 . La unión cooperativa se logra mediante interacciones entre subunidades: la oxigenación de una subunidad aumenta la afinidad de una segunda unidad por el oxígeno.
La afinidad de la hemeritrina por el monóxido de carbono (CO) es en realidad menor que su afinidad por el O 2 , a diferencia de la hemoglobina que tiene una afinidad muy alta por el CO. La baja afinidad de la hemeritrina por el envenenamiento por CO refleja el papel de los enlaces de hidrógeno en la unión del O 2 , un modo de vía que es incompatible con los complejos de CO que normalmente no forman enlaces de hidrógeno.
El dominio de unión al catión hemeritrina/HHE se presenta como un dominio duplicado en hemeritrinas, miohemeritrinas y proteínas relacionadas. Este dominio se une al hierro en la hemeritrina, pero puede unirse a otros metales en proteínas relacionadas, como el cadmio en la hemeritrina Nereis diversicolor . También se encuentra en la proteína NorA de Cupriavidus necator , esta proteína es un regulador de la respuesta al óxido nítrico , lo que sugiere una configuración diferente para sus ligandos metálicos . Una proteína de Cryptococcus neoformans (Filobasidiella neoformans) que contiene dominios de unión a cationes hemeritrina/HHE también participa en la respuesta al óxido nítrico. [4] Se ha observado que una proteína de Staphylococcus aureus que contiene este dominio, la proteína reparadora de grupos de hierro y azufre ScdA, es importante cuando el organismo pasa a vivir en ambientes con bajas concentraciones de oxígeno; Quizás esta proteína actúe como depósito o eliminador de oxígeno. [5]
Las proteínas hemeritrina/HHE (H-HxxxE-HxxxH-HxxxxD) que se encuentran en las bacterias están implicadas en la transducción de señales y la quimiotaxis . Las relacionadas más lejanamente incluyen las proteínas H-HxxxE-H-HxxxE (incluida la ligasa E3 ) y las proteínas animales F-box (H-HExxE-H-HxxxE). [6]
{{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )