_resting_in_a_crowd_on_Wahlbergøya,_Svalbard_(3).jpg/440px-Walrus_(Odobenus_rosmarus)_resting_in_a_crowd_on_Wahlbergøya,_Svalbard_(3).jpg)
La bioturbación se define como la reelaboración de suelos y sedimentos por parte de animales o plantas. Incluye excavación, ingestión y defecación de granos de sedimento. Las actividades bioturbantes tienen un efecto profundo en el medio ambiente y [2] se cree que son un impulsor principal de la biodiversidad . [3] El estudio formal de la bioturbación comenzó en el siglo XIX cuando Charles Darwin experimentó en su jardín. [3] La alteración de los sedimentos acuáticos y los suelos terrestres a través de actividades bioturbantes proporciona importantes servicios ecosistémicos . Estos incluyen la alteración de los nutrientes en los sedimentos acuáticos y el agua suprayacente, el refugio de otras especies en forma de madrigueras en ecosistemas terrestres y acuáticos, y la producción de suelo en la tierra. [4] [5]
Los bioturbadores se consideran ingenieros de ecosistemas porque alteran la disponibilidad de recursos para otras especies a través de los cambios físicos que realizan en sus entornos. [5] Este tipo de cambio en el ecosistema afecta la evolución de las especies que cohabitan y el medio ambiente, [5] lo cual es evidente en los rastros fósiles dejados en los sedimentos marinos y terrestres. Otros efectos de la bioturbación incluyen la alteración de la textura de los sedimentos ( diagénesis ), la bioirrigación y el desplazamiento de microorganismos y partículas no vivas. En ocasiones se confunde la bioturbación con el proceso de biorrigación, sin embargo estos procesos se diferencian en lo que se mezclan; La biorrigación se refiere a la mezcla de agua y solutos en sedimentos y es un efecto de la bioturbación. [3]
Las morsas , los salmones y las tuzas son ejemplos de grandes bioturbadores. [6] [7] [1] Aunque las actividades de estos grandes bioturbadores de macrofauna son más notorias, los bioturbadores dominantes son pequeños invertebrados, como lombrices de tierra , poliquetos , camarones fantasma , camarones de barro y larvas de mosquitos . [3] [8] Las actividades de estos pequeños invertebrados, que incluyen excavar, ingerir y defecar granos de sedimento, contribuyen a la mezcla y la alteración de la estructura del sedimento.
Los bioturbadores se han organizado mediante una variedad de agrupaciones funcionales basadas en características ecológicas o efectos biogeoquímicos. [9] [10] Si bien la categorización predominante se basa en la forma en que los bioturbadores transportan e interactúan con los sedimentos, las diversas agrupaciones probablemente surgen de la relevancia de un modo de categorización para un campo de estudio (como la ecología o la biogeoquímica de sedimentos) y un intento organizar de manera concisa la amplia variedad de organismos bioturbantes en clases que describen su función. Ejemplos de categorizaciones incluyen aquellas basadas en alimentación y motilidad, [11] alimentación e interacciones biológicas, [12] y modos de movilidad. [13] El conjunto de agrupaciones más común se basa en el transporte de sedimentos y son los siguientes:


La evaluación del papel ecológico de los bioturbadores ha sido en gran medida específica de cada especie. [8] Sin embargo, su capacidad para transportar solutos, como el oxígeno disuelto, mejorar la descomposición y diagénesis de la materia orgánica y alterar la estructura de los sedimentos los ha hecho importantes para la supervivencia y la colonización de otras comunidades microbianas y de macrofauna. [8]
Las comunidades microbianas están muy influenciadas por las actividades de los bioturbadores, ya que el aumento del transporte de oxidantes energéticamente más favorables , como el oxígeno, a sedimentos típicamente muy reducidos en profundidad altera los procesos metabólicos microbianos que ocurren alrededor de las madrigueras. [17] [15] A medida que los bioturbadores excavan, también aumentan la superficie de los sedimentos a través de la cual se pueden intercambiar solutos oxidados y reducidos, aumentando así el metabolismo general de los sedimentos. [18] Este aumento en el metabolismo de los sedimentos y la actividad microbiana da como resultado una mayor descomposición de la materia orgánica y una mayor absorción de oxígeno en los sedimentos. [15] Además de los efectos de la actividad de excavación en las comunidades microbianas, los estudios sugieren que la materia fecal bioturbadora proporciona una fuente de alimento altamente nutritiva para los microbios y otra macrofauna, mejorando así la actividad microbiana bentónica. [15] Este aumento de la actividad microbiana por parte de los bioturbadores puede contribuir a una mayor liberación de nutrientes a la columna de agua suprayacente. [19] Los nutrientes liberados por la descomposición microbiana mejorada de la materia orgánica, en particular los nutrientes limitantes, como el amonio, pueden tener efectos de abajo hacia arriba en los ecosistemas y dar como resultado un mayor crecimiento de fitoplancton y bacterioplancton. [19] [20] [21]
Las madrigueras ofrecen protección contra la depredación y las duras condiciones ambientales. [7] Por ejemplo, las termitas ( Macrotermes bellicosus ) excavan y crean montículos que tienen un complejo sistema de conductos de aire y dispositivos de evaporación que crean un microclima adecuado en un entorno físico desfavorable. [22] Muchas especies se sienten atraídas por las madrigueras de bioturbadores debido a sus capacidades protectoras. [7] El uso compartido de madrigueras ha permitido la evolución de relaciones simbióticas entre los bioturbadores y las muchas especies que utilizan sus madrigueras. [23] [24] Por ejemplo, gobios, gusanos escamosos y cangrejos viven en las madrigueras hechas por los gusanos posaderos. [25] Las interacciones sociales proporcionan evidencia de coevolución entre los huéspedes y sus simbiontes de madriguera. [26] [22] Esto se ejemplifica con las asociaciones camarón-gobio. [26] Las madrigueras de camarones brindan refugio a los gobios y los gobios sirven como exploradores en la boca de la madriguera, señalando la presencia de un peligro potencial. [26] Por el contrario, el gobio ciego Typhlogobius californiensis vive en la parte profunda de las madrigueras de camarones Callianassa , donde no hay mucha luz. [7] El gobio ciego es un ejemplo de una especie que es comensalista obligado , lo que significa que su existencia depende del bioturbador huésped y su madriguera. [7] Aunque los gobios ciegos recién nacidos tienen ojos completamente desarrollados, sus ojos se retraen y se cubren de piel a medida que se desarrollan. [7] Muestran evidencia de evolución morfológica comensal porque se plantea la hipótesis de que la falta de luz en las madrigueras donde residen los gobios ciegos es responsable de la pérdida evolutiva de los ojos funcionales. [7]
Los bioturbadores también pueden inhibir la presencia de otros organismos bentónicos asfixiándolos, exponiéndolos a depredadores o competencia por recursos. [27] [28] Si bien los camarones talasínidos pueden proporcionar refugio a algunos organismos y cultivar relaciones entre especies dentro de sus madrigueras, también se ha demostrado que tienen fuertes efectos negativos en otras especies, especialmente aquellas de bivalvos y gasterópodos que pastan en la superficie , porque los camarones talasínidos pueden asfixia a los bivalvos cuando resuspenden el sedimento. También se ha demostrado que excluyen o inhiben poliquetos, cumáceos y anfípodos . [29] [30] [28] Esto se ha convertido en un problema grave en el noroeste de los Estados Unidos, ya que el camarón fantasma y el camarón de barro (camarón talassinideo) se consideran plagas para las operaciones de acuicultura de bivalvos . [31] La presencia de bioturbadores puede tener efectos tanto negativos como positivos en el reclutamiento de larvas de congéneres (aquellos de la misma especie) y de otras especies, ya que la resuspensión de sedimentos y la alteración del flujo en la interfaz sedimento-agua pueden afectan la capacidad de las larvas para excavar y permanecer en los sedimentos. [32] Este efecto es en gran medida específico de cada especie, ya que las diferencias entre especies en los modos de resuspensión y excavación tienen efectos variables en la dinámica de fluidos en la interfaz sedimento-agua. [32] Los bioturbadores que se alimentan de depósitos también pueden obstaculizar el reclutamiento al consumir larvas recientemente asentadas. [33]
Desde su inicio hace unos 539 millones de años, la bioturbación ha sido responsable de cambios en la química de los océanos , principalmente a través del ciclo de nutrientes. [34] Los bioturbadores desempeñaron, y continúan desempeñando, un papel importante en el transporte de nutrientes a través de los sedimentos. [34]
Por ejemplo, se supone que los animales bioturbantes afectaron el ciclo del azufre en los primeros océanos. Según esta hipótesis, las actividades bioturbantes tuvieron un gran efecto sobre la concentración de sulfato en el océano. Alrededor del límite Cámbrico-Precámbrico (hace 539 millones de años), los animales comenzaron a mezclar azufre reducido de los sedimentos oceánicos con el agua suprayacente, lo que provocó que el sulfuro se oxidara, lo que aumentó la composición de sulfato en el océano. Durante grandes eventos de extinción, la concentración de sulfato en el océano se redujo. Aunque esto es difícil de medir directamente, las composiciones de isótopos de azufre del agua de mar durante estos tiempos indican que los bioturbadores influyeron en el ciclo del azufre en la Tierra primitiva.
Los bioturbadores también han alterado el ciclo del fósforo a escalas geológicas. [35] Los bioturbadores mezclan partículas de fósforo orgánico (P) fácilmente disponibles a mayor profundidad en las capas de sedimentos oceánicos, lo que evita la precipitación de fósforo (mineralización) al aumentar el secuestro de fósforo por encima de las tasas químicas normales. El secuestro de fósforo limita las concentraciones de oxígeno al disminuir la producción en una escala de tiempo geológico. [36] Esta disminución en la producción da como resultado una disminución general en los niveles de oxígeno, y se ha propuesto que el aumento de la bioturbación corresponde a una disminución en los niveles de oxígeno de ese tiempo. [36] La retroalimentación negativa de los animales que secuestran fósforo en los sedimentos y posteriormente reducen las concentraciones de oxígeno en el medio ambiente limita la intensidad de la bioturbación en este entorno temprano. [36]
La bioturbación puede mejorar o reducir el flujo de contaminantes desde el sedimento a la columna de agua, dependiendo del mecanismo de transporte de sedimento. [37] En los sedimentos contaminados , los animales bioturbantes pueden mezclar la capa superficial y provocar la liberación de contaminantes secuestrados en la columna de agua. [38] [39] Las especies transportadoras ascendentes, como los gusanos poliquetos, son eficientes para mover partículas contaminadas a la superficie. [40] [39] Los animales invasores pueden removilizar contaminantes que antes se consideraban enterrados a una profundidad segura. En el Mar Báltico , la especie invasora Marenzelleria de gusanos poliquetos puede excavar entre 35 y 50 centímetros más que los animales nativos, liberando así contaminantes previamente secuestrados. [38] [37] Sin embargo, los animales bioturbantes que viven en el sedimento ( infauna ) también pueden reducir el flujo de contaminantes a la columna de agua enterrando contaminantes orgánicos hidrofóbicos en el sedimento. [37] El entierro de partículas no contaminadas por organismos bioturbantes proporciona superficies más absorbentes para secuestrar contaminantes químicos en los sedimentos. [39]
El ciclo de nutrientes todavía se ve afectado por la bioturbación en la Tierra moderna. A continuación se muestran algunos ejemplos en los ecosistemas terrestres y acuáticos.

Las plantas y los animales utilizan el suelo como alimento y refugio, alterando las capas superiores del suelo y transportando rocas erosionadas químicamente llamadas saprolita desde las profundidades inferiores del suelo hasta la superficie. [3] La bioturbación terrestre es importante en la producción del suelo, el entierro, el contenido de materia orgánica y el transporte pendiente abajo. Las raíces de los árboles son fuentes de materia orgánica del suelo , y el crecimiento de las raíces y la descomposición de los tocones también contribuyen al transporte y la mezcla del suelo. [3] La muerte y descomposición de las raíces de los árboles primero entrega materia orgánica al suelo y luego crea huecos, disminuyendo la densidad del suelo. El arranque de árboles provoca un desplazamiento considerable del suelo al producir montículos, mezclar el suelo o invertir secciones verticales del suelo. [3]
Los animales excavadores , como las lombrices de tierra y los pequeños mamíferos, forman conductos para el transporte de aire y agua que cambian las propiedades del suelo, como la distribución vertical del tamaño de las partículas , la porosidad del suelo y el contenido de nutrientes. [3] Los invertebrados que excavan y consumen detritos de plantas ayudan a producir una capa superior del suelo rica en materia orgánica conocida como biomanto del suelo y, por lo tanto, contribuyen a la formación de horizontes del suelo. [4] Los pequeños mamíferos como las tuzas también desempeñan un papel importante en la producción de suelo, posiblemente con la misma magnitud que los procesos abióticos. [41] Las tuzas de bolsillo forman montículos sobre el suelo, que mueven el suelo desde los horizontes inferiores hacia la superficie, exponiendo la roca mínimamente erosionada a procesos de erosión superficial, acelerando la formación del suelo . [3] Se cree que las tuzas de bolsillo desempeñan un papel importante en el transporte de suelo pendiente abajo, ya que el suelo que forma sus montículos es más susceptible a la erosión y al transporte posterior. De manera similar a los efectos de las raíces de los árboles, la construcción de madrigueras, incluso cuando se rellenan, disminuye la densidad del suelo. [41] La formación de montículos superficiales también entierra la vegetación superficial, creando puntos críticos de nutrientes cuando la vegetación se descompone, aumentando la materia orgánica del suelo. Debido a las altas demandas metabólicas de su estilo de vida subterráneo de excavación de madrigueras, las tuzas de bolsillo deben consumir grandes cantidades de material vegetal. [41] Aunque esto tiene un efecto perjudicial en las plantas individuales, el efecto neto de las tuzas de bolsillo es un mayor crecimiento de las plantas debido a sus efectos positivos sobre el contenido de nutrientes del suelo y las propiedades físicas del suelo. [41]
Fuentes importantes de bioturbación en los ecosistemas de agua dulce incluyen peces bentívoros (que viven en el fondo), macroinvertebrados como gusanos, larvas de insectos, crustáceos y moluscos, e influencias estacionales de peces anádromos (migratorios) como el salmón. Los peces anádromos migran del mar a ríos y arroyos de agua dulce para desovar. Los macroinvertebrados actúan como bombas biológicas para mover material entre los sedimentos y la columna de agua, alimentándose de la materia orgánica de los sedimentos y transportando nutrientes mineralizados a la columna de agua. [42] Tanto los peces bentívoros como los anádromos pueden afectar los ecosistemas al disminuir la producción primaria a través de la resuspensión de sedimentos, [42] el desplazamiento posterior de los productores primarios bentónicos y el reciclaje de nutrientes del sedimento a la columna de agua. [43] [44]

Los sedimentos de los ecosistemas de lagos y estanques son ricos en materia orgánica, con mayores contenidos de materia orgánica y nutrientes en los sedimentos que en el agua suprayacente. [42] La regeneración de nutrientes a través de la bioturbación de sedimentos mueve los nutrientes hacia la columna de agua, mejorando así el crecimiento de las plantas acuáticas y el fitoplancton ( productores primarios ). [42] Los principales nutrientes de interés en este flujo son el nitrógeno y el fósforo, que a menudo limitan los niveles de producción primaria en un ecosistema. [42] La bioturbación aumenta el flujo de formas mineralizadas (inorgánicas) de estos elementos, que pueden ser utilizadas directamente por los productores primarios. Además, la bioturbación aumenta las concentraciones de materia orgánica que contiene nitrógeno y fósforo en la columna de agua, que luego pueden ser consumidas por la fauna y mineralizadas. [42]
Los sedimentos de lagos y estanques a menudo pasan del carácter aeróbico (que contiene oxígeno) del agua superpuesta a las condiciones anaeróbicas (sin oxígeno) del sedimento inferior en profundidades de sedimento de sólo unos pocos milímetros; por lo tanto, incluso los bioturbadores de tamaño modesto pueden afectar esta transición. de las características químicas de los sedimentos. [42] Al mezclar sedimentos anaeróbicos en la columna de agua, los bioturbadores permiten que los procesos aeróbicos interactúen con los sedimentos resuspendidos y las superficies de sedimentos del fondo recién expuestas. [42]
Los macroinvertebrados, incluidas las larvas de quironómidos (mosquitos que no pican) y los gusanos tubífidos (gusanos detritus), son agentes importantes de bioturbación en estos ecosistemas y tienen diferentes efectos según sus respectivos hábitos alimentarios. Los gusanos tubífidos no forman madrigueras, son transportadores ascendentes. Los quironómidos, por otro lado, forman madrigueras en el sedimento, actúan como bioirrigadores y airean los sedimentos y son transportadores descendentes. Esta actividad, combinada con la respiración de los quironómidos dentro de sus madrigueras, disminuye el oxígeno disponible en el sedimento y aumenta la pérdida de nitratos a través de mayores tasas de desnitrificación . [42]
El aumento del aporte de oxígeno a los sedimentos mediante la bioirrigación de macroinvertebrados junto con la bioturbación en la interfaz sedimento-agua complica el flujo total de fósforo. Mientras que la bioturbación da como resultado un flujo neto de fósforo hacia la columna de agua, la bioirrigación de los sedimentos con agua oxigenada mejora la adsorción de fósforo en compuestos de óxido de hierro, reduciendo así el flujo total de fósforo hacia la columna de agua. [42]
La presencia de macroinvertebrados en los sedimentos puede iniciar una bioturbación debido a su condición de importante fuente de alimento para peces bentívoros como la carpa . [42] De las especies de peces bentívoros bioturbantes, las carpas en particular son importantes ingenieros de ecosistemas y sus actividades de búsqueda de alimento y excavación pueden alterar las características de la calidad del agua de estanques y lagos. [43] Las carpas aumentan la turbidez del agua mediante la resuspensión de sedimentos bentónicos. Este aumento de turbidez limita la penetración de la luz y, junto con un mayor flujo de nutrientes desde el sedimento hacia la columna de agua, inhibe el crecimiento de macrófitos (plantas acuáticas) favoreciendo el crecimiento de fitoplancton en las aguas superficiales. Las colonias de fitoplancton superficiales se benefician tanto del aumento de nutrientes suspendidos como del reclutamiento de células de fitoplancton enterradas liberadas de los sedimentos por la bioturbación de los peces. [42] También se ha demostrado que el crecimiento de macrófitos se ve inhibido por el desplazamiento de los sedimentos del fondo debido a las excavaciones de peces. [43]
Los ecosistemas de ríos y arroyos muestran respuestas similares a las actividades de bioturbación, y las larvas de quironómidos y los macroinvertebrados de gusanos tubífidos siguen siendo importantes agentes bentónicos de bioturbación. [45] Estos ambientes también pueden estar sujetos a fuertes efectos de bioturbación estacional provenientes de peces anádromos. [46]
Los salmones funcionan como bioturbadores tanto en sedimentos del tamaño de grava como arena y en una escala de nutrientes, al mover y reelaborar los sedimentos en la construcción de redds (depresiones de grava o "nidos" que contienen huevos enterrados bajo una fina capa de sedimento) en ríos y arroyos. [46] y por movilización de nutrientes. [47] La construcción de redds de salmón funciona para aumentar la facilidad de movimiento del fluido ( conductividad hidráulica ) y la porosidad del lecho del arroyo. [47] En ríos seleccionados, si el salmón se congrega en concentraciones suficientemente grandes en un área determinada del río, el transporte total de sedimentos de la construcción de redes puede igualar o exceder el transporte de sedimentos de las inundaciones. [46] El efecto neto sobre el movimiento de sedimentos es la transferencia río abajo de grava, arena y materiales más finos y la mejora de la mezcla del agua dentro del sustrato del río. [46]
La construcción de redes de salmón aumenta los flujos de sedimentos y nutrientes a través de la zona hiporreica (área entre aguas superficiales y subterráneas) de los ríos y afecta la dispersión y retención de nutrientes de origen marino (MDN) dentro del ecosistema fluvial. [47] Los MDN llegan a los ecosistemas de ríos y arroyos a través de la materia fecal del salmón en desove y los cadáveres en descomposición de los salmones que completaron su desove y murieron. [47] El modelado numérico sugiere que el tiempo de residencia de MDN dentro de un área de desove del salmón es inversamente proporcional a la cantidad de construcción de redd dentro del río. [47] Las mediciones de la respiración dentro de un río salmonero en Alaska sugieren además que la bioturbación del salmón en el lecho del río juega un papel importante en la movilización de MDN y la limitación de la productividad primaria mientras el desove del salmón está activo. [44] Se descubrió que el ecosistema fluvial cambia de un sistema autótrofo neto a un sistema heterótrofo en respuesta a una disminución de la producción primaria y un aumento de la respiración. [44] La disminución de la producción primaria en este estudio se atribuyó a la pérdida de productores primarios bentónicos que fueron desalojados debido a la bioturbación, mientras que se pensó que el aumento de la respiración se debía al aumento de la respiración de carbono orgánico, también atribuido a la movilización de sedimentos de la construcción del salmón rojo. . [44] Si bien generalmente se cree que los nutrientes derivados del mar aumentan la productividad en los ecosistemas ribereños y de agua dulce, varios estudios han sugerido que se deben considerar los efectos temporales de la bioturbación al caracterizar las influencias del salmón en los ciclos de nutrientes. [44] [47]
Los principales bioturbadores marinos van desde pequeños invertebrados infaunales hasta peces y mamíferos marinos. [2] En la mayoría de los sedimentos marinos , sin embargo, están dominados por pequeños invertebrados, incluidos poliquetos , bivalvos , camarones excavadores y anfípodos .

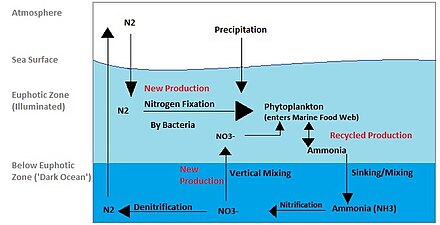
Los ecosistemas costeros , como los estuarios, son generalmente muy productivos, lo que se traduce en la acumulación de grandes cantidades de detritos (residuos orgánicos). Estas grandes cantidades, además del tamaño típicamente pequeño de los granos de sedimento y las densas poblaciones, hacen que los bioturbadores sean importantes en la respiración de los estuarios. [15] [48] Los bioturbadores mejoran el transporte de oxígeno a los sedimentos mediante el riego y aumentan la superficie de los sedimentos oxigenados mediante la construcción de madrigueras. [15] Los bioturbadores también transportan materia orgánica a mayor profundidad en los sedimentos a través de actividades generales de reelaboración y producción de materia fecal. [15] Esta capacidad de reponer oxígeno y otros solutos en la profundidad del sedimento permite una mejor respiración tanto de los bioturbadores como de la comunidad microbiana, alterando así el ciclo elemental del estuario. [49]
Los efectos de la bioturbación sobre el ciclo del nitrógeno están bien documentados. [50] La desnitrificación y la nitrificación acopladas se mejoran debido al aumento del suministro de oxígeno y nitrato a los sedimentos profundos y al aumento de la superficie a través de la cual se puede intercambiar oxígeno y nitrato. [50] El acoplamiento mejorado de nitrificación - desnitrificación contribuye a una mayor eliminación de nitrógeno biológicamente disponible en ambientes costeros y poco profundos, que puede mejorarse aún más mediante la excreción de amonio por los bioturbadores y otros organismos que residen en madrigueras de bioturbadores. [50] [51] Si bien tanto la nitrificación como la desnitrificación se ven mejoradas por la bioturbación, se ha descubierto que los efectos de los bioturbadores sobre las tasas de desnitrificación son mayores que los de las tasas de nitrificación, lo que promueve aún más la eliminación del nitrógeno biológicamente disponible. [52] Se ha sugerido que esta mayor eliminación de nitrógeno biológicamente disponible está relacionada con mayores tasas de fijación de nitrógeno en microambientes dentro de las madrigueras, como lo indica la evidencia de fijación de nitrógeno por bacterias reductoras de sulfato a través de la presencia de genes nif H ( nitrogenasa ). [53]
La bioturbación causada por la alimentación de las morsas es una fuente importante de sedimentos, estructura de comunidades biológicas y flujo de nutrientes en el Mar de Bering. [1] Las morsas se alimentan hundiendo sus hocicos en el sedimento y extrayendo almejas mediante una poderosa succión. [1] Al excavar a través del sedimento, las morsas liberan rápidamente grandes cantidades de material orgánico y nutrientes, especialmente amonio, del sedimento a la columna de agua. [1] Además, el comportamiento de alimentación de las morsas mezcla y oxigena el sedimento y crea hoyos en el sedimento que sirven como nuevas estructuras de hábitat para las larvas de invertebrados. [1]
La bioturbación es importante en las profundidades marinas porque el funcionamiento de los ecosistemas marinos depende del uso y reciclaje de nutrientes y aportes orgánicos de la zona fótica . [53] [54] En regiones de baja energía (áreas con agua relativamente tranquila), la bioturbación es la única fuerza que crea heterogeneidad en la concentración de solutos y la distribución de minerales en el sedimento. [55] Se ha sugerido que una mayor diversidad bentónica en las profundidades del mar podría conducir a una mayor bioturbación que, a su vez, aumentaría el transporte de materia orgánica y nutrientes a los sedimentos bentónicos. [53] A través del consumo de materia orgánica derivada de la superficie, los animales que viven en la superficie del sedimento facilitan la incorporación de partículas de carbono orgánico (POC) al sedimento, donde es consumido por los animales y las bacterias que habitan en el sedimento. [56] [57] La incorporación de POC en las redes alimentarias de los animales que viven en sedimentos promueve el secuestro de carbono al eliminarlo de la columna de agua y enterrarlo en el sedimento. [56] En algunos sedimentos de aguas profundas, la bioturbación intensa mejora el ciclo del manganeso y el nitrógeno. [55]
El papel de los bioturbadores en la biogeoquímica de sedimentos hace que la bioturbación sea un parámetro común en los modelos biogeoquímicos de sedimentos, que a menudo son modelos numéricos construidos utilizando ecuaciones diferenciales ordinarias y parciales . [58] La bioturbación normalmente se representa como D B , o coeficiente de biodifusión, y se describe mediante un término de difusión y, a veces, advectivo . [58] Esta representación y las variaciones posteriores dan cuenta de los diferentes modos de mezcla por grupos funcionales y la bioirrigación que resulta de ellos. El coeficiente de biodifusión generalmente se mide utilizando trazadores radiactivos como Pb 210 , [59] radioisótopos de la lluvia nuclear, [60] partículas introducidas que incluyen perlas de vidrio marcadas con radioisótopos o partículas fluorescentes inertes, [61] y clorofila a. [62] Los modelos de biodifusión luego se ajustan a distribuciones verticales (perfiles) de trazadores en sedimentos para proporcionar valores de D B . [63]
Sin embargo, la parametrización de la bioturbación puede variar, ya que se pueden utilizar modelos más nuevos y complejos para ajustar los perfiles de los trazadores. A diferencia del modelo de biodifusión estándar, estos modelos más complejos, como las versiones ampliadas del modelo de biodifusión, el paseo aleatorio y los modelos de seguimiento de partículas, pueden proporcionar más precisión, incorporar diferentes modos de transporte de sedimentos y dar cuenta de una mayor heterogeneidad espacial. [63] [64] [65] [66]
El inicio de la bioturbación tuvo un efecto profundo en el medio ambiente y la evolución de otros organismos. [2] Se cree que la bioturbación fue un cofactor importante de la Explosión Cámbrica , durante la cual la mayoría de los principales filos animales aparecieron en el registro fósil en un corto período de tiempo. [2] La depredación surgió durante esta época y promovió el desarrollo de esqueletos duros, por ejemplo cerdas, espinas y caparazones, como una forma de protección blindada . [2] Se plantea la hipótesis de que la bioturbación fue el resultado de la formación de este esqueleto. [2] Estas nuevas partes duras permitieron a los animales excavar en el sedimento para buscar refugio de los depredadores, lo que creó un incentivo para que los depredadores buscaran presas en el sedimento (ver Carrera armamentista evolutiva ). [2] Las especies excavadoras se alimentaban de materia orgánica enterrada en el sedimento, lo que dio lugar a la evolución de la alimentación en depósitos (consumo de materia orgánica dentro del sedimento). [2] Antes del desarrollo de la bioturbación, las esteras microbianas laminadas eran las estructuras biológicas dominantes del fondo del océano e impulsaban gran parte de las funciones del ecosistema . [2] A medida que aumentaba la bioturbación, los animales excavadores alteraron el sistema de estera microbiana y crearon una capa de sedimento mixto con mayor diversidad biológica y química. [2] Se cree que esta mayor diversidad biológica y química ha llevado a la evolución y diversificación de las especies que habitan en el fondo marino. [2] [7]
Existe una hipótesis alternativa, menos ampliamente aceptada, sobre el origen de la bioturbación. Se cree que el rastro fósil de Nenoxitas es el registro más antiguo de bioturbación, anterior al período Cámbrico. [67] El fósil data de 555 millones de años, lo que lo sitúa en el período Ediacárico. [67] El fósil indica una profundidad de bioturbación de 5 centímetros en sedimentos fangosos provocada por un gusano excavador. [67] Esto es consistente con el comportamiento de búsqueda de alimentos, ya que tendía a haber más recursos alimenticios en el lodo que en la columna de agua. [68] Sin embargo, esta hipótesis requiere una datación geológica más precisa para descartar un origen cámbrico temprano para este espécimen. [69]
La evolución de los árboles durante el período Devónico mejoró la erosión del suelo y aumentó la expansión del suelo debido a la bioturbación provocada por las raíces de los árboles. [70] La penetración y el desarraigo de las raíces también mejoraron el almacenamiento de carbono en el suelo al permitir la erosión mineral y el entierro de materia orgánica. [70]

En la roca litificada se conservan patrones o rastros de bioturbación . El estudio de tales patrones se llama icnología , o el estudio de "rastros fósiles", que, en el caso de los bioturbadores, son fósiles dejados por animales excavadores o excavadores. Esto se puede comparar con la huella que dejan estos animales. En algunos casos, la bioturbación es tan generalizada que destruye por completo las estructuras sedimentarias , como las capas laminadas o los estratos cruzados . Por tanto, afecta a las disciplinas de sedimentología y estratigrafía dentro de la geología. El estudio de las icnotelas bioturbadoras utiliza la profundidad de los fósiles, el corte transversal de los fósiles y la nitidez (o qué tan bien definido) del fósil [71] para evaluar la actividad que ocurrió en los sedimentos antiguos. Normalmente, cuanto más profundo sea el fósil, mejor conservado y mejor definido estará el espécimen. [71]
Se han encontrado importantes rastros de fósiles de bioturbación en sedimentos marinos de mareas, costeros y de aguas profundas. Además, los sedimentos de dunas de arena, o eólicos , son importantes para la preservación de una amplia variedad de fósiles. [72] Se han encontrado pruebas de bioturbación en núcleos de sedimentos de aguas profundas, incluso en registros prolongados, aunque el acto de extraer el núcleo puede alterar los signos de bioturbación, especialmente a profundidades menores. [73] Los artrópodos, en particular, son importantes para el registro geológico de la bioturbación de los sedimentos eólicos. Los registros de dunas muestran rastros de animales excavadores que se remontan al Mesozoico inferior (hace 250 millones de años), [72] aunque se ha observado bioturbación en otros sedimentos ya hace 550 Ma. [35] [36]
La importancia de la bioturbación para los procesos del suelo y la geomorfología fue descubierta por primera vez por Charles Darwin, quien dedicó su último libro científico al tema ( La formación de moho vegetal mediante la acción de los gusanos ). [2] Darwin esparció polvo de tiza sobre un campo para observar cambios en la profundidad de la capa de tiza a lo largo del tiempo. [2] Las excavaciones realizadas 30 años después del depósito inicial de tiza revelaron que la tiza estaba enterrada a 18 centímetros bajo el sedimento, lo que indicaba una tasa de enterramiento de 6 milímetros por año. [2] Darwin atribuyó este entierro a la actividad de las lombrices de tierra en el sedimento y determinó que estas alteraciones fueron importantes en la formación del suelo. [2] [3] En 1891, el geólogo Nathaniel Shaler amplió el concepto de Darwin para incluir la alteración del suelo por hormigas y árboles. [3] [4] El término "bioturbación" fue acuñado más tarde por Rudolf Richter en 1952 para describir las estructuras en los sedimentos causadas por organismos vivos. [5] Desde la década de 1980, el término "bioturbación" se ha utilizado ampliamente en la literatura sobre suelos y geomorfología para describir la reelaboración del suelo y los sedimentos por parte de plantas y animales. [6]
{{cite book}}: Mantenimiento CS1: otros ( enlace ){{cite book}}: Mantenimiento CS1: otros ( enlace ){{cite book}}: Mantenimiento CS1: otros ( enlace ){{cite book}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )