
La bioimpresión tridimensional ( 3D ) es el uso de técnicas similares a la impresión 3D para combinar células , factores de crecimiento , biotintas y biomateriales para fabricar estructuras funcionales que se usaban tradicionalmente para aplicaciones de ingeniería de tejidos , pero que en los últimos tiempos han aumentado el interés en otras aplicaciones como la biodetección y la remediación ambiental . [1] [2] [3] Generalmente, la bioimpresión 3D utiliza un método capa por capa para depositar materiales conocidos como biotintas para crear estructuras similares a tejidos que luego se usan en varios campos médicos y de ingeniería de tejidos. [4] [5] [6] La bioimpresión 3D cubre una amplia gama de técnicas de bioimpresión y biomateriales. Actualmente, la bioimpresión se puede utilizar para imprimir modelos de tejidos y órganos para ayudar a investigar medicamentos y posibles tratamientos. [7] No obstante, la traducción de construcciones celulares vivas bioimpresas a aplicaciones clínicas se enfrenta a varios problemas debido a la complejidad y la cantidad de células necesarias para crear órganos funcionales. [8] Sin embargo, las innovaciones abarcan desde la bioimpresión de la matriz extracelular hasta la mezcla de células con hidrogeles depositados capa por capa para producir el tejido deseado. [9] Además, la bioimpresión 3D ha comenzado a incorporar la impresión de andamios que se pueden utilizar para regenerar articulaciones y ligamentos. [10] Aparte de estos, la bioimpresión 3D se ha utilizado recientemente en aplicaciones de remediación ambiental, incluida la fabricación de biopelículas funcionales que albergan microorganismos funcionales que pueden facilitar la eliminación de contaminantes. [11]
La bioimpresión 3D generalmente sigue tres pasos: prebioimpresión, bioimpresión y posbioimpresión. [12] [13]
La prebioimpresión es el proceso de creación de un modelo que la impresora creará más tarde y la elección de los materiales que se utilizarán. Uno de los primeros pasos es obtener una biopsia del órgano para tomar muestras de células. Las tecnologías comunes que se utilizan para la bioimpresión son la tomografía computarizada (TC) y la resonancia magnética (RM). Para imprimir con un enfoque capa por capa, se realiza una reconstrucción tomográfica sobre las imágenes. Las imágenes ahora en 2D se envían a la impresora para su creación. Una vez creada la imagen, se aíslan y multiplican ciertas células. [12] Luego, estas células se mezclan con un material licuado especial que proporciona oxígeno y otros nutrientes para mantenerlas vivas. Esta agregación de células no requiere un andamio y es necesaria para colocarlas en la fusión de tejido de tipo tubular para procesos como la extrusión. [14] : 165
En el segundo paso, las mezclas líquidas de células, matriz y nutrientes conocidas como biotintas se colocan en un cartucho de impresora y se depositan utilizando las exploraciones médicas de los pacientes. [15] Cuando un pre-tejido bioimpreso se transfiere a una incubadora, este pre-tejido basado en células madura hasta convertirse en un tejido.
La bioimpresión 3D para fabricar construcciones biológicas generalmente implica la distribución de células sobre un andamio biocompatible utilizando un enfoque sucesivo de capa por capa para generar estructuras tridimensionales similares a los tejidos. [16] Se ha demostrado que los órganos artificiales como hígados y riñones fabricados mediante bioimpresión 3D carecen de elementos cruciales que afectan al cuerpo, como vasos sanguíneos funcionales, túbulos para recolectar orina y el crecimiento de miles de millones de células necesarias para estos órganos. Sin estos componentes, el cuerpo no tiene forma de obtener los nutrientes esenciales y el oxígeno de su interior. [16] Dado que cada tejido del cuerpo está compuesto naturalmente por diferentes tipos de células, muchas tecnologías para imprimir estas células varían en su capacidad para garantizar la estabilidad y viabilidad de las células durante el proceso de fabricación. Algunos de los métodos que se utilizan para la bioimpresión 3D de células son la fotolitografía , la bioimpresión 3D magnética , la estereolitografía y la extrusión celular directa. [14] : 196
El proceso de post-bioimpresión es necesario para crear una estructura estable a partir del material biológico. Si este proceso no se mantiene bien, la integridad mecánica y la función del objeto impreso en 3D están en riesgo. [12] Para mantener el objeto, se necesitan estimulaciones tanto mecánicas como químicas. Estas estimulaciones envían señales a las células para controlar la remodelación y el crecimiento de los tejidos. Además, en desarrollos recientes, las tecnologías de biorreactores [17] han permitido la rápida maduración de los tejidos, la vascularización de los tejidos y la capacidad de sobrevivir a los trasplantes. [13]
Los biorreactores funcionan proporcionando transporte de nutrientes por convección, creando entornos de microgravedad, modificando la presión para que la solución fluya a través de las células o añadiendo compresión para una carga dinámica o estática. Cada tipo de biorreactor es ideal para diferentes tipos de tejido; por ejemplo, los biorreactores de compresión son ideales para el tejido cartilaginoso. [14] : 198
Los investigadores en este campo han desarrollado enfoques para producir órganos vivos que se construyen con las propiedades biológicas y mecánicas adecuadas. La bioimpresión 3D se basa en tres enfoques principales: biomimetismo, autoensamblaje autónomo y bloques de construcción de mini-tejidos. [18]
El primer enfoque de la bioimpresión se denomina biomimética. El objetivo principal de este enfoque es crear estructuras fabricadas que sean idénticas a la estructura natural que se encuentra en los tejidos y órganos del cuerpo humano. La biomimética requiere la duplicación de la forma, la estructura y el microambiente de los órganos y tejidos. [19] La aplicación de la biomimética en la bioimpresión implica la creación de partes celulares y extracelulares idénticas de los órganos. Para que este enfoque tenga éxito, los tejidos deben replicarse a microescala. Por lo tanto, es necesario comprender el microambiente, la naturaleza de las fuerzas biológicas en este microambiente, la organización precisa de los tipos de células funcionales y de soporte, los factores de solubilidad y la composición de la matriz extracelular. [18]
El segundo enfoque de la bioimpresión es el autoensamblaje autónomo. Este enfoque se basa en el proceso físico del desarrollo de los órganos embrionarios como modelo para replicar los tejidos de interés. [19] Cuando las células están en su desarrollo temprano, crean su propio bloque de construcción de matriz extracelular, la señalización celular adecuada y una disposición y patrón independientes para proporcionar las funciones biológicas y la microarquitectura requeridas. [18] El autoensamblaje autónomo exige información específica sobre las técnicas de desarrollo de los tejidos y órganos del embrión. [19] Existe un modelo "sin andamiaje" que utiliza esferoides autoensamblables que se someten a fusión y disposición celular para parecerse a los tejidos en evolución. El autoensamblaje autónomo depende de la célula como el impulsor fundamental de la histogénesis, guiando los bloques de construcción, las propiedades estructurales y funcionales de estos tejidos. Exige una comprensión más profunda de cómo se desarrollan los mecanismos de los tejidos embrionarios, así como del microambiente que rodea para crear los tejidos bioimpresos. [18]
El tercer enfoque de la bioimpresión es una combinación de los enfoques de biomimetismo y autoensamblaje, denominados minitejidos. Los órganos y tejidos se construyen a partir de componentes funcionales muy pequeños. El enfoque de minitejidos toma estas pequeñas piezas y las organiza en una estructura más grande. [19] [18]

Al igual que las impresoras de tinta comunes, las bioimpresoras tienen tres componentes principales: el hardware utilizado, el tipo de biotinta y el material sobre el que se imprime (biomateriales). [12] La biotinta es un material hecho a partir de células vivas que se comporta de manera muy similar a un líquido, lo que permite que las personas lo "impriman" para crear la forma deseada. Para fabricar biotinta, los científicos crean una mezcla de células que se puede cargar en un cartucho e insertar en una impresora especialmente diseñada, junto con otro cartucho que contiene un gel conocido como biopapel. [20] En la bioimpresión, se han utilizado tres tipos principales de impresoras. Estas son las impresoras de inyección de tinta, asistidas por láser y de extrusión. Las impresoras de inyección de tinta se utilizan principalmente en la bioimpresión para productos rápidos y a gran escala. Un tipo de impresora de inyección de tinta, llamada impresora de inyección de tinta de gota a demanda, imprime materiales en cantidades exactas, minimizando el costo y el desperdicio. [21] Las impresoras que utilizan láser proporcionan una impresión de alta resolución; sin embargo, estas impresoras suelen ser caras. Las impresoras de extrusión imprimen células capa por capa, al igual que la impresión 3D para crear construcciones 3D. Además de solo células, las impresoras de extrusión también pueden utilizar hidrogeles infundidos con células. [12]
La impresión basada en extrusión es una técnica muy común dentro del campo de la impresión 3D que implica extruir o forzar un flujo continuo de material sólido fundido o líquido viscoso a través de una especie de orificio, a menudo una boquilla o jeringa. [22] Cuando se trata de bioimpresión basada en extrusión, existen cuatro tipos principales de extrusión. Estos son accionados neumáticamente, accionados por pistón, accionados por tornillo y accionados por tornillo excéntrico (también conocido como bomba de cavidad progresiva). Cada método de extrusión tiene sus propias ventajas y desventajas. La extrusión neumática utiliza aire presurizado para forzar la biotinta líquida a través de un agente de depósito. Los filtros de aire se utilizan comúnmente para esterilizar el aire antes de su uso, para garantizar que el aire que empuja la biotinta no esté contaminado. [23] La extrusión accionada por pistón utiliza un pistón conectado a un tornillo guía. El movimiento lineal del pistón exprime el material fuera de la boquilla. La extrusión accionada por tornillo utiliza un tornillo sinfín para extruir material utilizando un movimiento de rotación. [24] Los dispositivos accionados por tornillo permiten el uso de materiales de mayor viscosidad y proporcionan un mayor control volumétrico. [22] Los sistemas accionados por tornillo excéntrico permiten una deposición mucho más precisa de materiales de viscosidad baja a alta debido a las cámaras autosellantes en el extrusor. [25] Una vez impresos, muchos materiales requieren un paso de reticulación para lograr las propiedades mecánicas deseadas para la construcción, lo que se puede lograr, por ejemplo, con el tratamiento de agentes químicos o fotorreticulantes.
La extrusión directa es una de las técnicas de bioimpresión basadas en extrusión más comunes, en la que la fuerza presurizada dirige la biotinta para que fluya fuera de la boquilla e imprima directamente el andamio sin necesidad de fundición. [26] La biotinta en sí para este enfoque puede ser una mezcla de hidrogeles de polímero, materiales de origen natural como colágeno y células vivas suspendidas en la solución. [26] De esta manera, los andamios se pueden cultivar después de la impresión y sin la necesidad de un tratamiento adicional para la siembra celular. Algunos enfoques en el uso de técnicas de impresión directa se basan en el uso de conjuntos de boquillas coaxiales o extrusión coaxial. La configuración de la boquilla coaxial permite la extrusión simultánea de múltiples biotintas de material, capaces de hacer andamios multicapa en un solo paso de extrusión. [27] El desarrollo de estructuras tubulares ha encontrado que la extrusión en capas lograda a través de estas técnicas es deseable por la variabilidad radial en la caracterización del material que puede ofrecer, ya que la boquilla coaxial proporciona un tubo interno y externo para el flujo de biotinta. [27] Las técnicas de extrusión indirecta para bioimpresión requieren la impresión de un material base de hidrogeles cargados de células, pero a diferencia de la extrusión directa, contienen un hidrogel de sacrificio que se puede eliminar fácilmente después de la impresión mediante extracción térmica o química. [28] La resina restante se solidifica y se convierte en la construcción impresa en 3D deseada.
La bioimpresión basada en láser se puede dividir en dos clases principales: las basadas en tecnologías de transferencia celular o fotopolimerización . En la impresión láser por transferencia celular, un láser estimula la conexión entre el material que absorbe energía (por ejemplo, oro, titanio, etc.) y la biotinta. Esta "capa donante" se vaporiza bajo la irradiación del láser, formando una burbuja a partir de la capa de biotinta que se deposita desde un chorro. [29] Las técnicas de fotopolimerización utilizan reacciones fotoiniciadas para solidificar la tinta, moviendo la trayectoria del haz de un láser para inducir la formación de una construcción deseada. Ciertas frecuencias láser emparejadas con reacciones de fotopolimerización se pueden llevar a cabo sin dañar las células en el material.
En esta forma de impresión, los residuos plásticos se funden y se colocan en capas individuales en secciones para crear la forma deseada. El nailon y el PVA son ejemplos de biomateriales utilizados en este método. Esta técnica se utiliza con mayor frecuencia para diseñar prototipos para prótesis y construcción de cartílago. [30]
Otra forma de bioimpresión implica una impresora de inyección de tinta, que se utiliza principalmente en entornos biomédicos. Este método imprime proteínas y ácidos nucleicos detallados. [30] Los hidrogeles se seleccionan comúnmente como biotinta. Las células se pueden imprimir en un medio de superficie seleccionado para proliferar y, en última instancia, diferenciarse. Una desventaja de este método de impresión es la capacidad de las biotintas, como los hidrogeles, de obstruir la boquilla de impresión, debido a su alta viscosidad. [30] La bioimpresión de inyección de tinta ideal implica el uso de una viscosidad de polímero baja (idealmente por debajo de 10 centipoise), baja densidad celular (<10 millones de células/ml) y bajas alturas estructurales (<10 millones de células/ml). [31]
Existen otras técnicas de bioimpresión que se utilizan con menos frecuencia. La bioimpresión basada en gotas es una técnica en la que la mezcla de biotinta de células y/o hidrogeles se coloca en gotas en posiciones precisas. Las más comunes entre este enfoque son las técnicas térmicas y piezoeléctricas de gota a demanda. [32] Este método de bioimpresión se utiliza a menudo experimentalmente con modelos de cáncer de pulmón y ovario. [33] Las tecnologías térmicas utilizan señales de corta duración para calentar la biotinta, lo que induce la formación de pequeñas burbujas que se expulsan. La bioimpresión piezoeléctrica tiene una corriente de corta duración aplicada a un actuador piezoeléctrico , que induce una vibración mecánica capaz de expulsar un pequeño glóbulo de biotinta a través de la boquilla. Un aspecto significativo del estudio de los enfoques basados en gotas para la bioimpresión es tener en cuenta el estrés mecánico y térmico que experimentan las células dentro de la biotinta cerca de la punta de la boquilla a medida que se extruyen.
Las biotintas son componentes esenciales del proceso de bioimpresión. Están compuestas de células vivas y suplementos enzimáticos para nutrir un entorno que respalde las necesidades biológicas del tejido impreso. [34] El entorno creado por la biotinta permite que la célula se adhiera, crezca y se diferencie hasta su forma adulta. [34] Los hidrogeles encapsulantes de células se utilizan en métodos de bioimpresión basados en extrusión, mientras que la gelatina metacriloilgelatina metacrilona (GelMA) y las biotintas compuestas de células se utilizan con mayor frecuencia en técnicas de ingeniería de tejidos que requieren reticulación e integridad estructural precisa. [34] Es esencial que las biotintas ayuden a replicar el entorno de la matriz celular externa en la que se encontraría la célula de forma natural.
La bioimpresión 3D se puede utilizar para reconstruir tejido de varias regiones del cuerpo. El precursor de la adopción de la impresión 3D en la atención médica fue una serie de ensayos realizados por investigadores del Boston Children's Hospital. El equipo construyó vejigas urinarias de reemplazo a mano para siete pacientes construyendo andamios, luego colocando capas de células de los pacientes en los andamios y dejándolos crecer. Los ensayos fueron un éxito ya que los pacientes permanecieron en buen estado de salud 7 años después de la implantación, lo que llevó a un investigador llamado Anthony Atala, MD, a buscar formas de automatizar el proceso. [35] Los pacientes con enfermedad de vejiga en etapa terminal ahora pueden ser tratados mediante el uso de tejidos de vejiga bioingeniería para reconstruir el órgano dañado. [36] Esta tecnología también se puede aplicar potencialmente a los huesos, la piel, el cartílago y el tejido muscular. [37] Aunque un objetivo a largo plazo de la tecnología de bioimpresión 3D es reconstruir un órgano completo, así como minimizar el problema de la falta de órganos para trasplante. [38] Ha habido poco éxito en la bioimpresión de órganos completamente funcionales, por ejemplo, hígado, piel, menisco o páncreas. [39] [40] [41] A diferencia de los stents implantables, los órganos tienen formas complejas y son significativamente más difíciles de bioimprimir. Un corazón bioimpreso, por ejemplo, no solo debe cumplir con los requisitos estructurales, sino también con los requisitos de vascularización, carga mecánica y propagación de señales eléctricas. [42] En 2022, se informó del primer éxito de un ensayo clínico para un trasplante bioimpreso en 3D que se realiza a partir de las propias células del paciente, una oreja externa para tratar la microtia , [43] . [44]
La bioimpresión 3D contribuye a avances significativos en el campo médico de la ingeniería de tejidos al permitir la investigación sobre materiales innovadores llamados biomateriales . Algunas de las sustancias de bioingeniería más notables suelen ser más fuertes que los materiales corporales promedio, incluidos los tejidos blandos y los huesos. Estos componentes pueden actuar como futuros sustitutos, incluso mejoras, de los materiales corporales originales. Además, la Agencia de Reducción de Amenazas de Defensa tiene como objetivo imprimir miniórganos como corazones, hígados y pulmones como una posibilidad de probar nuevos medicamentos con mayor precisión y tal vez eliminar la necesidad de realizar pruebas en animales. [15]
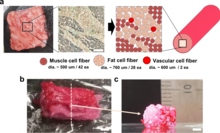
La bioimpresión también se puede utilizar para la carne cultivada . En 2021, se produjo una carne cultivada similar a un filete, compuesta por tres tipos de fibras de células bovinas. La carne de res similar a la de Wagyu tiene una estructura similar a la carne original. [45] [46] Esta tecnología proporciona una alternativa a los métodos naturales de recolección de carne si la industria ganadera se ve afectada por enfermedades. Además, proporciona una posible solución para reducir el impacto ambiental de la industria ganadera.
La biorremediación utiliza microorganismos o, en los últimos tiempos, materiales de origen biológico, como enzimas , biocompositos , biopolímeros o nanopartículas , para degradar bioquímicamente los contaminantes en sustancias inofensivas, lo que la convierte en una alternativa ecológica y rentable; la bioimpresión 3D facilita la fabricación de estructuras funcionales utilizando estos materiales que mejoran los procesos de biorremediación, lo que genera un interés significativo en la aplicación de construcciones bioimpresas en 3D para mejorar la biorremediación. [3]
La bioimpresión de biopelículas utiliza los mismos métodos que otras bioimpresiones. A menudo, la biopelícula comienza con una extrusión de un polisacárido para proporcionar la estructura para el crecimiento de la biopelícula. Un ejemplo de uno de estos polisacáridos es el alginato. La estructura de alginato puede tener microbios incrustados dentro de la estructura. [47] Los hidrogeles también se pueden utilizar para ayudar en la formación de biopelículas funcionales. [2] Las biopelículas son difíciles de analizar en un entorno de laboratorio debido a la estructura compleja y el tiempo que tarda en formarse una biopelícula funcional. La bioimpresión 3D de biopelículas nos permite omitir ciertos procesos y facilita el análisis de biopelículas funcionales. [47] El grosor de la biopelícula que se imprime cambiará la funcionalidad debido a la difusión de nutrientes y oxígeno. Las biopelículas impresas en 3D más gruesas seleccionarán naturalmente anaerobios, por ejemplo. [48]
Las biopelículas son capaces de remediarse en el entorno natural, lo que sugiere que existe potencial en lo que respecta al uso de biopelículas bioimpresas en 3D en la remediación ambiental . [49] Los microbios pueden degradar una amplia gama de productos químicos y metales y proporcionar una estructura para que estos microbios florezcan, como en las estructuras de biopelículas, es beneficioso. [50] Las biopelículas artificiales protegen a los microbios de los peligros del medio ambiente al tiempo que promueven la señalización y las interacciones microbianas generales. [51] La bioimpresión 3D permite colocar microorganismos funcionales en estructuras que brindan estabilidad mecánica y los protegen de las condiciones ambientales. [11] [3] El área de contacto más grande proporcionada por las estructuras impresas en 3D en comparación con las estructuras ambientales normales proporciona una eliminación más eficiente de los contaminantes. [11] [3 ]
La bioimpresión también tiene posibles usos en el futuro para ayudar en el tratamiento de aguas residuales y en el control de la corrosión. [47] Cuando los humanos entran en contacto con biopelículas ambientales, es posible que se produzcan infecciones y riesgos para la salud a largo plazo. [51] La penetración y expansión de antibióticos dentro de una biopelícula es un área de investigación que puede beneficiarse de las técnicas de bioimpresión, para explorar más a fondo el efecto de las biopelículas ambientales en la salud humana. [11] La impresión de biopelículas requiere más investigación debido a los datos publicados limitados y los protocolos complejos.