Sir Joseph John Thomson OM FRS [1] (18 de diciembre de 1856 - 30 de agosto de 1940) fue un físico británico y premio Nobel de Física , a quien se le atribuye el descubrimiento del electrón , la primera partícula subatómica encontrada.
En 1897, Thomson demostró que los rayos catódicos estaban compuestos de partículas con carga negativa desconocidas hasta entonces (ahora llamadas electrones), que calculó que debían tener cuerpos mucho más pequeños que los átomos y una relación carga-masa muy grande . [2] A Thomson también se le atribuye el hallazgo de la primera evidencia de isótopos de un elemento estable (no radiactivo) en 1913, como parte de su exploración de la composición de los rayos canal (iones positivos). Sus experimentos para determinar la naturaleza de las partículas con carga positiva, con Francis William Aston , fueron el primer uso de la espectrometría de masas y condujeron al desarrollo del espectrógrafo de masas. [2] [3]
Thomson recibió el Premio Nobel de Física en 1906 por su trabajo sobre la conducción de la electricidad en los gases. [4] Thomson también fue profesor, y siete de sus estudiantes ganaron premios Nobel: Ernest Rutherford (Química 1908), Lawrence Bragg (Física 1915), Charles Barkla (Física 1917), Francis Aston (Química 1922), Charles Thomson Rees Wilson (Física 1927), Owen Richardson (Física 1928) y Edward Victor Appleton (Física 1947). [5] Solo el historial de mentoría de Arnold Sommerfeld ofrece una lista comparable de estudiantes de alto rendimiento.
Joseph John Thomson nació el 18 de diciembre de 1856 en Cheetham Hill , Manchester , Lancashire , Inglaterra. Su madre, Emma Swindells, provenía de una familia textil local. Su padre, Joseph James Thomson, regentaba una librería de antigüedades fundada por el bisabuelo de Thomson. Tenía un hermano, Frederick Vernon Thomson, que era dos años menor que él. [6] JJ Thomson era un anglicano reservado pero devoto . [7] [8] [9]
Su primera educación se realizó en pequeñas escuelas privadas donde demostró un talento sobresaliente e interés por la ciencia. En 1870, fue admitido en el Owens College de Manchester (ahora Universidad de Manchester ) a la inusualmente temprana edad de 14 años y quedó bajo la influencia de Balfour Stewart , profesor de física, quien inició a Thomson en la investigación física. [10] Thomson comenzó a experimentar con la electrificación por contacto y pronto publicó su primer artículo científico. [11] Sus padres planearon inscribirlo como ingeniero aprendiz en Sharp, Stewart & Co , un fabricante de locomotoras, pero estos planes se vieron truncados cuando su padre murió en 1873. [6]
En 1876 se trasladó al Trinity College de Cambridge . En 1880 obtuvo su licenciatura en matemáticas ( segundo Wrangler en el Tripos [12] y segundo premio Smith ). [13] Solicitó y se convirtió en miembro del Trinity College en 1881. [14] Recibió su maestría en artes (con el premio Adams ) en 1883. [13]
En 1890, Thomson se casó con Rose Elisabeth Paget en la iglesia de Santa María la Menor . Rose, que era hija de Sir George Edward Paget , médico y entonces profesor regio de Física en Cambridge , estaba interesada en la física. A partir de 1882, las mujeres podían asistir a demostraciones y conferencias en la Universidad de Cambridge. Rose asistió a demostraciones y conferencias, entre ellas las de Thomson, lo que condujo a su relación. [15]
Tuvieron dos hijos: George Paget Thomson , quien también recibió el Premio Nobel por su trabajo sobre las propiedades ondulatorias del electrón, y Joan Paget Thomson (más tarde Charnock), [16] quien se convirtió en autora, escribiendo libros para niños, no ficción y biografías. [17]
El 22 de diciembre de 1884, Thomson fue nombrado profesor de Física de la Universidad de Cambridge . [2] El nombramiento causó una considerable sorpresa, dado que candidatos como Osborne Reynolds o Richard Glazebrook eran mayores y tenían más experiencia en el trabajo de laboratorio. Thomson era conocido por su trabajo como matemático, donde fue reconocido como un talento excepcional. [18]
En 1906 recibió el Premio Nobel, «en reconocimiento a los grandes méritos de sus investigaciones teóricas y experimentales sobre la conducción de la electricidad por los gases». Fue nombrado caballero en 1908 y designado miembro de la Orden del Mérito en 1912. En 1914, dio la Conferencia Romanes en Oxford sobre «La teoría atómica». En 1918, se convirtió en rector del Trinity College de Cambridge , donde permaneció hasta su muerte. Murió el 30 de agosto de 1940; sus cenizas reposan en la Abadía de Westminster , [19] cerca de las tumbas de Sir Isaac Newton y su antiguo alumno Ernest Rutherford . [20]
Rutherford lo sucedió como profesor de Física de la cátedra Cavendish . Seis de los asistentes de investigación y colegas jóvenes de Thomson ( Charles Glover Barkla , [21] Niels Bohr , [22] Max Born , [23] William Henry Bragg , Owen Willans Richardson [24] y Charles Thomson Rees Wilson [1] ) ganaron premios Nobel de Física, y dos ( Francis William Aston [25] y Ernest Rutherford [26] ) ganaron premios Nobel de Química. El hijo de Thomson ( George Paget Thomson ) también ganó el Premio Nobel de Física de 1937 por demostrar las propiedades ondulatorias de los electrones. [27]
La obra maestra de Thomson, premiada, Tratado sobre el movimiento de los anillos de vórtice , muestra su temprano interés en la estructura atómica. [4] En ella, Thomson describió matemáticamente los movimientos de la teoría de vórtices de los átomos de William Thomson . [18]
Thomson publicó una serie de artículos que abordaban cuestiones tanto matemáticas como experimentales del electromagnetismo. Examinó la teoría electromagnética de la luz de James Clerk Maxwell , introdujo el concepto de masa electromagnética de una partícula cargada y demostró que un cuerpo cargado en movimiento aparentemente aumentaría su masa. [18]
Gran parte de su trabajo en el modelado matemático de procesos químicos puede considerarse como química computacional temprana . [2] En un trabajo posterior, publicado en forma de libro como Aplicaciones de la dinámica a la física y la química (1888), Thomson abordó la transformación de la energía en términos matemáticos y teóricos, sugiriendo que toda la energía podría ser cinética. [18] Su siguiente libro, Notas sobre investigaciones recientes en electricidad y magnetismo (1893), se basó en el Tratado sobre electricidad y magnetismo de Maxwell , y a veces se lo conoce como "el tercer volumen de Maxwell". [4] En él, Thomson enfatizó los métodos físicos y la experimentación e incluyó extensas figuras y diagramas de aparatos, incluido un número para el paso de electricidad a través de gases. [18] Su tercer libro, Elementos de la teoría matemática de la electricidad y el magnetismo (1895) [28] fue una introducción legible a una amplia variedad de temas y alcanzó una considerable popularidad como libro de texto. [18]

Una serie de cuatro conferencias, impartidas por Thomson durante una visita a la Universidad de Princeton en 1896, se publicaron posteriormente con el título Descarga de electricidad a través de gases (1897). Thomson también presentó una serie de seis conferencias en la Universidad de Yale en 1904. [4]
Varios científicos, como William Prout y Norman Lockyer , habían sugerido que los átomos se formaban a partir de una unidad más fundamental, pero imaginaron que esta unidad sería del tamaño del átomo más pequeño, el hidrógeno. Thomson en 1897 fue el primero en sugerir que una de las unidades fundamentales del átomo era más de 1.000 veces más pequeña que un átomo, lo que sugiere la partícula subatómica ahora conocida como electrón. Thomson descubrió esto a través de sus exploraciones sobre las propiedades de los rayos catódicos. Thomson hizo su sugerencia el 30 de abril de 1897 después de su descubrimiento de que los rayos catódicos (en ese momento conocidos como rayos Lenard ) podían viajar mucho más lejos a través del aire de lo esperado para una partícula del tamaño de un átomo. [29] Estimó la masa de los rayos catódicos midiendo el calor generado cuando los rayos golpean una unión térmica y comparándolo con la desviación magnética de los rayos. Sus experimentos sugirieron no sólo que los rayos catódicos eran más de 1.000 veces más ligeros que el átomo de hidrógeno, sino también que su masa era la misma independientemente del tipo de átomo del que procedieran. Concluyó que los rayos estaban compuestos de partículas muy ligeras, cargadas negativamente, que eran un bloque de construcción universal de los átomos. Llamó a las partículas "corpúsculos", pero los científicos posteriores prefirieron el nombre de electrón, que había sido sugerido por George Johnstone Stoney en 1891, antes del descubrimiento real de Thomson. [30]
En abril de 1897, Thomson sólo tenía indicios tempranos de que los rayos catódicos podían ser desviados eléctricamente (investigadores anteriores como Heinrich Hertz habían pensado que no era posible). Un mes después del anuncio de Thomson del corpúsculo, descubrió que podía desviar de manera fiable los rayos mediante un campo eléctrico si evacuaba el tubo de descarga a una presión muy baja. Al comparar la desviación de un haz de rayos catódicos mediante campos eléctricos y magnéticos, obtuvo mediciones más sólidas de la relación masa-carga que confirmaron sus estimaciones anteriores. [31] Este se convirtió en el método clásico para medir la relación carga-masa del electrón. (La carga en sí no se midió hasta el experimento de la gota de aceite de Robert A. Millikan en 1909).
Thomson creía que los corpúsculos surgían de los átomos del gas traza dentro de sus tubos de rayos catódicos . Por lo tanto, concluyó que los átomos eran divisibles y que los corpúsculos eran sus bloques de construcción. En 1904, Thomson sugirió un modelo del átomo, planteando la hipótesis de que era una esfera de materia positiva dentro de la cual las fuerzas electrostáticas determinaban la posición de los corpúsculos. [2] Para explicar la carga neutra general del átomo, propuso que los corpúsculos estaban distribuidos en un mar uniforme de carga positiva. En este " modelo de pudín de pasas ", los electrones se veían como incrustados en la carga positiva como pasas en un pudín de pasas (aunque en el modelo de Thomson no estaban estacionarios, sino que orbitaban rápidamente). [32] [33]
Thomson hizo el descubrimiento casi al mismo tiempo que Walter Kaufmann y Emil Wiechert descubrieron la relación correcta entre masa y carga de estos rayos catódicos (electrones). [34]
El nombre "electrón" fue adoptado para estas partículas por la comunidad científica, principalmente debido a la defensa de GF FitzGerald , J. Larmor y HA Lorentz . [35] : 273 El término fue acuñado originalmente por George Johnstone Stoney en 1891 como un nombre tentativo para la unidad básica de carga eléctrica (que aún no se había descubierto). [36] [37] Durante algunos años, Thomson se resistió a usar la palabra "electrón" porque no le gustaba cómo algunos físicos hablaban de un "electrón positivo" que se suponía que era la unidad elemental de carga positiva al igual que el "electrón negativo" es la unidad elemental de carga negativa. Thomson prefirió quedarse con la palabra "corpúsculo", que definió estrictamente como cargado negativamente. [38] Cedió en 1914, utilizando la palabra "electrón" en su libro The Atomic Theory . [39] En 1920, Rutherford y sus colegas acordaron llamar al núcleo del ion hidrógeno "protón", estableciendo un nombre distinto para la partícula de materia con carga positiva más pequeña conocida (que de todos modos puede existir independientemente). [40]

En 1912, como parte de su exploración de la composición de las corrientes de partículas con carga positiva entonces conocidas como rayos canal , Thomson y su asistente de investigación FW Aston canalizaron una corriente de iones de neón a través de un campo magnético y eléctrico y midieron su desviación colocando una placa fotográfica en su camino. [6] Observaron dos manchas de luz en la placa fotográfica (ver imagen a la derecha), lo que sugirió dos parábolas de desviación diferentes, y concluyeron que el neón está compuesto de átomos de dos masas atómicas diferentes (neón-20 y neón-22), es decir, de dos isótopos . [41] [42] Esta fue la primera evidencia de isótopos de un elemento estable; Frederick Soddy había propuesto previamente la existencia de isótopos para explicar la desintegración de ciertos elementos radiactivos .
La separación de isótopos de neón por su masa de Thomson fue el primer ejemplo de espectrometría de masas , que posteriormente fue mejorada y desarrollada hasta convertirse en un método general por F. W. Aston y A. J. Dempster . [2] [3]
Anteriormente, los físicos debatieron si los rayos catódicos eran inmateriales como la luz ("algún proceso en el éter ") o eran "de hecho completamente materiales, y... marcan los caminos de partículas de materia cargadas con electricidad negativa", citando a Thomson. [31] La hipótesis etérea era vaga, [31] pero la hipótesis de la partícula era lo suficientemente definida para que Thomson la probara.
Thomson investigó por primera vez la desviación magnética de los rayos catódicos. Los rayos catódicos se producían en el tubo lateral de la izquierda del aparato y pasaban a través del ánodo hacia la campana principal , donde eran desviados por un imán. Thomson detectó su trayectoria mediante la fluorescencia en una pantalla cuadrada en la campana. Descubrió que, independientemente del material del ánodo y del gas en la campana, la desviación de los rayos era la misma, lo que sugería que los rayos tenían la misma forma independientemente de su origen. [43]
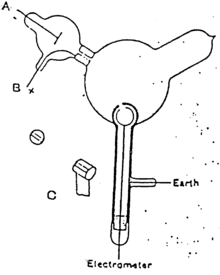
Aunque los partidarios de la teoría etérea aceptaron la posibilidad de que se produjeran partículas con carga negativa en los tubos de Crookes , [ cita requerida ] creían que eran un mero subproducto y que los rayos catódicos en sí mismos eran inmateriales. [ cita requerida ] Thomson se propuso investigar si realmente podía separar la carga de los rayos.
Thomson construyó un tubo de Crookes con un electrómetro colocado a un lado, fuera de la trayectoria directa de los rayos catódicos. Thomson pudo rastrear la trayectoria del rayo observando la mancha fosforescente que creaba donde golpeaba la superficie del tubo. Thomson observó que el electrómetro registraba una carga solo cuando desviaba el rayo catódico hacia él con un imán. Concluyó que la carga negativa y los rayos eran una misma cosa. [29]

En mayo-junio de 1897, Thomson investigó si los rayos podían ser desviados por un campo eléctrico. [6] Los experimentadores anteriores no habían podido observar esto, pero Thomson creía que sus experimentos eran defectuosos porque sus tubos contenían demasiado gas.
Thomson construyó un tubo de Crookes con un vacío mejor. Al principio del tubo estaba el cátodo desde el que se proyectaban los rayos. Los rayos se afilaban hasta formar un haz mediante dos rendijas de metal: la primera de estas rendijas hacía las veces de ánodo y la segunda estaba conectada a tierra. El haz pasaba entonces entre dos placas de aluminio paralelas, que producían un campo eléctrico entre ellas cuando se conectaban a una batería. El extremo del tubo era una gran esfera donde el haz impactaba contra el vidrio, creando una mancha brillante. Thomson pegó una escala a la superficie de esta esfera para medir la desviación del haz. Cualquier haz de electrones colisionaría con algunos átomos de gas residuales dentro del tubo de Crookes, ionizándolos y produciendo electrones e iones en el tubo ( carga espacial ); en experimentos anteriores, esta carga espacial apantallaba eléctricamente el campo eléctrico aplicado externamente. Sin embargo, en el tubo de Crookes de Thomson la densidad de átomos residuales era tan baja que la carga espacial de los electrones e iones era insuficiente para apantallar eléctricamente el campo eléctrico aplicado externamente, lo que permitió a Thomson observar con éxito la desviación eléctrica.
Cuando la placa superior se conectó al polo negativo de la batería y la placa inferior al polo positivo, el parche brillante se movió hacia abajo, y cuando se invirtió la polaridad, el parche se movió hacia arriba.
En su experimento clásico, Thomson midió la relación masa-carga de los rayos catódicos midiendo cuánto eran desviados por un campo magnético y comparándolo con la desviación eléctrica. Utilizó el mismo aparato que en su experimento anterior, pero colocó el tubo de descarga entre los polos de un gran electroimán. Descubrió que la relación masa-carga era más de mil veces menor que la de un ion de hidrógeno (H + ), lo que sugería que las partículas eran muy ligeras y/o estaban muy cargadas. [31] Significativamente, los rayos de cada cátodo arrojaron la misma relación masa-carga. Esto contrasta con los rayos anódicos (que ahora se sabe que surgen de iones positivos emitidos por el ánodo), donde la relación masa-carga varía de ánodo a ánodo. El propio Thomson siguió siendo crítico con lo que estableció su trabajo, y en su discurso de aceptación del Premio Nobel se refirió a "corpúsculos" en lugar de "electrones".
Los cálculos de Thomson se pueden resumir de la siguiente manera (en su notación original, utilizando F en lugar de E para el campo eléctrico y H en lugar de B para el campo magnético):
La desviación eléctrica se expresa mediante , donde Θ es la desviación eléctrica angular, F es la intensidad eléctrica aplicada, e es la carga de las partículas de rayos catódicos, l es la longitud de las placas eléctricas, m es la masa de las partículas de rayos catódicos y v es la velocidad de las partículas de rayos catódicos. La desviación magnética se expresa mediante , donde φ es la desviación magnética angular y H es la intensidad del campo magnético aplicado.
Se varió el campo magnético hasta que las desviaciones magnética y eléctrica fueron las mismas, momento en el que . Esto se puede simplificar para dar . La deflexión eléctrica se midió por separado para dar Θ y se conocieron H, F y l, por lo que se pudo calcular m/e.
Como los rayos catódicos llevan una carga de electricidad negativa, son desviados por una fuerza electrostática como si estuvieran electrificados negativamente y están sometidos a la acción de una fuerza magnética exactamente en la misma forma en que esta fuerza actuaría sobre un cuerpo electrificado negativamente que se mueva a lo largo del camino de estos rayos, no veo escapatoria a la conclusión de que son cargas de electricidad negativa transportadas por partículas de materia.
—J.J. Thomson [31]
En cuanto a la fuente de estas partículas, Thomson creía que surgían de las moléculas de gas en las proximidades del cátodo.
Si, en el campo eléctrico muy intenso en las proximidades del cátodo, las moléculas del gas se disocian y se dividen, no en los átomos químicos ordinarios, sino en estos átomos primordiales, que para abreviar llamaremos corpúsculos; y si estos corpúsculos están cargados de electricidad y proyectados desde el cátodo por el campo eléctrico, se comportarían exactamente como los rayos catódicos.
—J.J. Thomson [44]
Thomson imaginó que el átomo estaba formado por estos corpúsculos que orbitaban en un mar de carga positiva; éste fue su modelo de pudín de pasas . Este modelo se demostró más tarde incorrecto cuando su alumno Ernest Rutherford demostró que la carga positiva está concentrada en el núcleo del átomo.
En 1905, Thomson descubrió la radiactividad natural del potasio . [45]
En 1906, Thomson demostró que el hidrógeno tenía un solo electrón por átomo. Las teorías anteriores admitían distintas cantidades de electrones. [46] [47]



Thomson fue elegido miembro de la Royal Society (FRS) [1] [48] y designado para la Cátedra Cavendish de Física Experimental en el Laboratorio Cavendish de la Universidad de Cambridge en 1884. [2] Thomson ganó numerosos premios y honores durante su carrera, entre ellos:
Thomson fue elegido miembro de la Royal Society [1] el 12 de junio de 1884 y sirvió como presidente de la Royal Society entre 1915 y 1920.
Thomson fue elegido Miembro Honorario Internacional de la Academia Estadounidense de las Artes y las Ciencias en 1902, y Miembro Internacional de la Sociedad Filosófica Estadounidense en 1903, y de la Academia Nacional de Ciencias de los Estados Unidos en 1903. [49] [50] [51]
En noviembre de 1927, Thomson inauguró el edificio Thomson, llamado así en su honor, en la Leys School de Cambridge. [52]
En 1991, se propuso el Thomson (símbolo: Th) como unidad para medir la relación masa-carga en espectrometría de masas en su honor. [53]
La avenida JJ Thomson, en el sitio West Cambridge de la Universidad de Cambridge , lleva el nombre de Thomson. [54]
El premio Medalla Thomson , patrocinado por la Fundación Internacional de Espectrometría de Masas , lleva el nombre de Thomson. [55]
La Medalla y Premio Joseph Thomson del Instituto de Física lleva el nombre de Thomson. [56]
Thomson Crescent en Deep River, Ontario, se conecta con Rutherford Ave.
Entre sus alumnos ganadores del Premio Nobel se encuentran Rutherford, Aston, Wilson, Bragg, Barkla, Richardson y Appleton.
Trabajó con JJ Thomson en el Laboratorio Cavendish en Cambridge.
realizó una estancia en Cambridge, donde aprovechó para seguir el trabajo experimental que se estaba llevando a cabo en el Laboratorio Cavendish bajo la guía de Sir JJ Thomson
Born fue a Cambridge por un corto tiempo, para estudiar con Larmor y JJ Thomson.
Richardson, graduado (1900) del Trinity College, Cambridge, y alumno de JJ Thomson en el Laboratorio Cavendish.
A finales de 1909 aceptó la invitación de Sir JJ Thomson para trabajar como su asistente en el Laboratorio Cavendish
como estudiante de investigación en el Laboratorio Cavendish bajo la dirección de JJ Thomson.
realizó experimentos sobre el comportamiento de los electrones... que demostraron que los electrones se comportan como ondas...
Según la hipótesis de JJ Thomson, los átomos están formados por sistemas de anillos giratorios de electrones.
Marcus Chown dice que la verdad no es exactamente como sugieren los libros de historia.
El premio Medalla Thomson lleva el nombre de Sir JJ Thomson, quien fue responsable del primer espectrógrafo de masas.


