La epoxidación de Juliá-Colonna es una epoxidación nucleofílica asimétrica catalizada por polileucina de olefinas deficientes en electrones en un sistema trifásico . La reacción fue descrita por Sebastian Juliá en el Instituto Químico de Sarriá en 1980, [1] con mayor elaboración por Juliá y Stefano Colonna (Istituto di Chimica Industriale dell'Università, Milán, Italia). [2]

En el protocolo trifásico original, el sustrato de chalcona es soluble en la fase orgánica, generalmente tolueno o tetracloruro de carbono . El oxidante alcalino de peróxido de hidrógeno es soluble principalmente en la fase acuosa y la reacción ocurre en la capa de polímero insoluble en la interfaz de las dos fases. Se han desarrollado protocolos bifásicos y monofásicos alternativos con mayor accesibilidad del sustrato y velocidad de reacción. [3] [4]
La epoxidación catalítica enantioselectiva eficiente en condiciones suaves es de gran utilidad sintética. Los epóxidos no sólo son sintones eficaces para una variedad de transformaciones, sino que tienen una presencia significativa en las estructuras de los productos naturales. Además, la reacción se ha ampliado de manera efectiva a niveles de utilidad industrial, con trabajos realizados en particular por Bayer y Evonik . Finalmente, la actividad similar a la enzima de los segmentos de poliaminoácidos sugiere un papel de la reacción en el origen prebiótico de la vida . [5] [6]
La epoxidación de Juliá-Colonna es una epoxidación nucleofílica asimétrica de olefinas deficientes en electrones, como las cetonas α,β-insaturadas . El mecanismo general que se muestra en la Figura 2 se aplica a todas las epoxidaciones nucleofílicas, pero en esta reacción está controlado por el catalizador de polileucina.

El anión hidroperóxido y la chalcona se unen en un complejo con el catalizador de polileucina antes de reaccionar para formar un intermedio de enolato de peróxido. El intermedio se cierra posteriormente, según lo controla la estructura del catalizador, para formar el producto epóxido de forma estereoselectiva.
Las cadenas de polileucina muestran una cinética similar a la de las enzimas con una dependencia de primer orden y una saturación final con el anión hidroperóxido (K M = 30 mM) y el sustrato de olefina (K M = 110 mM). El estudio cinético sugiere que la reacción se produce mediante la formación aleatoria en estado estable de un complejo ternario (polileucina + anión hidroperóxido + olefina) . Ambos sustratos deben unirse antes de la reacción y, si bien cualquiera de ellos puede unirse primero, la unión inicial del hidroperóxido es cinéticamente preferida. El rápido equilibrio que permite la formación del complejo es seguido por la formación limitante de la velocidad del enolato de peróxido (Figura 3). [5] [8]
Todos los reactivos se asocian con el catalizador de polileucina antes de la reacción para formar el intermedio de enolato de hidroperóxido. El catalizador orienta los reactivos y, aún más significativamente, el intermedio de enolato de peróxido mediante una serie de interacciones de enlaces de hidrógeno con los cuatro grupos amino N-terminales en la α-hélice de polileucina . Si bien se han propuesto otros modelos, [9] los cálculos de Kelly et al. han sugerido que el NH-2, NH-3 y NH-4 forman un triángulo isósceles disponible para enlaces de hidrógeno como un agujero de oxianión estabilizador intermedio . Si bien la unión de olefina a la cara endo o exo de la hélice está permitida estéricamente, solo la unión endo orienta al grupo NH-4 para unirse con la fracción de hidroperóxido, lo que permite el desplazamiento del hidróxido en el paso de reacción final (Figura 4). [7]
La enantioselectividad se maximiza mediante secuencias de poliaminoácidos que contienen el mayor contenido de hélice α; estas incluyen poli- leucina y poli- alanina . [1] Tanto los poli-L- como los poli-D-aminoácidos están disponibles y causan la estereoinducción opuesta. [10]

Los catalizadores originales de poli-leucina se formaron mediante la reacción de N-carboxianhídridos de leucina con un iniciador como una amina, un alcohol o agua (Figura 5). [2] En sistemas trifásicos, el catalizador de polímero debe empaparse en el disolvente orgánico y la solución de peróxido para generar un gel antes de la reacción. [11] – Especialmente en sistemas bifásicos, el tiempo de reacción se puede reducir y la enantioselectividad aumentar activando el catalizador con NaOH antes de la reacción. Además, en sistemas bifásicos, el polímero se puede inmovilizar en poliestireno , polietilenglicol (PEG) o gel de sílice y formar una pasta. [4]
El componente activo del catalizador asume una estructura α-helicoidal donde los cuatro a cinco residuos N-terminales participan activamente en la catálisis. Si bien se han generado catalizadores activos a partir de leucina escalémica, se debe mantener un contenido enantiomérico constante a través de la región N-terminal para dar una lateralidad adecuada a la estructura. [10] Si bien la mayor enantioselectividad se observó originalmente cuando n = 30 residuos, [2] un polipéptido de leucina de 10 meros tiene una longitud suficiente para proporcionar una enantioselectividad significativa [10] Después de la mejora del procedimiento original, se ha observado una mayor enantioselectividad para polímeros de menor peso molecular, presumiblemente debido a la mayor cantidad de extremos N disponibles por masa utilizada. [4]
La epoxidación de Juliá-Colonna de olefinas deficientes en electrones se demostró originalmente con chalconas, pero pronto se extendió a otros sistemas con fracciones que atraen electrones, como cetonas α,β-insaturadas, ésteres y amidas. [1] [2] La reacción también ha demostrado eficiencia con sustratos de sulfona , y el alcance de la reacción se está ampliando con más investigaciones metodológicas. [12]
Sin embargo, existen varias clases de sustratos que no son adecuados para la epoxidación de Juliá-Colonna, entre ellos: [10]
La epoxidación nucleofílica es naturalmente complementaria en alcance a las epoxidaciones electrófilas como la epoxidación de Sharpless y la epoxidación de Jacobsen .
La estereoinducción de la epoxidación de Juliá-Colonna depende de la estructura secundaria α-helicoidal del catalizador de polileucina. Si bien la estereoquímica consistente de los aminoácidos N-terminales es necesaria para esta inducción, incluso un polipéptido de leucina de 10 meros tiene una longitud suficiente para proporcionar una enantioselectividad significativa. [10]
Esta dependencia únicamente de la región N-terminal de la hélice es más pronunciada en la estereoinducción enantioselectiva por catalizadores escalémicos. Incluso un exceso enantiomérico del 40% de L frente a D-leucina en la formación del catalizador puede producir el mismo epóxido enantiomérico enriquecido que el catalizador enantiopuro. La relación entre el catalizador y la enantiopureza del producto se puede aproximar estrechamente con un modelo estadístico bernoulliano : ee n = (L n -D n )/(L n +D n ) donde L y D son las proporciones de L- y D-leucina utilizadas para generar los polímeros catalíticos y n es la longitud del componente catalítico. [5] [6]
Se han generado aminoácidos quirales, incluida la leucina, en experimentos de descarga eléctrica diseñados para imitar las condiciones prebióticas de la Tierra, y se han encontrado en mezclas escalémicas en meteoritos. Se ha sugerido que fragmentos de poliaminoácidos análogos al catalizador de Juliá-Colonna pueden haber sido iniciados por derivados de imidazol o cianuro , y los fragmentos resultantes pueden haber desempeñado un papel catalítico en el origen del enriquecimiento enantiomérico omnipresente en la vida actual. [5]
Se ha demostrado que la polileucina injertada con sílice cataliza eficazmente la epoxidación de cetonas aromáticas α,β-insaturadas. El injerto de sílice permite recuperar fácilmente el catalizador con solo una leve pérdida de actividad y es particularmente útil para reacciones de aumento de escala. [13]
En el protocolo bifásico alternativo, el sustrato de olefina se disuelve en tetrahidrofurano (THF) junto con el oxidante peróxido de hidrógeno de urea (UHP) y una base de amina terciaria como 8-diazabiciclo[5.4.0]undec-7-eno (DBU). El catalizador de polímero inmovilizado forma una pasta que sirve como sitio de reacción. Las condiciones de reacción de dos fases ampliaron el rango de enonas a las que se podía aplicar la reacción. [3]
Se utilizó un iniciador soluble O,O'-bis(2-aminoetil)polietilenglicol (diaminoPEG) para el ensamblaje de polileucina para generar un polímero tribloque soluble en THF . La utilización de este catalizador en condiciones de reacción homogéneas permitió una marcada extensión de la metodología a cetonas α,β-insaturadas , dienos y bis -dienos. [4]
La adición de bromuro de tetrabutilamonio como catalizador de transferencia de fase aumenta drásticamente la velocidad de reacción. Se supone que el cocatalizador aumenta la concentración del oxidante peróxido en la fase orgánica, lo que permite un acceso más eficiente al complejo ternario reactivo. [14] Estas condiciones se desarrollaron para su aplicación en sistemas de dos fases, pero también funcionan en sistemas de tres fases y se han utilizado hasta la escala de 100 g [5] [12]
Los catalizadores inmovilizados se han utilizado en reactores de membrana y se están investigando para su aplicación en reactores de lecho fijo de flujo continuo. [11]
Adger et al. utilizaron la epoxidación bifásica de Juliá-Colonna con poli-L-leucina inmovilizada (I-PLL) y peróxido de hidrógeno de urea (UHP), y 8-diazabiciclo[5.4.0]undec-7-eno (DBU) como paso clave en la síntesis eficiente de diltiazem (Figura 6). El diltiazem es un fármaco disponible comercialmente que actúa como bloqueador de los canales de calcio . [11]

Cappi et al. utilizaron la epoxidación de Juliá-Colonna con poli-L-leucina inmovilizada con PEG (PEG-PLL) y peróxido de hidrógeno DABCO (DABCO-H 2 O 2 ) o peróxido de hidrógeno de urea (UHP) en un sistema de reactor de flujo continuo de lecho fijo en miniatura (Figura 7). Este protocolo se aprovechó para sintetizar (+)-clausenamida como prueba de concepto en el desarrollo del nuevo protocolo de reacción; (+)-clausenamida exhibe actividad antiamnésica y hepatoprotectora. [15]
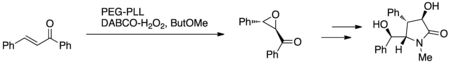
Chen et al. utilizaron el protocolo de epoxidación bifásica de Juliá-Colonna con peróxido de hidrógeno de urea (UHP), poli-L-leucina (PLL) y 8-diazabiciclo[5.4.0]undec-7-eno (DBU) como un paso clave en la síntesis de una familia de lactonas de estiril aisladas de Goniothalamus giganteus (Figura 8). Estos compuestos, incluidos el (+)-goniotriol 7, el (+)-goniofufurona 8, el (+)-8-acetilgoniotriol 9 y la gonio-pipirona, han demostrado actividad citotóxica contra células tumorales humanas. [16]
