El principio de Sabatier es un concepto cualitativo en catálisis química heterogénea que lleva el nombre del químico francés Paul Sabatier . Afirma que las interacciones entre el catalizador y los reactivos deben ser "perfectas"; es decir, ni demasiado fuerte ni demasiado débil. Si la interacción es demasiado débil, la molécula no podrá unirse al catalizador y no se producirá ninguna reacción. Por otro lado, si la interacción es demasiado fuerte, el producto no logra disociarse. [1]
El principio se puede mostrar gráficamente trazando la velocidad de reacción frente a una propiedad como el calor de adsorción del reactivo por el catalizador. Estas gráficas pasan por un máximo, pareciéndose aproximadamente a un triángulo o una parábola invertida, y se denominan gráficas de volcán debido a su forma. [1] También se pueden construir gráficos tridimensionales análogos en función de dos propiedades diferentes, como los calores de adsorción de los dos reactivos para una reacción de dos componentes. En ese caso, el gráfico generalmente se muestra como un gráfico de contorno y se denomina superficie de volcán . [2] Balandin introdujo los diagramas de volcanes. [3] [4]
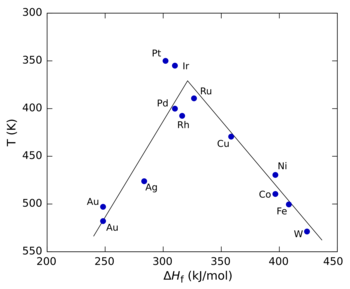
La figura de la derecha muestra un diagrama de volcán para la descomposición del ácido fórmico utilizando diferentes metales de transición como catalizadores. [5] En este caso, el calor de formación (Δ f H ) de la sal de formiato metálico se utilizó para el eje x porque los estudios demostraron que el intermedio de reacción era un formiato de superficie. Para el eje y, se utilizó la temperatura a la que la reacción alcanza una velocidad específica (el eje y se traza al revés para preservar la forma convencional de "volcán"). A valores bajos de ΔfH , la reacción es lenta (en otras palabras, requiere temperaturas más altas) porque la velocidad de adsorción es lenta y limitante . A valores altos de ΔfH , la desorción se convierte en el paso limitante de la velocidad. La velocidad máxima, que se observa para los metales del grupo del platino en este caso, requiere valores intermedios de Δ f H , siendo la velocidad una combinación de la velocidad de adsorción y la velocidad de desorción. [3] Los catalizadores pueden superar el límite de Sabatier mediante resonancia catalítica .
{{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite book}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )