El trióxido de fósforo es el compuesto químico con la fórmula molecular P 4 O 6 . Aunque la fórmula molecular sugiere el nombre de hexóxido de tetrafósforo, el nombre de trióxido de fósforo precedió al conocimiento de la estructura molecular del compuesto y su uso continúa en la actualidad. Este sólido incoloro está relacionado estructuralmente con el adamantano . Formalmente es el anhídrido del ácido fosforoso , H 3 PO 3 , pero no puede obtenerse mediante la deshidratación del ácido. Sólido blanco que se funde a temperatura ambiente, es ceroso, cristalino y altamente tóxico, con olor a ajo. [1]
Se obtiene por combustión de fósforo en un suministro limitado de aire a bajas temperaturas.
Los subproductos incluyen subóxido de fósforo rojo. [1]
El trióxido de fósforo reacciona con el agua para formar ácido fosforoso , reflejando el hecho de que es el anhídrido de ese ácido. [2]
Reacciona con cloruro de hidrógeno para formar H 3 PO 3 y tricloruro de fósforo .
Con cloro o bromo forma el correspondiente haluro de fosforilo y reacciona con yodo en un tubo sellado para formar tetrayoduro de difósforo . [1]
El P 4 O 6 reacciona con el ozono a 195 K para dar el compuesto inestable P 4 O 18 . [3]
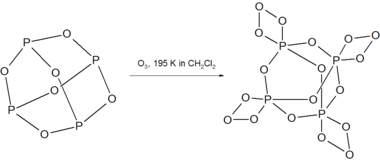
El P 4 O 18 se descompone por encima de 238 K en solución con liberación de gas O 2 . La descomposición del P 4 O 18 seco es explosiva.
En una reacción de desproporción , el P 4 O 6 se convierte en la especie mixta P (III) P (V) P 4 O 8 cuando se calienta en un tubo sellado a 710 K, siendo el producto secundario fósforo rojo. [3]
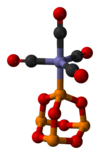
P 4 O 6 es un ligando para metales de transición, comparable al fosfito . Un complejo ilustrativo es P 4 O 6 ·Fe(CO) 4 . [4] Con BH 3 se produce un aducto dimérico: [3]
.jpg/440px-P4O6_photo_(5).jpg)