David Markham Lemal (nacido en 1934) es profesor emérito de química Albert W. Smith y profesor de investigación de química en el Dartmouth College . [1] [2] [3] Recibió una licenciatura (summa) del Amherst College en 1955 y un doctorado en química de la Universidad de Harvard en 1959. [4] En Harvard trabajó con RB Woodward en desoxiazúcares y en una síntesis del alcaloide yohimbina. [5]
Lemal comenzó su carrera académica independiente en la Universidad de Wisconsin en Madison , primero como instructor (1958-60), y luego como profesor asistente (1960-65). En 1965 se unió al departamento de química en Dartmouth College y se convirtió en profesor titular en 1969. Presidió el departamento de 1976 a 1979. En 1981, fue nombrado profesor de química Albert W. Smith. En Wisconsin, Lemal desarrolló un interés de toda su carrera en moléculas altamente tensas, especies de vida corta y reacciones concertadas. A fines de la década de 1960 se sintió intrigado por la química de organofluorados, que ha seguido siendo un foco principal de su investigación. Lemal fue un participante activo de las Conferencias de Investigación Gordon . En 1970, presidió la conferencia GRC sobre Química de Hidrocarburos, en 1971 la GRC sobre Compuestos Heterocíclicos; Fue miembro del consejo de administración (1973-79; presidente, 1977-78). Copresidió las Conferencias internacionales de invierno sobre flúor en 1987 y 1989, y luego, en 1990, presidió la División de flúor de la Sociedad Química Estadounidense. De 1996 a 2004, formó parte del Comité de Ciencia de la Sociedad. En 2005, Lemal se retiró de la docencia y se convirtió en profesor de investigación de química, continuando su trabajo en síntesis de organofluorados hasta 2016. Durante su carrera, Lemal fue mentor en investigación de más de cien estudiantes de pregrado, posgrado y becarios posdoctorales, y enseñó cursos de química durante 50 años. [1]
Lemal recibió los honores de ser miembro de la National Science Foundation (1955-58) y de ser miembro de la Alfred P. Sloan Foundation Research Fellow (1968-70). En 1987, recibió el Chemical Manufacturers Association Catalyst Award. En 1989, fue nombrado Profesor del Año de New Hampshire por el Council for Advancement and Support of Education. Recibió el Dartmouth President's Award por su liderazgo y logros sobresalientes (1991) y el Robert A. Fish Memorial Prize por sus contribuciones sobresalientes a la enseñanza de pregrado (1996). Ganó el premio de la American Chemical Society en 2002 por su trabajo creativo en química del flúor. En 2011, Lemal se convirtió en miembro de la American Chemical Society. [1]
Fuente: [6]
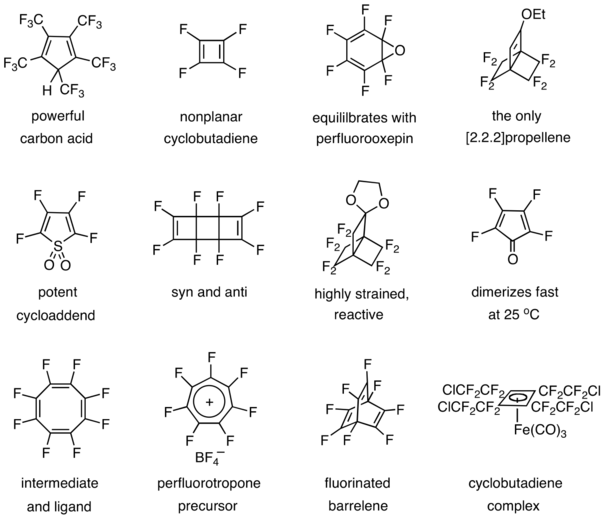
Habiendo sintetizado y estudiado el hexametilprismano en 1966, [7] el grupo de Lemal estaba interesado en cómo un prismano sustituido con grupos aceptores de electrones en lugar de grupos donantes diferiría en naturaleza y reactividad. Esto condujo a la fotólisis en fase de vapor del perfluorohexametilbenceno ( 1 ), que produjo no solo el prismano ( 2 ), sino también el benceno dewar ( 3 ) y el benzvaleno ( 4 ). [8] Un grupo inglés hizo el mismo descubrimiento de forma independiente. [9] Estas moléculas tensas eran notablemente robustas y térmicamente estables en comparación con sus contrapartes de hidrocarburos bastante frágiles, y ese intrigante contraste condujo a una mayor exploración de la química de los fluorocarbonos .
Posteriormente sintetizaron perfluorohexametilbiciclopropenilo ( 5 ) para dar cuerpo al primer conjunto completo de isómeros de valencia de benceno. [10] Este compuesto se reordena térmicamente a 1 con una vida media de ≥ 2 h a 360 °C, en comparación con el hidrocarburo original que polimeriza a -10 °C. [11] Lemal acuñó el término "efecto perfluoroalquilo" para representar el compuesto de influencias estabilizadoras, termodinámicas y cinéticas, que los grupos perfluoroalquilo confieren a las estructuras de carbono altamente tensas. [12] El efecto ha demostrado ser general, pero si los grupos flúor en lugar de perfluoroalquilo decoran el esqueleto de carbono, el comportamiento puede ser muy diferente, como revela el siguiente ejemplo.
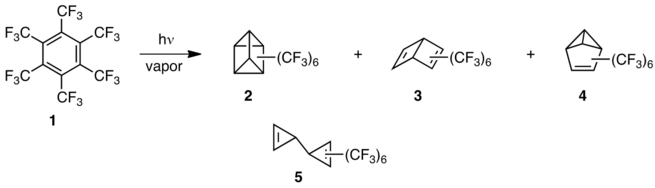
Otro caso de química contrastante surgió cuando el grupo de Lemal preparó perfluoroquadricyclane ( 6 ) mediante una fotorreacción a -30 °C y lo dejó calentar por encima de 0 °C. [13] Se produjo la reorganización al isómero tricíclico 7 , y un calentamiento adicional a temperatura ambiente produjo perfluorotropilideno ( 8 ). El cuadriciclano original ( 9 ) se reorganiza en cambio a norbornadieno ( 10 ), en condiciones mucho más vigorosas. [14]
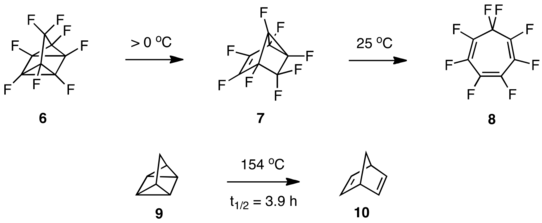
Los equilibrios ceto-enólicos se ven afectados drásticamente por la sustitución del flúor. En marcado contraste con las cetonas derivadas de hidrocarburos, cuyos tautómeros enólicos generalmente están presentes solo en cantidades traza en el equilibrio, las cetonas fluoradas a veces son mucho menos estables que sus enoles. [15] [16] [17] [18] Los equilibrios ceto-enólicos para la ciclopentanona ( 11 ) y la heptafluorociclopentanona ( 12 ) son un buen ejemplo. [17]
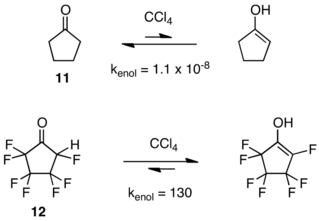
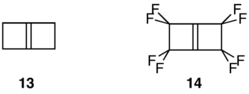
Los alquenos altamente reactivos y de alta tensión biciclo[2.2.0]hex-1(4)-eno ( 13 ) y su contraparte perfluorada 14 proporcionan otro contraste notable en estabilidad. Mientras que 13 se dimeriza y polimeriza a temperaturas inferiores a 0 °C, [19] 14 sobrevive al calentamiento a 140 °C y no forma un dímero bajo ninguna condición. [20]
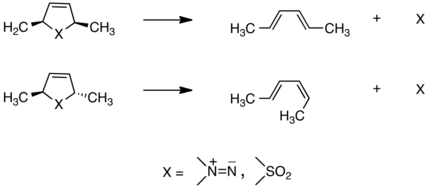
En 1966, Lemal y sus colaboradores estudiaron una clase de reacciones que se denominarían procesos cíclicos concertados queletrópicos en los que se forman o se rompen dos enlaces en el mismo átomo. Al descubrir que se producen de forma estereoespecífica, los hallazgos se basaron en las ideas de Woodward y Hoffmann para desarrollar de forma independiente una teoría de esta clase de transformaciones que explicaba los resultados experimentales del grupo, que se muestran aquí: [21] [22]
Una década después, cuando se aceptó generalmente que todos los procesos cíclicos concertados (denominados pericíclicos) obedecen las reglas de simetría orbital de Woodward-Hoffmann (de las cuales las de las reacciones quelotrópicas son un subconjunto), Lemal y sus colaboradores descubrieron un reordenamiento degenerado extraordinariamente fácil que los llevó a desafiar esa creencia. [23] El grupo S=O en la molécula de abajo se mueve paso a paso alrededor del grupo de 4 miembros con una constante de velocidad extrapolada de 70 millones de s −1 a 25 °C. [24]

Dada la geometría molecular, los investigadores supusieron que esto podría suceder solo si el par solitario de azufre forma un nuevo enlace SC a medida que el par de electrones del enlace SC que se rompe se convierte en el nuevo par solitario. Aunque más tarde se demostró que era incorrecta [25] [26], esta idea sin embargo condujo a una idea clave. Lemal y sus colaboradores reconocieron que hay muchos procesos cíclicos concertados en los que los electrones no enlazantes y enlazantes pueden intercambiar roles, procesos que no están sujetos a las reglas de simetría orbital. Esto condujo a un término pseudopericíclico . [23] La idea está muy bien ilustrada por la pirólisis de ésteres, que se ha demostrado que se desarrolla a través de un estado de transición planar:

En el oxígeno del grupo carbonilo, un par solitario forma el enlace con el hidrógeno y el enlace pi se convierte en el nuevo par solitario. Como estos orbitales se encuentran en planos perpendiculares y, por lo tanto, son ortogonales, existe efectivamente una "desconexión" en la disposición orbital cíclica que exime a la reacción de las restricciones de simetría orbital.
La fe en las reglas era tal que la idea de las reacciones pseudopericíclicas fue ignorada durante casi 20 años, pero luego David Birney de Texas Tech tomó la causa. [26] En una investigación larga y continua que ha combinado la experimentación y el cálculo con gran efecto, su grupo y otros posteriormente han establecido que hay ejemplos pseudopericíclicos que se pueden encontrar en todas las clases de procesos cíclicos concertados.
En 1960, Wanzlick informó que el tetraaminoetileno 1 se disocia fácilmente en mitades de diaminocarbeno [27] y su grupo publicó una larga serie de artículos que describían reacciones interesantes del 1 que se interpretaban como derivadas del carbeno. Basándose en un experimento cruzado, Lemal y sus colaboradores demostraron en 1964 que el 1 no se disocia ni siquiera en las condiciones más rigurosas que Wanzlick había empleado [28] . La química de la reacción se explicó en términos de un ataque electrofílico al tetraaminoetileno seguido de la escisión del enlace central.
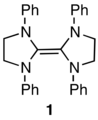
Muchos años después, en 1991, Arduengo hizo el sorprendente descubrimiento de que los diaminocarbenos con la estructura 2 son estables y no dimerizan. [29] Esto llevó a Denk en 1999 a repetir el experimento de cruce de Lemal, para encontrar el cruce y, por lo tanto, concluir que Wanzlick tenía razón sobre la disociación después de todo. [30] El grupo de Lemal respondió repitiendo el trabajo ellos mismos, y demostró que eliminar la catálisis electrofílica impedía la ocurrencia del cruce, reafirmando así el resultado que Lemal había obtenido 36 años antes. [31]

Al seleccionar una estructura de diaminocarbeno de carácter intermedio entre los carbenos de Wanzlick y Arduengo, el grupo de Lemal encontró y estudió un par carbeno-dímero que existe en equilibrio. [32] Aquí el dímero ( 3 ) se encuentra aproximadamente 5 kcal/mol por debajo de sus "mitades" ( 4 ) en energía libre a 25 °C.

Otras contribuciones incluyen la preparación y estudios de un potente ácido carbónico, [33] tetrafluorociclobutadieno, [34] [35] óxido de hexafluorobenceno, [36] [37] un [2.2.2]propeleno, [38] dióxido de tetrafluorotiofeno, [39] octafluorotriciclooctadieno, [40] un propelano altamente reactivo, [41] tetrafluorociclopentadienona, [42] octafluorociclooctatetraeno, [43] una sal de heptafluorotropilio, octafluorobarreleno, [44] y un complejo de ciclobutadieno. [45]