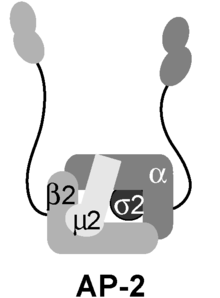
El complejo adaptador AP2 es una proteína multimérica que actúa en la membrana celular para internalizar la carga en la endocitosis mediada por clatrina . [1] Es un complejo estable de cuatro adaptinas que dan lugar a una estructura que tiene un dominio central y dos dominios apéndices unidos al dominio central mediante conectores polipeptídicos. Estos dominios de apéndices a veces se denominan "orejas". El dominio central se une a la membrana y a la carga destinada a la internalización . Los dominios del apéndice alfa y beta se unen a proteínas accesorias y a clatrina . Sus interacciones permiten la regulación temporal y espacial del ensamblaje de vesículas recubiertas de clatrina y su endocitosis .
El complejo AP-2 es un heterotetrámero que consta de dos adaptinas grandes (α y β), una adaptina mediana (μ) y una adaptina pequeña (σ):
El complejo adaptador AP2 existe en dos conformaciones principales: la conformación abierta (estado activo) y la conformación cerrada (estado inactivo). [2] En su estado activo, el sitio de unión de clatrina que se encuentra en la subunidad β y el sitio de unión de carga que se encuentra en la subunidad μ están expuestos al citosol, [2] permitiendo que se produzcan sus respectivas interacciones. En su estado inactivo, el complejo experimenta un cambio conformacional que hace que ambos sitios queden cubiertos, impidiendo sus funciones primarias. [3] Las cadenas pesadas α y β del complejo constituyen aproximadamente el 60 % de la secuencia polipeptídica de AP2 y están estrechamente estructuradas en 14 repeticiones HEAT que forman estructuras de hélice α en zigzag que interactúan con las "patas" helicoidales del trímero de clatrina. . [4] [2]

AP2 facilita el ensamblaje de redes de clatrina cuando es necesario que ocurra endocitosis, agregándose junto con otros complejos AP2, en su conformación activa. [4] Estos agregados AP2 interactúan con proteínas clatrina individuales a través de sus sitios β-activos, orientándolas hacia las "jaulas" de clatrina que forman la capa endocítica. [4]
La regulación de la actividad AP2 se realiza principalmente a través de reordenamientos conformacionales de la estructura en dos conformaciones distintas (y potencialmente una tercera y una cuarta). La conformación "abierta" es el estado activo del complejo, ya que los "hoyos" o sitios de unión activos para las clatrinas y la carga están descubiertos. Por otra parte, la conformación "cerrada" se denota por el cierre o inaccesibilidad de estos mismos sitios. [6]
Se ha descubierto que la presencia de clatrina induce la unión a la carga y, de manera similar, la presencia de carga parece inducir la unión de clatrina. Se cree que esto ocurre mediante una estabilización secundaria de la compleja estructura, que permitiría la activación parcial o el acceso a los respectivos pozos. [7] [8] El fosfatidilinositol-(4,5)-bisfosfato (PIP2) sirve como una secuencia señal que se une y es reconocida por AP2. PIP2 se puede encontrar dentro de liposomas que contienen carga, que interactúan con AP2 para luego unirse a clatrina y ejecutar su función. En la forma cerrada, el sitio de unión de PIP2 queda expuesto, lo que permite que se produzca la regulación conformacional. [9] Debido a esto, un cierto orden de ligeros cambios conformacionales provocan la conformación completamente abierta, comenzando con la unión de PIP2, luego la unión de la secuencia carga y finalmente la unión de clatrina. [9] Se cree que una familia de proteínas llamadas muniscinas son los principales activadores alostéricos del complejo adaptador AP2, [10] debido a su prevalencia en las fosas asociadas a AP2 y su inhibición, lo que resulta en una disminución de la endocitosis mediada por AP2. [11] [12] Además, se ha descubierto que el complejo está regulado y activado por la fosforilación de su subunidad (mu). [13] [14]
La desactivación o el cambio a la conformación "cerrada" aún no está clara. Se cree que los NECAP desempeñan un papel en ello al unirse a la subunidad α de AP2. [6] No se sabe mucho, pero la conformación abierta de AP2, que está fosforilada, parece ser necesaria para que NECAP1 se una a su núcleo. [3] El proceso de acción aún se desconoce, pero esta interacción provoca la desfosforilación del complejo adaptador AP2, desactivándolo.
Se ha identificado que AP2 participa íntimamente en las vías celulares autofágicas, responsables de la degradación de proteínas agregadas. [15] De hecho, se ha observado que forma complejo con la leucemia linfoide-mieloide del ensamblaje de fosfatidilinositol clatrina (PICALM), que serviría como un grupo receptor importante para la cadena ligera 3 de la proteína 1 asociada a microtúbulos ( LC3 ). LC3 tiene un papel importante en algunas vías autofágicas. [16] Debido a esto, se sospecha que la deficiencia o disfunción de AP2 puede ser un precursor del desarrollo de la enfermedad de Alzheimer familiar. [15]