El cloruro de tris(etilendiamina)cobalto(III) es un compuesto inorgánico con la fórmula [Co(en) 3 ]Cl 3 (donde "en" es la abreviatura de etilendiamina ). Es la sal de cloruro del complejo de coordinación [Co(en) 3 ] 3+ . Este trication fue importante en la historia de la química de coordinación debido a su estabilidad y su estereoquímica . Se han descrito muchas sales diferentes. El complejo fue descrito por primera vez por Alfred Werner, quien aisló esta sal como cristales con forma de aguja de color amarillo dorado. [1]
El compuesto se prepara a partir de una solución acuosa de etilendiamina y prácticamente cualquier sal de cobalto (II), como el cloruro de cobalto (II) . La solución se purga con aire para oxidar los complejos de cobalto (II)-etilendiamina a cobalto (III). La reacción se lleva a cabo con un rendimiento del 95% y el tricatión se puede aislar con una variedad de aniones. Un análisis detallado del producto de una síntesis a gran escala reveló que un subproducto menor era [Co(en) 2 Cl(H 2 NCH 2 CH 2 NH 3 )]Cl 3 , que contiene un raro ligando de etilendiamina monodentado (protonado). [2]
El catión [Co(en) 3 ] 3+ es octaédrico con distancias Co-N en el rango de 1,947–1,981 Å . Los ángulos N-Co-N son de 85° dentro de los anillos quelatos y de 90° entre átomos de nitrógeno en anillos adyacentes. [3]
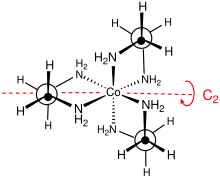
El grupo puntual de este complejo es D 3 . El complejo se puede resolver en enantiómeros que se describen como Δ y Λ. Por lo general, la resolución implica el uso de sales de tartrato . [4] La resolución óptica es un componente estándar de los cursos de síntesis inorgánica. [5] Debido a su no planaridad, los anillos MN 2 C 2 pueden adoptar cualquiera de dos conformaciones , que se describen con los símbolos λ y δ. La relación entre estas conformaciones de anillo y la configuración absoluta de los centros metálicos se describe con la nomenclatura lel (cuando la cadena principal en se encuentra paralela al eje de simetría C 3 ) u ob (cuando la cadena principal en es anverso a este mismo eje C 3 ). Por lo tanto, se pueden identificar las siguientes conformaciones diastereoméricas : Δ-( lel ) 3 , Δ-(lel) 2 (ob), Δ-(lel)(ob) 2 y Δ-( ob ) 3 . Por supuesto, también existen imágenes especulares de estas especies. [6]
Los complejos de coordinación catiónicos de amoníaco y aminas de alquilo cristalizan típicamente con agua en la red , y la estequiometría puede depender de las condiciones de cristalización y, en los casos de complejos quirales, de la pureza óptica del catión. El [Co(en) 3 ]Cl3 racémico se obtiene con mayor frecuencia como dihidrato o trihidrato. Para la sal ópticamente pura también se conocen (+)-[Co(en) 3 ] Cl3 ·1.5H2O , (+)-[Co ( en) 3 ]Cl3 · 0.5NaCl · 3H2O y (+)-[Co(en) 3 ] Cl3 · H2O . [3 ]
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )