La aspartato carbamoiltransferasa (también conocida como aspartato transcarbamoilasa o ATCase ) cataliza el primer paso en la vía biosintética de la pirimidina ( EC 2.1.3.2). [1]
En E. coli , la enzima es un complejo proteico de múltiples subunidades compuesto por 12 subunidades (300 kDa en total). [2] La composición de las subunidades es C 6 R 6 , formando 2 trímeros de subunidades catalíticas (34 kDa) y 3 dímeros de subunidades reguladoras (17 kDa). La disposición particular de las subunidades catalíticas y reguladoras en esta enzima proporciona al complejo un comportamiento fuertemente alostérico con respecto a sus sustratos. [3] La enzima es un ejemplo arquetípico de modulación alostérica del control fino de las reacciones enzimáticas metabólicas.
La ATCasa no sigue la cinética de Michaelis-Menten , sino que se encuentra entre sus estados "tenso" de baja actividad y baja afinidad y sus estados "relajado" de alta actividad y alta afinidad. [4] La unión del sustrato a las subunidades catalíticas da como resultado un cambio de equilibrio hacia el estado R, mientras que la unión del CTP a las subunidades reguladoras da como resultado un cambio de equilibrio hacia el estado T. La unión del ATP a las subunidades reguladoras da como resultado un cambio de equilibrio hacia el estado R. [5]
La ATCase es una enzima altamente regulada que cataliza el primer paso comprometido en la biosíntesis de pirimidina, la condensación de L-aspartato y carbamoil fosfato para formar N-carbamoil-L-aspartato y fosfato inorgánico . La catálisis por ATCase sirve como paso limitante de la velocidad en la biosíntesis de pirimidina porque altera su velocidad catalítica en respuesta a los niveles celulares tanto de pirimidinas como de purinas . El producto final de la vía de la pirimidina, CTP , disminuye la velocidad catalítica, mientras que el ATP , el producto final de la vía paralela de las purinas, aumenta la velocidad catalítica.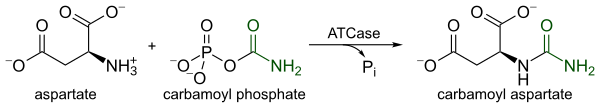
.jpg/440px-Aspartate_carbamoyltransferase_(ATCase).jpg)
La discusión de la estructura, el centro catalítico y el sitio alostérico que sigue se basa en la versión procariota de ATCase, específicamente la de E. coli .
Los primeros estudios demostraron que la ATCasa consta de dos tipos diferentes de cadenas polipeptídicas , que tienen diferentes funciones. [7] Las subunidades catalíticas catalizan la carbamilación del grupo amino del aspartato pero no tienen propiedades reguladoras, mientras que las subunidades reguladoras no tienen ninguna actividad catalítica pero contienen los sitios reguladores para la unión del efector. La holoenzima ATCasa está formada por dos trímeros catalíticos que están en contacto y se mantienen unidos por tres dímeros reguladores, por lo que la forma nativa de la enzima contiene seis cadenas de cada tipo, con un peso molecular total de 310 kDa .
Cada uno de los dominios catalíticos está compuesto por dos dominios estructurales, el dominio aspartato, que contiene la mayoría de los residuos responsables de la unión del aspartato , y el dominio carbamoil fosfato, que contiene la mayoría de los residuos que se unen al carbamoil fosfato . Cada dominio regulador también está compuesto por dos dominios, el dominio alostérico, que tiene el sitio de unión para los efectores de nucleótidos , y el dominio zinc , que consiste en cuatro residuos de cisteína agrupados en su región C-terminal. Estos residuos coordinan un átomo de zinc que no está involucrado en ninguna propiedad catalítica, pero se ha demostrado que es esencial para la asociación de subunidades reguladoras y catalíticas. [8]
La disposición tridimensional de las subunidades catalíticas y reguladoras implica varios contactos estabilizadores iónicos e hidrofóbicos entre los residuos de aminoácidos. [6] Cada cadena catalítica está en contacto con otras tres cadenas catalíticas y dos cadenas reguladoras. Cada monómero regulador está en contacto con otra cadena reguladora y dos cadenas catalíticas. En la enzima no ligada, los dos trímeros catalíticos también están en contacto.
El sitio catalítico de la ATCase se encuentra en la interfase entre dos cadenas catalíticas vecinas en el mismo trímero e incorpora cadenas laterales de aminoácidos de ambas subunidades. La comprensión del modo de unión de los sustratos al centro catalítico de la ATCase fue posible por primera vez gracias a la unión de un análogo de bisustrato, el N-(fosfonoacetil)-L-aspartato (PALA). [9] Este compuesto es un potente inhibidor de la ATCase y se cree que tiene una estructura muy similar a la del estado de transición de los sustratos. [10] Además, se han obtenido estructuras cristalinas de la ATCase unida a carbamoilfosfato y succinato. [11] Estos estudios, además de las investigaciones que utilizan mutagénesis dirigida al sitio de aminoácidos específicos, han identificado varios residuos que son cruciales para la catálisis, como Ser52, Thr53, Arg54, Thr55, Arg105, His134, Gln137, Arg167, Arg229, Glu231 y Ser80 y Lys84 de una cadena catalítica adyacente. El sitio activo es un bolsillo altamente cargado positivamente. Una de las cadenas laterales más críticas es la de Arg54, que interactúa con un oxígeno terminal y el oxígeno anhídrido del fosfato de carbamoilo, estabilizando la carga negativa del grupo fosfato saliente. Arg105, His134 y Thr55 ayudan a aumentar la electrofilicidad del carbono carbonílico al interactuar con el oxígeno carbonílico. [7] En general, la mejora de la velocidad de la ATCasa se logra mediante la orientación y estabilización de sustratos, intermediarios y productos en lugar de mediante la participación directa de residuos de aminoácidos en el mecanismo catalítico.
El sitio alostérico en el dominio alostérico de las cadenas R del complejo ATCase se une a los nucleótidos ATP, CTP y/o UTP. Hay un sitio con alta afinidad por ATP y CTP y uno con afinidad 10 a 20 veces menor por estos nucleótidos en cada dímero regulador. [7] El ATP se une predominantemente a los sitios de alta afinidad y posteriormente activa la enzima, mientras que la unión de UTP y CTP conduce a la inhibición de la actividad. El UTP puede unirse al sitio alostérico, pero la inhibición de ATCase por UTP solo es posible en combinación con CTP. Con CTP presente, la unión de UTP se mejora y se dirige preferentemente a los sitios de baja afinidad. Por el contrario, la unión de UTP conduce a una mayor afinidad por CTP en los sitios de alta afinidad y juntos inhiben la actividad enzimática hasta en un 95%, mientras que la unión de CTP sola inhibe la actividad en un 50% a 70%. [3] La comparación de las estructuras cristalinas de las formas T y R de la ATCasa muestra que aumenta de tamaño durante la transición alostérica y que las subunidades catalíticas se condensan durante este proceso. Los dos trímeros catalíticos se separan a lo largo del eje triple en 12 Å y giran alrededor de este eje 5° cada uno, lo que finalmente conduce a una reorientación de las subunidades reguladoras alrededor de su eje doble en 15°. [12] Este cambio de estructura cuaternaria está asociado con alteraciones en las interacciones entre subunidades y entre dominios. La interacción entre las subunidades C1-C4 y R1 se modifica ampliamente durante esta conversión. En particular, hay un gran movimiento de los residuos de aminoácidos 230-254, conocidos colectivamente como el bucle 240s. Estos residuos se encuentran en la hendidura entre los dominios de fosfato de carbamoilo y aspartato en la interfaz C1-C4. El resultado general de estos cambios estructurales es que los dos dominios de cada cadena catalítica se acercan, lo que garantiza un mejor contacto con los sustratos o sus análogos .
Durante esta transición estructural, algunas interacciones entre las cadenas laterales se pierden y otras se establecen. Los estudios han confirmado que la posición del bucle 240s afecta directamente la unión del sustrato en el sitio activo correspondiente. [13] Estudios anteriores que utilizaron mutagénesis dirigida al sitio del bucle 240s mostraron que las interacciones entre Asp271 y Tyr240, y entre Glu239 de C1 y Tyr165 de C4 estabilizarían el estado T, mientras que las interacciones entre Glu239 de C1 y tanto Lys164 como Tyr165 de C4 estabilizarían el estado R. [14]
Ubicada cerca del bucle 240s y el sitio activo, la región del bucle que abarca los residuos 160-166 desempeña un papel tanto en la arquitectura interna de la enzima como en sus propiedades reguladoras. [15] En particular, el residuo Asp162 interactúa con Gln231 (conocido por estar involucrado en la unión del aspartato) y se une a los mismos residuos tanto en el estado T como en el R. Un mutante que tenía este residuo mutado a alanina mostró una enorme reducción en la actividad específica, una disminución del doble en la afinidad por el aspartato , una pérdida de cooperatividad homotrópica y una disminución de la activación por ATP . Se sugirió que el cambio en la estructura general causado por la introducción de este residuo afecta a otros residuos en las interfaces R1-C1, R1-C4 y C1-C4, que están involucradas en la transición de la estructura cuaternaria . [16]
Las subunidades reguladoras y catalíticas existen como homólogos proteicos fusionados, lo que proporciona una fuerte evidencia de que interactuarían entre sí. [17] Dos trímeros catalíticos y dos dímeros reguladores se ensamblan para formar un intermedio de la aspartato carbamoiltransferasa que consta de 6 subunidades catalíticas y 4 subunidades reguladoras. [18]
{{cite book}}: |last=tiene nombre genérico ( ayuda )Mantenimiento de CS1: varios nombres: lista de autores ( enlace )