Aleksandr Pavlovich Dianin ( en ruso : Александр Павлович Дианин ; 20 de abril de 1851 - 6 de diciembre de 1918) fue un químico ruso de San Petersburgo . Realizó estudios sobre fenoles y descubrió un derivado del fenol ahora conocido como bisfenol A [1] [2] y el correspondiente compuesto de Dianin . [3] Estaba casado con la hija adoptiva de su colega químico Alexander Borodin . En 1887, Dianin sucedió a su suegro como presidente del Departamento de Química de la Academia Imperial Médico-Quirúrgica de San Petersburgo (ahora Academia Médica Militar SM Kirov ).
El método de Dianin para preparar bisfenol A de 1891 [1] sigue siendo el enfoque más conocido para este importante compuesto, [4] aunque el método se ha refinado para la síntesis a escala industrial. [5] Implica la condensación catalizada de una mezcla 2:1 de fenol y acetona en presencia de ácido clorhídrico concentrado o ácido sulfúrico . La reacción se produce fácilmente a temperatura ambiente produciendo un producto crudo que contiene una gran variedad de productos secundarios (incluido el compuesto de Dianin ) en cuestión de horas. [4] La ecuación general es simple, con agua como único subproducto :
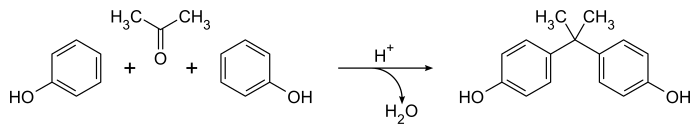
Mecánicamente, el catalizador ácido convierte la acetona en un ion carbenio que experimenta una reacción de sustitución aromática electrofílica con el fenol, produciendo productos predominantemente para -sustituidos . Una segunda especie de carbenio se produce por protonación y pérdida del grupo hidroxilo alifático , dando lugar al bisfenol A (4,4'-isopropilidendifenol) después de una segunda reacción de sustitución aromática. El proceso no es muy selectivo y se conoce una gran cantidad de productos menores y reacciones secundarias. [4]

Los productos secundarios que son isómeros del bisfenol A resultan de la formación de productos orto -sustituidos, e incluyen los isómeros 2,2'- y 2,4'- del isopropilidendifenol. Otras reacciones secundarias incluyen la formación de trifenol I, 4,4'-(4-hidroxi- m -fenilendiisopropilideno)difenol, a partir del ataque de un electrófilo de carbenio sobre una molécula de bisfenol A y la formación de trifenol II, 4,4',4''-(2-metil-2-pentanil-4-ilideno)trifenol, cuando una reacción de eliminación convierte el carbenio en una olefina reactiva . [4] La dimerización catalizada de acetona a través de una condensación aldólica es bien conocida, y produce alcohol de diacetona y (por deshidratación ) óxido de mesitilo tanto en condiciones ácidas [6] como básicas. [7] [8] La generación in situ de óxido de mesitilo agrega otra olefina reactiva a la mezcla. En los casos en que una fracción olefínica puede interactuar con un grupo hidroxilo fenólico (normalmente como resultado de una sustitución orto ), se producen reacciones de ciclización rápidas que producen flavanos y cromanos . [4] Esta es la fuente del compuesto de Dianin en la mezcla, y Dianin demostró posteriormente que el compuesto se puede producir con un rendimiento mucho mayor haciendo reaccionar el fenol con óxido de mesitilo directamente. [3] Trabajos posteriores han demostrado que la producción de bisfenol A se puede hacer mucho más selectiva utilizando una mezcla de reacción con un exceso considerable de fenol en lugar de una composición estequiométrica 2:1, lo que suprime en gran medida las reacciones secundarias. [5]