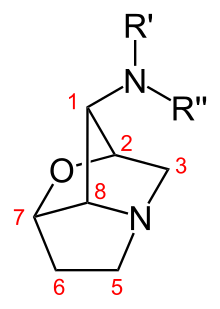
Un alcaloide lolina es un miembro de las 1-aminopirrolizidinas (a menudo denominadas lolinas ), que son productos naturales bioactivos con varias características biológicas y químicas distintivas. Las lolinas son compuestos insecticidas y disuasorios de insectos que se producen en pastos infectados por simbiontes fúngicos endófitos del género Epichloë ( especie anamorfa : Neotyphodium ). Las lolinas aumentan la resistencia de los pastos infectados por endófitos a los herbívoros insectos y también pueden proteger a las plantas infectadas de estreses ambientales como la sequía y la competencia espacial. Son alcaloides , compuestos orgánicos que contienen átomos de nitrógeno básicos. La estructura química básica de las lolinas comprende un anillo de pirrolizidina saturado, una amina primaria en el carbono C-1 y un puente de éter interno , una característica distintiva de las lolinas, que es poco común en compuestos orgánicos, que une dos carbonos de anillo distantes (C-2 y C-7) (ver Fig. 1). Diferentes sustituyentes en la amina C-1, como los grupos metilo , formilo y acetilo , producen especies de lolina que tienen bioactividad variable contra los insectos. Además de los simbiontes endófitos-gramíneas, también se han identificado alcaloides de lolina en algunas otras especies de plantas ; a saber, especies de Adenocarpus (familia Fabaceae ) y Argyreia mollis (familia Convolvulaceae ).
Un miembro de los alcaloides de la lolina se aisló por primera vez de la hierba Lolium temulentum y su composición elemental se determinó en 1892. Inicialmente se denominó temulina y luego se renombró norlolina . (Revisado por Schardl et al. (2007).) [1] Los estudios realizados en los años 1950 y 1960 por investigadores rusos establecieron el nombre de lolina e identificaron el puente 2,7 éter característico en su estructura molecular. [1] Desde entonces, los métodos analíticos para la purificación y el análisis de las lolinas se han refinado y se han identificado varias especies diferentes de lolinas en muchos Lolium y gramíneas relacionadas infectadas por los endófitos Epichloë/Neotyphodium (epichloae). [2] [3] Las lolinas están ausentes en las plantas herbáceas que no albergan los endófitos epicloae, y no todas las epicloae producen las lolinas. [1] Debido a la asociación muy íntima de la planta y el endófito y las dificultades para reproducir las condiciones simbióticas in vitro , durante mucho tiempo se desconoció si el hongo era el productor de las lolinas o si eran sintetizadas por la planta en respuesta a la infección del endófito. En 2001, se demostró que el endófito Neotyphodium uncinatum produce lolinas en algunos medios de crecimiento definidos químicamente , [4] lo que sugiere que el endófito también es el productor de las lolinas en la planta de pasto. También se han reportado las lolinas de algunas plantas en varias familias de plantas , [5] [6] lo que sugiere una ocurrencia más extendida de estos compuestos en la naturaleza.
Las lolinas son insecticidas y disuasorias para una amplia gama de insectos, incluyendo especies de Hemiptera , Coleoptera , Hymenoptera , Lepidoptera y Blattodea , como el pulgón de la cereza de pájaro-avena (género Rhopalosiphum ), la chinche de algodoncillo grande ( Oncopeltus fasciatus ) y la cucaracha americana ( Periplaneta americana ). [1] [7] Los valores de LC50 de N - formilolina o N - acetilolina de los extractos de semillas de pasto son de 1-20 μg/ml para pulgones y chinches de algodoncillo y perjudican el desarrollo y la fecundidad de los insectos y hacen que eviten los tejidos de pasto que contienen lolinas. [7] Sin embargo, los resultados de las pruebas de alimentación con extractos de pasto son ocasionalmente difíciles de interpretar debido a la presencia de otros alcaloides endófitos en estos extractos, [1] y se desconocen los mecanismos exactos de las acciones insecticidas de las lolinas. Las lolinas pueden ser neurotóxicas para los insectos, y las diferencias en los grupos químicos en la C-1-amina resultan en diferentes niveles de toxicidad para los insectos; por ejemplo, la N -formilolina (ver Figura 2), que se encuentra en concentraciones más altas en plantas herbáceas infectadas con endófitos, [7] tiene una mayor toxicidad para los insectos que algunas otras lolinas, que se encuentran en concentraciones más bajas en la planta herbácea. [1]

Las bioactividades de la lolina muestran cierta variabilidad inesperada con la variación en su concentración en los tejidos de la hierba. Por ejemplo, el endófito de festuca alta, N. coenophialum , se ha asociado con una mayor resistencia al nematodo endoparásito de raíces migratorio, Pratylenchus scribneri . En concentraciones bajas, la N -formilolina sirve como quimioatrayente para P. scribneri , pero actúa como repelente en concentraciones más altas. [8] Sin embargo, los alcaloides del cornezuelo también tienen efectos repelentes e inmovilizadores sobre P. scribneri , [8] y un endófito de raigrás perenne que carece de lolinas, y que ha sido modificado genéticamente para no producir alcaloides del cornezuelo, exhibe resistencia a este nematodo. [9] Por lo tanto, la importancia relativa de la lolina y los alcaloides del cornezuelo para la resistencia a los nematodos sigue sin estar clara.
Muchos endófitos epicloae, incluyendo N. coenophialum simbiótico con Lolium arundinaceum (sin. Festuca arundinacea , festuca alta), también producen alcaloides del cornezuelo que son tóxicos para los herbívoros mamíferos. Los alcaloides del cornezuelo se encuentran en concentraciones relativamente bajas en la planta y a menudo son difíciles de detectar analíticamente. Por el contrario, las lolinas se acumulan con frecuencia en niveles muy altos en los tejidos de la hierba, [1] y, por lo tanto, inicialmente también se asociaron con toxicidad para los herbívoros mamíferos . [10] Específicamente, se pensaba que las lolinas eran responsables de los síntomas tóxicos llamados toxicosis de festuca que se muestran por el ganado que pasta en pastos infectados por N. coenophialum . [10] Sin embargo, posteriormente se demostró que solo los alcaloides del cornezuelo producidos por endófitos son responsables de los síntomas de la toxicosis de festuca (o síndrome de verano ), [11] y no las lolinas que, incluso en dosis altas, solo tienen efectos fisiológicos muy pequeños en los mamíferos que se alimentan. [12] Otro grupo de alcaloides, los alcaloides de tipo senecio , son producidos por varias plantas y al igual que las lolinas, los alcaloides de senecio poseen una estructura de anillo de pirrolizidina. Sin embargo, a diferencia de las lolinas, los alcaloides de senecio exhiben una fuerte hepatotoxicidad , [13] debido a un doble enlace entre C-1 y C-2 en su estructura de anillo. [13] Este doble enlace está ausente en las lolinas, lo que explica la falta de hepatotoxicidad de este grupo de compuestos. Se ha sugerido que las lolinas inhiben la germinación de las semillas o el crecimiento de otras plantas ( alelopatía ), [14] y aumentan la resistencia de las gramíneas infectadas contra la sequía , pero tales efectos no se han comprobado en condiciones más naturales de cultivo o en hábitats. [1] [15]

Las lolinas son producidas por varias simbiosis de gramíneas y endófitos que involucran especies de epicloae, a menudo junto con otros metabolitos bioactivos, incluidos los alcaloides del cornezuelo y los diterpenoides indólicos , y el inusual alcaloide de pirrolopirazina, peramina , que no se encuentra en otras comunidades biológicas u organismos. Sin embargo, las lolinas se producen en niveles que pueden superar los 10 mg/g de tejido de la hierba (que van desde 2 a 20 000 μg/g [1] [16] ), superando las concentraciones de los otros alcaloides endófitos en >1000 veces. [7] Las lolinas producidas en las gramíneas Lolium pratense (sin. Festuca pratensis , festuca de los prados) y festuca alta infectadas por N. uncinatum y N. coenophialum (ver Figura 3), respectivamente, exhiben concentraciones variables en los tejidos de la hierba. [2] [16] Concentraciones más altas de lolina (100–1000 μg/g) están presentes en las semillas y en los tejidos de las hojas más jóvenes, y las lolinas muestran cambios estacionales en los niveles de concentración en toda la planta. [16] La aparición periódica de tejidos con altas concentraciones de lolina, como tallos florales y semillas, contribuye a esta variación estacional. [16] Las concentraciones de lolina a menudo aumentan en los tejidos de la hierba que vuelven a crecer después de la defoliación y el corte de las plantas, lo que sugiere un mecanismo de respuesta de defensa inducible , que involucra a ambos socios simbióticos. Sin embargo, este aumento parece deberse a niveles más altos de lolina en hojas más jóvenes en comparación con las hojas más viejas, [17] pero también se han informado aumentos de lolina que se asemejan a defensas vegetales inducibles. [18] La variación de la concentración de lolina con la etapa de desarrollo de tejidos de hierba específicos [16] sugiere la regulación de las distribuciones de lolina en la planta , proporcionando una mayor protección de los tejidos recién crecidos o embrionarios contra los ataques de insectos. [1] Sorprendentemente, la aplicación exógena del compuesto señalizador de la planta, metil jasmonato —que comúnmente señala la depredación por insectos— disminuye la expresión de los genes de las lolinas. [19] Los factores que controlan la producción de lolinas también varían entre los tejidos de pastos infectados por endófitos: mientras que los aminoácidos suministrados por las plantas que son precursores de lolinas limitan la acumulación de lolinas en muchos tejidos de pastos, [17] su producción en tejidos que soportan el crecimiento micelial externo para la reproducción de hongos ( estromas ) está regulada por la expresión de genes de lolinas. [20]
Las lolinas son estructuralmente similares a los alcaloides de pirrolizidina producidos por muchas plantas, en particular el anillo de necina que contiene una amina terciaria . Esto condujo a la hipótesis inicial de que la biosíntesis de las lolinas es similar a la de las pirrolizidinas vegetales, que se sintetizan a partir de poliaminas . [21] Sin embargo, los estudios de alimentación con aminoácidos marcados con isótopos de carbono o moléculas relacionadas en cultivos puros del hongo productor de lolina N. uncinatum demostraron recientemente que la vía del alcaloide de la lolina es fundamentalmente diferente de la de las pirrolizidinas vegetales. [1] La estructura química básica de la lolina se ensambla en varios pasos biosintéticos a partir de los precursores de aminoácidos , L -prolina y L -homoserina . [22] En el primer paso propuesto en la biosíntesis de lolina, estos dos aminoácidos se acoplan en una reacción de condensación que une el carbono γ en la homoserina a la amina secundaria en la prolina en una reacción catalizada por enzimas de tipo PLP para formar el intermediario de lolina, N- (3-amino-3-carboxi)propilprolina (NACPP). [23] Se cree que los pasos posteriores en la biosíntesis de lolina proceden con descarboxilaciones oxidativas y catalizadas por enzimas PLP secuenciales de los grupos carboxi en las fracciones de homoserina y prolina, respectivamente, ciclización para formar la estructura del anillo central de lolina y oxidación de los carbonos C-2 y C-7 para dar el puente de oxígeno que abarca los dos anillos de pirrolizidina. [1] [24]
Los estudios genéticos concuerdan con las rutas biosintéticas establecidas en los experimentos de alimentación de precursores. [1] Los estudios basados en AFLP que utilizan cruces entre cepas del endófito, Epichloë festucae , que difieren en la capacidad de producir lolinas, muestran que la producción de lolina y la protección de la hierba, Lolium giganteum , de la alimentación por el pulgón , Rhopalosiphum padi , se segregan de manera mendeliana . [25] La presencia de un solo locus para la producción de lolina se confirmó más tarde con el hallazgo de que los endófitos epicloae productores de lolina contienen un grupo de genes ( grupo LOL ) de al menos once genes. [20] [26] Los genes LOL se regulan positivamente de forma grande y coordinada durante la producción de alcaloides de lolina, [24] y las pruebas genéticas experimentales que implican la manipulación de genes LOL seleccionados mediante interferencia de ARN y eliminación de genes han confirmado directamente la participación de dos de los genes LOL en la biosíntesis de lolina. [27] [28] Estas pruebas y similitudes en las secuencias de péptidos de las proteínas codificadas por estos genes con enzimas conocidas indican que un gen, denominado lolC , es probablemente requerido para el primer paso en la biosíntesis de lolina (condensación de L -prolina y L -homoserina para la formación de NACPP), [27] y otro gen, LolP —probablemente codificando una monooxigenasa del citocromo P450— , para la oxigenación de un grupo metilo en la amina C-1 de N -metilolina, que da la lolina más abundante en muchos simbiontes de pastos y endófitos, N -formilolina. [28]