El 1,2,4,5-tetrabromobenceno es un bromuro de arilo y un bromobenceno tetrasustituido con la fórmula C 6 H 2 Br 4 . Es uno de los tres isómeros del tetrabromobenceno. El compuesto es un sólido blanco. El 1,2,4,5-tetrabromobenceno es un metabolito importante del retardante de llama hexabromobenceno . [1]
La síntesis de 1,2,4,5-tetrabromobenceno ya había sido descrita en 1865 a partir de benceno y bromo en exceso en un tubo sellado a 150 °C. [2] Sin embargo, el punto de fusión claramente reducido de aproximadamente 160 °C indica impurezas en el producto final. En su tesis de 1885, Adolf Scheufelen publicó la síntesis de una muestra más pura utilizando cloruro de hierro (III) FeCl3 como catalizador , aislada como "agujas bonitas" ("schönen Nadeln"). [3]
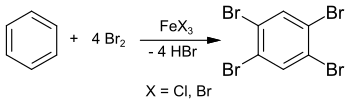
La síntesis también se puede llevar a cabo en solución en cloroformo o tetraclorometano y produce 1,2,4,5-tetrabromobenceno con un rendimiento del 89%. [4] Esta reacción también se puede llevar a cabo en un experimento de laboratorio con exceso de bromo y clavos de hierro (como material de partida para el bromuro de hierro (III) FeBr 3 ). [5] La etapa intermedia es el 1,4-dibromobenceno , que reacciona aún más con el exceso de bromo para dar 1,2,4,5-tetrabromobenceno.
Debido a su estructura simétrica y reactividad, el 1,2,4,5-tetrabromobenceno es un precursor de cristales líquidos nemáticos [6] con mesógenos cruzados y de cristales líquidos columnares (discoticos) [7] [8] con un núcleo extenso de tetrabenzoantraceno plano, "similar a un tablero".

En una reacción de un solo recipiente, el 1,2,4,5-tetrabromobenceno reacciona con 4-hidroxibenzaldehído , el agente alquilante 1-bromopentano, el reactivo de Wittig yoduro de metiltrifenilfosfonio, la base carbonato de potasio , el catalizador de transferencia de fase bromuro de tetrabutilamonio , el reactivo de Heck acetato de paladio (II) y el co-catalizador de Heck 1,3-bis (difenilfosfino) propano (dppp) en dimetilacetamida obteniendo directamente un tetraalcoxilstilbeno simétrico como isómero E con un rendimiento del 17%. [9]
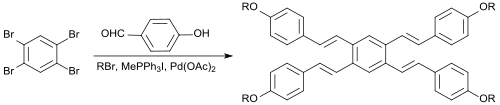
Debido a su pronunciada conjugación π, dichos compuestos podrían aplicarse potencialmente como abrillantadores ópticos , materiales OLED o cristales líquidos.
Los N -alquil-tetraaminobencenos están disponibles a partir de 1,2,4,5-tetrabromobenceno en altos rendimientos, que se pueden ciclar con ortoformiato de trietilo y ácidos a sales de benzobis(imidazolio) (sales BBI) y oxidar con oxígeno para formar diiminas de 1,4-benzoquinona. [10]
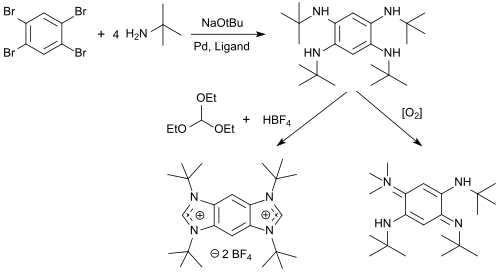
Las sales de BBI son colorantes fluorescentes versátiles con longitudes de onda de emisión λ em entre 329 y 561 nm, solvatocromismo pronunciado y fuerte desplazamiento de Stokes dependiente del solvente , que pueden usarse como etiqueta de proteína para el etiquetado fluorescente de proteínas. [11]
A partir de 1,2,4,5-tetrabromobenceno, se puede preparar in situ una 1,4-monoarina con un equivalente de n -butillitio por abstracción de bromo, que reacciona inmediatamente con furano para formar 6,7-dibromo-1,4-epoxi-1,4-dihidronaftaleno (6,7-dibromonaftaleno-1,4-endóxido) con un rendimiento del 70%. [12]

Cuando se utilizan 2,5-dialquilfuranos (por ejemplo, 2,5-(di-n-octil)furano), se forma el monoendóxido dibromado con un rendimiento del 64 %, a partir del cual se forma dibromo-5,8-di-n-octilnaftaleno con polvo de zinc/ tetracloruro de titanio con un rendimiento del 88 %. [13]

Tras el tratamiento con tetracloruro de titanio y polvo de zinc, el endóxido se desoxigena produciendo 2,3-dibromnaftaleno. [14]
El endóxido reacciona con 3-sulfoleno en una reacción de Diels-Alder tras la eliminación del dióxido de azufre . El aducto tricíclico resultante se convierte en 2,3-dibromoantraceno con un buen rendimiento. [15]
Si se permite que el óxido de dibromeno reaccione más con furano, en presencia de n -butillitio [12] o amida de potasio [16] o a través de un intermediario 1,4-arino, se forma el 1,4-aducto tricíclico 1,4:5.8-diepoxi-1,4,5,8-tetrahidroantraceno [17] con un rendimiento del 71% como una mezcla sin-anti . Sin embargo, con amida de sodio en dimetiléter de etilenglicol (DME), el óxido de dibromeno se comporta como un equivalente 1,3-arino y forma con furano un 1,3-aducto tricíclico similar al fenantreno, que puede reaccionar con furano y amida de sodio para formar un derivado de trifenileno (1,3,5-tris-areno). [16]
Las cicloadiciones [2+4] con 1,2,4,5-tetrabromobenceno a veces se producen con rendimientos muy altos, como la reacción de un 1,3-difenil-isobenzofurano sustituido con dihalógeno a un derivado de antraceno tetrahalogenado (98%), que se convierte sucesivamente con 1,3-difenil-isobenzofurano con un rendimiento del 65% a un derivado de pentaceno y furano a un derivado de hexaceno (67%). [18]

La reticulación de polímeros modificados con benzimidazol proporciona materiales con una alta capacidad de absorción de dióxido de carbono , lo que podría ser adecuado para la separación de CO2 de mezclas de gases. [19]

Es el material de partida para las mono- y bis-arinas. [12]
El 1,2,4,5-tetrabromobenceno es un producto de degradación tóxico para el hígado del retardante de llama hexabromobenceno y ya se detectó en Japón en 1987 en muestras de leche materna. [20]