El compuesto orgánico 1,1,1-tricloroetano , también conocido como metil cloroformo y cloroteno , es un cloroalcano con la fórmula química CH 3 CCl 3 . Es un isómero del 1,1,2-tricloroetano . Este líquido incoloro y de olor dulce alguna vez se produjo industrialmente en grandes cantidades para su uso como disolvente . [4] Está regulado por el Protocolo de Montreal como sustancia que agota la capa de ozono y su uso se está eliminando rápidamente.
El 1,1,1-tricloroetano fue reportado por primera vez por Henri Victor Regnault en 1840. Industrialmente, generalmente se produce en un proceso de dos pasos a partir de cloruro de vinilo . En el primer paso, el cloruro de vinilo reacciona con cloruro de hidrógeno a 20-50 °C para producir 1,1-dicloroetano :
Esta reacción está catalizada por una variedad de ácidos de Lewis , principalmente cloruro de aluminio , cloruro de hierro (III) o cloruro de zinc . Luego, el 1,1-dicloroetano se convierte en 1,1,1-tricloroetano mediante reacción con cloro bajo irradiación ultravioleta :
Esta reacción se desarrolla con un rendimiento del 80-90 % y el subproducto cloruro de hidrógeno se puede reciclar al primer paso del proceso. El principal subproducto es el compuesto relacionado 1,1,2-tricloroetano , del cual el 1,1,1-tricloroetano se puede separar mediante destilación .
Una cantidad algo menor de 1,1,1-tricloroetano se produce a partir de la reacción de 1,1-dicloroeteno y cloruro de hidrógeno en presencia de un catalizador de cloruro de hierro (III) :
El 1,1,1-tricloroetano se vende con estabilizadores porque es inestable respecto a la deshidrocloración y ataca a algunos metales. Los estabilizadores comprenden hasta el 8% de la formulación, incluidos eliminadores de ácido (epóxidos, aminas) y complejantes .
El 1,1,1-tricloroetano generalmente se considera un disolvente no polar. Debido a la buena polarizabilidad de los átomos de cloro, es un disolvente superior para compuestos orgánicos que no se disuelven bien en hidrocarburos como el hexano . Es un excelente disolvente para muchos materiales orgánicos y también uno de los hidrocarburos clorados menos tóxicos . Antes del Protocolo de Montreal, se usaba ampliamente para limpiar piezas metálicas y placas de circuitos , como solvente fotorresistente en la industria electrónica , como propulsor de aerosoles , como aditivo de fluido de corte y como solvente para tintas, pinturas, adhesivos y otros recubrimientos. Se utilizó 1,1,1-tricloroetano para limpiar en seco cuero y gamuza . [5] El 1,1,1-tricloroetano también se utiliza como fumigante insecticida .
También era el limpiador estándar para películas fotográficas (películas/diapositivas/negativos, etc.). Otros disolventes comúnmente disponibles dañan la emulsión y la base ( la acetona dañará gravemente la base de triacetato en la mayoría de las películas) y, por lo tanto, no son adecuados para esta aplicación. El sustituto estándar, Forane 141, es mucho menos eficaz y tiende a dejar residuos. El 1,1,1-tricloroetano se utilizó como diluyente en productos líquidos correctores como el papel líquido . Muchas de sus aplicaciones utilizaban anteriormente tetracloruro de carbono (que fue prohibido en productos de consumo estadounidenses en 1970). A su vez, el propio 1,1,1-tricloroetano está siendo sustituido en el laboratorio por otros disolventes. [6]
El 1,1,1-tricloroetano fue uno de los organoclorados volátiles que se han probado como alternativas al cloroformo en anestesia. [7] En la década de 1880, se descubrió que era un sustituto fuerte y seguro del cloroformo [8] pero su producción era costosa y difícil. [9]
En 1880, se sugirió el 1,1,1-tricloroetano como anestésico. Ese mismo año se hizo referencia por primera vez a él como "metilcloroformo". En ese momento, los efectos narcóticos del hidrato de cloral se debían a una ruta metabólica hipotética hacia el cloroformo en la "sangre alcalina". El tricloroetano se estudió por su similitud estructural con el cloral y sus posibles efectos anestésicos. Sin embargo, el tricloroetano no mostró ninguna conversión a cloroformo en experimentos de laboratorio. El isómero 1,1,2-tricloroetano , que carecía de un grupo triclorometilo , exhibía efectos anestésicos incluso más fuertes que el isómero 1,1,1. [10]
Aunque no es tan tóxico como muchos compuestos similares, el 1,1,1-tricloroetano inhalado o ingerido actúa como un depresor del sistema nervioso central y puede causar efectos similares a los de la intoxicación por etanol , incluidos mareos , confusión y, en concentraciones suficientemente altas, inconsciencia y muerte. [11] Se han informado envenenamientos fatales y enfermedades relacionadas con la inhalación intencional de tricloroetano. [12] [13] [14] [15] La eliminación del producto químico del líquido corrector comenzó debido a que la Propuesta 65 lo declara peligroso y tóxico. [16] [17]
El contacto prolongado de la piel con el líquido puede provocar la eliminación de grasas de la piel , lo que provoca irritación de la piel.
La Agencia Internacional para la Investigación del Cáncer sitúa el 1,1,1-tricloroetano en el Grupo 2A como probable carcinógeno . [18]
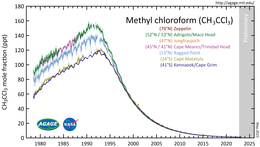

El Protocolo de Montreal señaló al 1,1,1-tricloroetano como uno de los compuestos responsables del agotamiento de la capa de ozono y prohibió su uso a partir de 1996. Desde entonces, su fabricación y uso se han eliminado gradualmente en la mayor parte del mundo. Su presencia atmosférica ha disminuido rápidamente debido a su vida atmosférica relativamente corta , de unos cinco años. [19]
Describimos cuatro casos de muerte súbita en adolescentes asociados con la inhalación recreativa de líquido corrector de máquinas de escribir que ocurrieron durante el período 1979 hasta mediados de 1984.
Un niño de 13 años fue encontrado muerto en el bosque luego de la inhalación de 1,1,1-tricloroetano (TCE).
Gillette acordó reformular el producto para que no representara un riesgo que requiriera una advertencia de la Proposición 65.