
La horquilla beta (a veces también llamada cinta beta o unidad beta-beta ) es un motivo estructural proteico simple que involucra dos hebras beta que parecen una horquilla . El motivo consiste en dos hebras que son adyacentes en la estructura primaria , orientadas en una dirección antiparalela (el extremo N de una hoja es adyacente al extremo C de la siguiente) y unidas por un bucle corto de dos a cinco aminoácidos . Las horquillas beta pueden ocurrir de forma aislada o como parte de una serie de hebras unidas por enlaces de hidrógeno que colectivamente comprenden una hoja beta .
Investigadores como Francisco Blanco et al. han utilizado la RMN de proteínas para demostrar que las horquillas beta se pueden formar a partir de péptidos cortos aislados en solución acuosa, lo que sugiere que las horquillas podrían formar sitios de nucleación para el plegamiento de proteínas . [1]
Las horquillas beta se clasificaron originalmente únicamente por el número de residuos de aminoácidos en sus secuencias de bucle, de modo que se las llamó de un residuo, de dos residuos, etc. [2] Este sistema, sin embargo, es algo ambiguo ya que no tiene en cuenta si los residuos que señalan el final de la horquilla están unidos entre sí mediante enlaces de hidrógeno simples o dobles. Desde entonces, Milner-White y Poet propusieron un medio mejorado de clasificación. [3] Las horquillas beta se dividen en cuatro clases distintas, como se muestra en la Figura 1 de la publicación. Cada clase comienza con el menor número posible de residuos de bucle y aumenta progresivamente el tamaño del bucle eliminando los enlaces de hidrógeno en la lámina beta. La horquilla primaria de la clase 1 es un bucle de un residuo donde los residuos unidos comparten dos enlaces de hidrógeno. Un enlace de hidrógeno se elimina entonces para crear un bucle de tres residuos, que es la horquilla secundaria de la clase 1. Los residuos unidos de forma simple se cuentan en la secuencia del bucle, pero también señalan el final del bucle, definiendo así esta horquilla como un bucle de tres residuos. Este enlace de hidrógeno simple se elimina entonces para crear la horquilla terciaria; un bucle de cinco residuos con residuos doblemente unidos. Este patrón continúa indefinidamente y define todas las horquillas beta dentro de la clase. La clase 2 sigue el mismo patrón comenzando con un bucle de dos residuos con residuos terminales que comparten dos enlaces de hidrógeno. La clase 3 comienza con un residuo de tres y la clase 4 con un residuo de cuatro. La clase 5 no existe ya que esa horquilla primaria ya está definida en la clase 1. Pi Este esquema de clasificación no solo da cuenta de varios grados de enlace de hidrógeno, sino que también dice algo sobre el comportamiento biológico de la horquilla. Los reemplazos de un solo aminoácido pueden destruir un enlace de hidrógeno particular, pero no desplegarán la horquilla ni cambiarán su clase. Por otra parte, las inserciones y deleciones de aminoácidos tendrán que desplegar y reformar toda la cadena beta para evitar un abultamiento beta en la estructura secundaria. Esto cambiará la clase de la horquilla en el proceso. Como las sustituciones son las mutaciones de aminoácidos más comunes, una proteína podría potencialmente sufrir una conversión sin afectar la funcionalidad de la horquilla beta. [3]
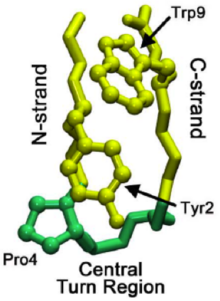

Comprender el mecanismo a través del cual se pliegan los microdominios puede ayudar a arrojar luz sobre los patrones de plegamiento de proteínas completas . Los estudios de una horquilla beta llamada chignolina (ver Chignolina en Proteopedia) han descubierto un proceso de plegamiento escalonado que impulsa el plegamiento de la horquilla beta. Esta horquilla tiene características de secuencia similares a más de 13.000 horquillas conocidas y, por lo tanto, puede servir como un modelo más general para la formación de la horquilla beta. La formación de una región de giro nativo indica que se inicia la cascada de plegamiento, donde un giro nativo es uno que está presente en la estructura plegada final.
En el plegamiento de proteínas en general, el giro puede originarse no en la región del giro nativo sino en la hebra C de la horquilla beta. Este giro luego se propaga a través de la hebra C (la hebra beta que conduce al extremo C) hasta que alcanza la región del giro nativo. A veces, las interacciones de los residuos que conducen a la región del giro nativo son demasiado fuertes, lo que provoca una propagación inversa. Sin embargo, una vez que se forma el giro nativo, las interacciones entre las prolinas y los residuos de triptófano (que se ven en la imagen de la derecha) en la región ayudan a estabilizar el giro, lo que evita el "retroceso" o la disolución.
Los investigadores creen que los giros no se originan en la hebra N, debido a una mayor rigidez (a menudo causada por una prolina que conduce a la región de giro nativa) y menos opciones conformacionales. La formación del giro inicial tiene lugar en aproximadamente 1 μs. Una vez que se ha establecido el giro inicial, se han propuesto dos mecanismos sobre cómo se pliega el resto de la horquilla beta: un colapso hidrofóbico con reordenamientos a nivel de la cadena lateral o el mecanismo más aceptado de tipo cremallera. [4]
El motivo de bucle de horquilla β se puede encontrar en muchas proteínas macromoleculares. Sin embargo, también pueden existir horquillas β pequeñas y simples por sí solas. Para verlo claramente, la proteína del dominio Pin1 se muestra a la izquierda como ejemplo.
Las proteínas ricas en láminas β, también llamadas dominios WW , funcionan adhiriéndose a péptidos ricos en prolina y/o fosforilados para mediar las interacciones proteína-proteína . El "WW" se refiere a dos residuos de triptófano (W) que se conservan dentro de la secuencia y ayudan en el plegamiento de las láminas β para producir un pequeño núcleo hidrofóbico. [5] Estos residuos de triptófano se pueden ver a continuación (derecha) en rojo.
Esta enzima se une a su ligando a través de fuerzas de van der Waals de los triptófanos conservados y las áreas ricas en prolina del ligando. Otros aminoácidos pueden asociarse con el núcleo hidrofóbico de la estructura de la horquilla β para reforzar la unión segura. [6]
También es común encontrar residuos de prolina dentro de la porción de bucle de la horquilla β, ya que este aminoácido es rígido y contribuye a la formación del "giro". Estos residuos de prolina se pueden ver como cadenas laterales rojas en la imagen del dominio WW de Pin1 que aparece a continuación (izquierda).
El diseño de péptidos que adoptan la estructura de horquilla β (sin depender de la unión de metales, aminoácidos inusuales o enlaces cruzados disulfuro) ha logrado un progreso significativo y ha proporcionado conocimientos sobre la dinámica de las proteínas. A diferencia de las hélices α , las horquillas β no se estabilizan mediante un patrón regular de enlaces de hidrógeno. Como resultado, los primeros intentos requerían al menos 20-30 residuos de aminoácidos para lograr pliegues terciarios estables de horquillas β. Sin embargo, este límite inferior se redujo a 12 aminoácidos por las ganancias de estabilidad conferidas por la incorporación de pares de cadenas cruzadas triptófano-triptófano. Se ha demostrado que dos pares de triptófano sin enlaces de hidrógeno se entrelazan en un motivo similar a una cremallera, estabilizando la estructura de la horquilla β al tiempo que le permiten seguir siendo soluble en agua . La estructura de RMN de un péptido β con cremallera de triptófano (trpzip) muestra el efecto estabilizador de las interacciones favorables entre anillos de indol adyacentes . [7]

La síntesis de péptidos de horquilla β de trpzip ha incorporado fotointerruptores que facilitan un control preciso sobre el plegamiento. Varios aminoácidos en el giro son reemplazados por azobenceno , que puede ser inducido a cambiar de la conformación trans a la cis mediante luz a 360 nm. Cuando la fracción de azobenceno está en la conformación cis, los residuos de aminoácidos se alinean correctamente para adoptar una formación de horquilla β. Sin embargo, la conformación trans no tiene una geometría de giro adecuada para la horquilla β. [8] Este fenómeno se puede utilizar para investigar la dinámica conformacional de los péptidos con espectroscopia de absorción de femtosegundos. [8]