Los metales alcalinos están formados por los elementos químicos litio (Li), sodio (Na), potasio (K), [nota 1] rubidio (Rb), cesio (Cs), [nota 2] y francio (Fr). Junto con el hidrógeno constituyen el grupo 1 , [nota 3] que se encuentra en el bloque s de la tabla periódica . Todos los metales alcalinos tienen su electrón más externo en un orbital s : esta configuración electrónica compartida da como resultado que tengan propiedades características muy similares. [nota 4] De hecho, los metales alcalinos proporcionan el mejor ejemplo de tendencias de grupo en propiedades en la tabla periódica, con elementos que exhiben un comportamiento homólogo bien caracterizado . [5] Esta familia de elementos también se conoce como la familia del litio por su elemento principal.
Los metales alcalinos son todos metales brillantes, blandos y altamente reactivos a temperatura y presión estándar y pierden fácilmente su electrón más externo para formar cationes con carga +1. Todos ellos se pueden cortar fácilmente con un cuchillo debido a su suavidad, exponiendo una superficie brillante que se empaña rápidamente en el aire debido a la oxidación por la humedad atmosférica y el oxígeno (y en el caso del litio, el nitrógeno ). Debido a su alta reactividad, deben almacenarse bajo aceite para evitar la reacción con el aire, y se encuentran naturalmente solo en sales y nunca como elementos libres. El cesio, el quinto metal alcalino, es el más reactivo de todos los metales. Todos los metales alcalinos reaccionan con el agua, y los metales alcalinos más pesados reaccionan con más vigor que los más ligeros.
Todos los metales alcalinos descubiertos se encuentran en la naturaleza en forma de compuestos: en orden de abundancia , el sodio es el más abundante, seguido del potasio, el litio, el rubidio, el cesio y, por último, el francio, que es muy raro debido a su altísima radiactividad ; el francio solo se encuentra en trazas diminutas en la naturaleza como un paso intermedio en algunas ramas secundarias oscuras de las cadenas de desintegración natural . Se han realizado experimentos para intentar la síntesis del elemento 119 , que probablemente sea el próximo miembro del grupo; ninguno tuvo éxito. Sin embargo, el ununennio puede no ser un metal alcalino debido a los efectos relativistas , que se predice que tienen una gran influencia en las propiedades químicas de los elementos superpesados ; incluso si resulta ser un metal alcalino, se predice que tendrá algunas diferencias en las propiedades físicas y químicas de sus homólogos más ligeros.
La mayoría de los metales alcalinos tienen muchas aplicaciones diferentes. Una de las aplicaciones más conocidas de los elementos puros es el uso del rubidio y el cesio en los relojes atómicos , de los cuales los relojes atómicos de cesio forman la base del segundo. Una aplicación común de los compuestos de sodio es la lámpara de vapor de sodio , que emite luz de manera muy eficiente. La sal de mesa , o cloruro de sodio, se ha utilizado desde la antigüedad. El litio se utiliza como medicamento psiquiátrico y como ánodo en las baterías de litio . El sodio, el potasio y posiblemente el litio son elementos esenciales , que tienen importantes funciones biológicas como electrolitos , y aunque los otros metales alcalinos no son esenciales, también tienen diversos efectos en el cuerpo, tanto beneficiosos como perjudiciales.

Los compuestos de sodio se conocen desde la antigüedad; la sal ( cloruro de sodio ) ha sido un producto básico importante en las actividades humanas. Si bien la potasa se ha utilizado desde la antigüedad, durante la mayor parte de su historia no se entendió que fuera una sustancia fundamentalmente diferente de las sales minerales de sodio. Georg Ernst Stahl obtuvo evidencia experimental que lo llevó a sugerir la diferencia fundamental entre las sales de sodio y potasio en 1702, [6] y Henri-Louis Duhamel du Monceau pudo demostrar esta diferencia en 1736. [7] La composición química exacta de los compuestos de potasio y sodio, y el estado como elemento químico del potasio y el sodio, no se conocía entonces, y por lo tanto Antoine Lavoisier no incluyó ninguno de los álcalis en su lista de elementos químicos en 1789. [8] [9]
El potasio puro fue aislado por primera vez en 1807 en Inglaterra por Humphry Davy , quien lo derivó de la potasa cáustica (KOH, hidróxido de potasio) mediante el uso de electrólisis de la sal fundida con la recién inventada pila voltaica . Los intentos anteriores de electrólisis de la sal acuosa no tuvieron éxito debido a la extrema reactividad del potasio. [10] : 68 El potasio fue el primer metal que se aisló por electrólisis. [11] Más tarde ese mismo año, Davy informó la extracción de sodio de la sustancia similar soda cáustica (NaOH, lejía) mediante una técnica similar, demostrando que los elementos, y por lo tanto las sales, eran diferentes. [8] [9] [12] [13]

La petalita ( Li Al Si 4 O 10 ) fue descubierta en 1800 por el químico brasileño José Bonifácio de Andrada en una mina en la isla de Utö, Suecia . [14] [15] [16] Sin embargo, no fue hasta 1817 que Johan August Arfwedson , que entonces trabajaba en el laboratorio del químico Jöns Jacob Berzelius , detectó la presencia de un nuevo elemento mientras analizaba el mineral de petalita . [17] [18] Observó que este nuevo elemento formaba compuestos similares a los del sodio y el potasio, aunque su carbonato e hidróxido eran menos solubles en agua y más alcalinos que los otros metales alcalinos. [19] Berzelius le dio al material desconocido el nombre de lithion / lithina , de la palabra griega λιθoς (transcrita como lithos , que significa "piedra"), para reflejar su descubrimiento en un mineral sólido, a diferencia del potasio, que se había descubierto en cenizas de plantas, y el sodio, que era conocido en parte por su alta abundancia en la sangre animal. Llamó al metal dentro del material litio . [20] [15] [18] El litio, el sodio y el potasio fueron parte del descubrimiento de la periodicidad , ya que se encuentran entre una serie de tríadas de elementos en el mismo grupo que Johann Wolfgang Döbereiner señaló en 1850 como poseedores de propiedades similares. [21]

El rubidio y el cesio fueron los primeros elementos que se descubrieron utilizando el espectroscopio , inventado en 1859 por Robert Bunsen y Gustav Kirchhoff . [22] Al año siguiente, descubrieron el cesio en el agua mineral de Bad Dürkheim , Alemania. Su descubrimiento del rubidio se produjo al año siguiente en Heidelberg , Alemania, al encontrarlo en el mineral lepidolita . [23] Los nombres de rubidio y cesio provienen de las líneas más prominentes en sus espectros de emisión : una línea roja brillante para el rubidio (de la palabra latina rubidus , que significa rojo oscuro o rojo brillante), y una línea azul cielo para el cesio (derivada de la palabra latina caesius , que significa azul cielo). [24] [25]
Alrededor de 1865, John Newlands produjo una serie de artículos en los que enumeraba los elementos en orden creciente de peso atómico y propiedades físicas y químicas similares que se repetían a intervalos de ocho; comparó dicha periodicidad con las octavas de la música, donde las notas separadas por una octava tienen funciones musicales similares. [26] [27] Su versión juntó en un grupo a todos los metales alcalinos conocidos entonces (del litio al cesio), así como al cobre, la plata y el talio (que muestran el estado de oxidación +1 característico de los metales alcalinos). Su tabla colocó al hidrógeno con los halógenos . [21]

Después de 1869, Dmitri Mendeleev propuso su tabla periódica colocando al litio en la parte superior de un grupo con sodio, potasio, rubidio, cesio y talio. [28] Dos años después, Mendeleev revisó su tabla, colocando el hidrógeno en el grupo 1 por encima del litio, y también moviendo el talio al grupo del boro . En esta versión de 1871, el cobre, la plata y el oro se colocaron dos veces, una como parte del grupo IB y otra como parte de un "grupo VIII" que abarca los grupos actuales 8 a 11. [29] [nota 5] Después de la introducción de la tabla de 18 columnas, los elementos del grupo IB se movieron a su posición actual en el bloque d , mientras que los metales alcalinos se dejaron en el grupo IA . Más tarde, el nombre del grupo se cambió a grupo 1 en 1988. [4] El nombre trivial "metales alcalinos" proviene del hecho de que los hidróxidos de los elementos del grupo 1 son todos álcalis fuertes cuando se disuelven en agua. [5]
Hubo al menos cuatro descubrimientos erróneos e incompletos [30] [31] [32] [33] antes de que Marguerite Perey del Instituto Curie en París, Francia, descubriera el francio en 1939 al purificar una muestra de actinio-227 , que se había informado que tenía una energía de desintegración de 220 keV . Sin embargo, Perey notó partículas de desintegración con un nivel de energía por debajo de los 80 keV. Perey pensó que esta actividad de desintegración podría haber sido causada por un producto de desintegración no identificado previamente, uno que se separó durante la purificación, pero emergió nuevamente del actinio -227 puro. Varias pruebas eliminaron la posibilidad de que el elemento desconocido fuera torio , radio , plomo, bismuto o talio . El nuevo producto exhibió propiedades químicas de un metal alcalino (como coprecipitar con sales de cesio), lo que llevó a Perey a creer que era el elemento 87, causado por la desintegración alfa del actinio-227. [34] Luego, Perey intentó determinar la proporción de desintegración beta y alfa en el actinio-227. Su primera prueba estimó que la ramificación alfa era del 0,6%, cifra que luego revisó al 1%. [35]
El siguiente elemento por debajo del francio ( eka -francio) en la tabla periódica sería el ununennio (Uue), elemento 119. [36] : 1729–1730 La síntesis del ununennio se intentó por primera vez en 1985 bombardeando un objetivo de einstenio -254 con iones de calcio -48 en el acelerador superHILAC en el Laboratorio Nacional Lawrence Berkeley en Berkeley, California. No se identificaron átomos, lo que llevó a un rendimiento límite de 300 nb . [37] [38]
Es muy poco probable [37] que esta reacción pueda crear átomos de ununennio en un futuro cercano, dada la extremadamente difícil tarea de producir cantidades suficientes de einstenio-254, que es el preferido para la producción de elementos ultrapesados debido a su gran masa, vida media relativamente larga de 270 días y disponibilidad en cantidades significativas de varios microgramos, [39] para hacer un objetivo lo suficientemente grande como para aumentar la sensibilidad del experimento al nivel requerido; el einstenio no se ha encontrado en la naturaleza y solo se ha producido en laboratorios, y en cantidades menores a las necesarias para la síntesis efectiva de elementos superpesados. Sin embargo, dado que el ununennio es solo el primer elemento del período 8 en la tabla periódica extendida , es muy posible que se descubra en un futuro cercano a través de otras reacciones y, de hecho, actualmente se está intentando sintetizarlo en Japón. [40] Actualmente, ninguno de los elementos del período 8 ha sido descubierto todavía, y también es posible, debido a las inestabilidades de goteo , que solo los elementos del período 8 inferior, hasta alrededor del elemento 128, sean físicamente posibles. [41] [42] No se han realizado intentos de síntesis para ningún metal alcalino más pesado: debido a su número atómico extremadamente alto, requerirían métodos y tecnología nuevos y más poderosos para fabricarlos. [36] : 1737–1739

La regla de Oddo-Harkins sostiene que los elementos con números atómicos pares son más comunes que aquellos con números atómicos impares, con la excepción del hidrógeno. Esta regla sostiene que los elementos con números atómicos impares tienen un protón desapareado y tienen más probabilidades de capturar otro, aumentando así su número atómico. En los elementos con números atómicos pares, los protones están apareados, y cada miembro del par compensa el espín del otro, lo que mejora la estabilidad. [44] [45] [46] Todos los metales alcalinos tienen números atómicos impares y no son tan comunes como los elementos con números atómicos pares adyacentes a ellos (los gases nobles y los metales alcalinotérreos ) en el Sistema Solar. Los metales alcalinos más pesados también son menos abundantes que los más ligeros, ya que los metales alcalinos a partir del rubidio solo pueden sintetizarse en supernovas y no en la nucleosíntesis estelar . El litio también es mucho menos abundante que el sodio y el potasio, ya que se sintetiza de forma deficiente tanto en la nucleosíntesis del Big Bang como en las estrellas: el Big Bang solo pudo producir trazas de litio, berilio y boro debido a la ausencia de un núcleo estable con 5 u 8 nucleones , y la nucleosíntesis estelar solo pudo superar este cuello de botella mediante el proceso triple alfa , fusionando tres núcleos de helio para formar carbono y saltándose esos tres elementos. [43]

La Tierra se formó a partir de la misma nube de materia que formó el Sol, pero los planetas adquirieron composiciones diferentes durante la formación y evolución del sistema solar . A su vez, la historia natural de la Tierra provocó que partes de este planeta tuvieran diferentes concentraciones de los elementos. La masa de la Tierra es de aproximadamente 5,98 × 1024 kg. Está compuesta principalmente de hierro (32,1%), oxígeno (30,1%), silicio (15,1%), magnesio (13,9%), azufre (2,9%), níquel (1,8%), calcio (1,5%) y aluminio (1,4%); y el 1,2% restante consiste en trazas de otros elementos. Debido a la diferenciación planetaria , se cree que la región central está compuesta principalmente de hierro (88,8%), con cantidades más pequeñas de níquel (5,8%), azufre (4,5%) y menos del 1% de oligoelementos. [47]
Los metales alcalinos, debido a su alta reactividad, no se encuentran en forma pura en la naturaleza. Son litófilos y, por lo tanto, permanecen cerca de la superficie de la Tierra porque se combinan fácilmente con el oxígeno y, por lo tanto, se asocian fuertemente con el sílice , formando minerales de densidad relativamente baja que no se hunden en el núcleo de la Tierra. El potasio, el rubidio y el cesio también son elementos incompatibles debido a sus grandes radios iónicos . [48]
El sodio y el potasio son muy abundantes en la Tierra, y ambos se encuentran entre los diez elementos más comunes en la corteza terrestre ; [49] [50] el sodio constituye aproximadamente el 2,6% de la corteza terrestre medida en peso, lo que lo convierte en el sexto elemento más abundante en general [51] y el metal alcalino más abundante. El potasio constituye aproximadamente el 1,5% de la corteza terrestre y es el séptimo elemento más abundante. [51] El sodio se encuentra en muchos minerales diferentes, de los cuales el más común es la sal común (cloruro de sodio), que se encuentra en grandes cantidades disuelta en el agua de mar. Otros depósitos sólidos incluyen halita , anfíbol , criolita , nitratina y zeolita . [51] Muchos de estos depósitos sólidos se producen como resultado de la evaporación de antiguos mares, lo que todavía ocurre ahora en lugares como el Gran Lago Salado de Utah y el Mar Muerto . [10] : 69 A pesar de su abundancia casi igual en la corteza terrestre, el sodio es mucho más común que el potasio en el océano, tanto porque el mayor tamaño del potasio hace que sus sales sean menos solubles, como porque el potasio está ligado por los silicatos en el suelo y lo que el potasio se lixivia es absorbido mucho más fácilmente por la vida vegetal que el sodio. [10] : 69
A pesar de su similitud química, el litio no suele presentarse junto con el sodio o el potasio debido a su menor tamaño. [10] : 69 Debido a su reactividad relativamente baja, se puede encontrar en el agua de mar en grandes cantidades; se estima que la concentración de litio en el agua de mar es de aproximadamente 0,14 a 0,25 partes por millón (ppm) [52] [53] o 25 micromolar . [54] Su relación diagonal con el magnesio a menudo le permite reemplazar al magnesio en minerales de ferromagnesio, donde su concentración en la corteza es de aproximadamente 18 ppm , comparable a la del galio y el niobio . Comercialmente, el mineral de litio más importante es la espodumena , que se encuentra en grandes depósitos en todo el mundo. [10] : 69
El rubidio es aproximadamente tan abundante como el zinc y más abundante que el cobre. Se encuentra de forma natural en los minerales leucita , polucita , carnalita , zinnwaldita y lepidolita , [55] aunque ninguno de ellos contiene solo rubidio y ningún otro metal alcalino. [10] : 70 El cesio es más abundante que algunos elementos comúnmente conocidos, como el antimonio , el cadmio , el estaño y el tungsteno , pero es mucho menos abundante que el rubidio. [56]
El francio-223 , el único isótopo natural del francio, [57] [58] es el producto de la desintegración alfa del actinio-227 y se puede encontrar en cantidades traza en minerales de uranio . [59] En una muestra dada de uranio, se estima que hay solo un átomo de francio por cada 10 18 átomos de uranio. [60] [61] Se ha calculado que hay como máximo 30 gramos de francio en la corteza terrestre en cualquier momento, debido a su vida media extremadamente corta de 22 minutos. [62] [63]
Las propiedades físicas y químicas de los metales alcalinos se pueden explicar fácilmente por tener una configuración electrónica de valencia ns 1 , lo que da como resultado un enlace metálico débil . Por lo tanto, todos los metales alcalinos son blandos y tienen densidades bajas , [5] puntos de fusión [5] y ebullición , [5] así como calores de sublimación , vaporización y disociación . [10] : 74 Todos ellos cristalizan en la estructura cristalina cúbica centrada en el cuerpo , [10] : 73 y tienen colores de llama distintivos porque su electrón s externo se excita muy fácilmente. [10] : 75 De hecho, estos colores de prueba de llama son la forma más común de identificarlos ya que todas sus sales con iones comunes son solubles. [10] : 75 La configuración ns 1 también da como resultado que los metales alcalinos tengan radios atómicos e iónicos muy grandes , así como una conductividad térmica y eléctrica muy alta . [10] : 75 Su química está dominada por la pérdida de su único electrón de valencia en el orbital s más externo para formar el estado de oxidación +1, debido a la facilidad de ionizar este electrón y la muy alta segunda energía de ionización. [10] : 76 La mayor parte de la química se ha observado solo para los primeros cinco miembros del grupo. La química del francio no está bien establecida debido a su extrema radiactividad ; [5] por lo tanto, la presentación de sus propiedades aquí es limitada. Lo poco que se sabe sobre el francio muestra que tiene un comportamiento muy cercano al cesio, como se esperaba. Las propiedades físicas del francio son aún más esquemáticas porque el elemento en masa nunca se ha observado; por lo tanto, cualquier dato que pueda encontrarse en la literatura son ciertamente extrapolaciones especulativas. [64]
Los metales alcalinos son más similares entre sí que los elementos de cualquier otro grupo entre sí. [5] De hecho, la similitud es tan grande que es bastante difícil separar el potasio, el rubidio y el cesio, debido a sus radios iónicos similares ; el litio y el sodio son más distintos. Por ejemplo, al moverse hacia abajo en la tabla, todos los metales alcalinos conocidos muestran un radio atómico creciente , [71] una electronegatividad decreciente , [71] una reactividad creciente , [5] y puntos de fusión y ebullición decrecientes [71] así como calores de fusión y vaporización. [10] : 75 En general, sus densidades aumentan al moverse hacia abajo en la tabla, con la excepción de que el potasio es menos denso que el sodio. [71] Una de las pocas propiedades de los metales alcalinos que no muestra una tendencia muy suave es su potencial de reducción : el valor del litio es anómalo, siendo más negativo que los otros. [10] : 75 Esto se debe a que el ion Li + tiene una energía de hidratación muy alta en la fase gaseosa: aunque el ion litio altera significativamente la estructura del agua, causando un mayor cambio en la entropía, esta alta energía de hidratación es suficiente para hacer que los potenciales de reducción lo indiquen como el metal alcalino más electropositivo, a pesar de la dificultad de ionizarlo en la fase gaseosa. [10] : 75
Los metales alcalinos estables son todos metales de color plateado, excepto el cesio, que tiene un tinte dorado pálido: [72] es uno de los tres únicos metales que están claramente coloreados (los otros dos son el cobre y el oro). [10] : 74 Además, los metales alcalinotérreos pesados calcio , estroncio y bario , así como los lantánidos divalentes europio e iterbio , son de color amarillo pálido, aunque el color es mucho menos prominente que el del cesio. [10] : 74 Su brillo se empaña rápidamente en el aire debido a la oxidación. [5]
Todos los metales alcalinos son altamente reactivos y nunca se encuentran en formas elementales en la naturaleza. [20] Debido a esto, generalmente se almacenan en aceite mineral o queroseno (aceite de parafina). [73] Reaccionan agresivamente con los halógenos para formar los haluros de metales alcalinos , que son compuestos cristalinos iónicos blancos que son todos solubles en agua excepto el fluoruro de litio (LiF). [5] Los metales alcalinos también reaccionan con el agua para formar hidróxidos fuertemente alcalinos y, por lo tanto, deben manipularse con mucho cuidado. Los metales alcalinos más pesados reaccionan más vigorosamente que los más ligeros; por ejemplo, cuando se deja caer en agua, el cesio produce una explosión mayor que el potasio si se usa el mismo número de moles de cada metal. [5] [74] [56] Los metales alcalinos tienen las energías de primera ionización más bajas en sus respectivos períodos de la tabla periódica [64] debido a su baja carga nuclear efectiva [5] y la capacidad de alcanzar una configuración de gas noble perdiendo solo un electrón . [5] Los metales alcalinos no sólo reaccionan con el agua, sino también con donantes de protones como los alcoholes y fenoles , el amoníaco gaseoso y los alquinos , estos últimos demostrando el fenomenal grado de su reactividad. Su gran poder como agentes reductores los hace muy útiles para liberar otros metales de sus óxidos o haluros. [10] : 76
La segunda energía de ionización de todos los metales alcalinos es muy alta [5] [64] ya que está en una capa completa que también está más cerca del núcleo; [5] por lo tanto, casi siempre pierden un solo electrón, formando cationes. [10] : 28 Los álcalis son una excepción: son compuestos inestables que contienen metales alcalinos en un estado de oxidación −1, lo cual es muy inusual ya que antes del descubrimiento de los álcalis, no se esperaba que los metales alcalinos pudieran formar aniones y se pensaba que podían aparecer en sales solo como cationes. Los aniones de álcali tienen subcapas s llenas , lo que les da suficiente estabilidad para existir. Se sabe que todos los metales alcalinos estables excepto el litio pueden formar álcalis, [75] [76] [77] y los álcalis tienen mucho interés teórico debido a su estequiometría inusual y bajos potenciales de ionización . Los álcalis son químicamente similares a los electruros , que son sales con electrones atrapados que actúan como aniones. [78] Un ejemplo particularmente llamativo de un álcali es el " hidruro de sodio inverso ", H + Na − (ambos iones están complejados ), a diferencia del hidruro de sodio habitual, Na + H − : [79] es inestable en aislamiento, debido a su alta energía resultante del desplazamiento de dos electrones del hidrógeno al sodio, aunque se predice que varios derivados serán metaestables o estables. [79] [80]
En solución acuosa, los iones de metales alcalinos forman iones de agua de fórmula [M(H 2 O) n ] + , donde n es el número de solvatación. Sus números de coordinación y formas concuerdan bien con los esperados a partir de sus radios iónicos. En solución acuosa, se dice que las moléculas de agua unidas directamente al ion metálico pertenecen a la primera esfera de coordinación , también conocida como primera capa de solvatación o primaria. El enlace entre una molécula de agua y el ion metálico es un enlace covalente dativo , en el que el átomo de oxígeno dona ambos electrones al enlace. Cada molécula de agua coordinada puede estar unida por enlaces de hidrógeno a otras moléculas de agua. Se dice que estas últimas residen en la segunda esfera de coordinación. Sin embargo, para los cationes de metales alcalinos, la segunda esfera de coordinación no está bien definida ya que la carga +1 en el catión no es lo suficientemente alta como para polarizar las moléculas de agua en la capa de solvatación primaria lo suficiente como para que formen fuertes enlaces de hidrógeno con las de la segunda esfera de coordinación, produciendo una entidad más estable. [81] [82] : 25 Se ha determinado experimentalmente que el número de solvatación para Li + es 4, formando el tetraédrico [Li(H 2 O) 4 ] + : mientras que se han encontrado números de solvatación de 3 a 6 para iones de litio-agua, los números de solvatación menores de 4 pueden ser el resultado de la formación de pares de iones de contacto , y los números de solvatación más altos pueden interpretarse en términos de moléculas de agua que se aproximan a [Li(H 2 O) 4 ] + a través de una cara del tetraedro, aunque las simulaciones de dinámica molecular pueden indicar la existencia de un ion hexaaqua octaédrico . También hay probablemente seis moléculas de agua en la esfera de solvatación primaria del ion sodio, formando el ion octaédrico [Na(H 2 O) 6 ] + . [65] [82] : 126–127 Si bien anteriormente se pensaba que los metales alcalinos más pesados también formaban iones hexaaqua octaédricos, desde entonces se ha descubierto que el potasio y el rubidio probablemente forman los iones [K(H 2 O) 8 ] + y [Rb(H 2 O) 8 ] + , que tienen la estructura antiprismática cuadrada , y que el cesio forma el ion [Cs(H 2 O) 12 ] + de 12 coordenadas . [83]
La química del litio muestra varias diferencias con la del resto del grupo, ya que el pequeño catión Li + polariza los aniones y da a sus compuestos un carácter más covalente . [5] El litio y el magnesio tienen una relación diagonal debido a sus radios atómicos similares, [5] por lo que muestran algunas similitudes. Por ejemplo, el litio forma un nitruro estable , una propiedad común entre todos los metales alcalinotérreos (grupo del magnesio) pero única entre los metales alcalinos. [84] Además, entre sus respectivos grupos, solo el litio y el magnesio forman compuestos organometálicos con un carácter covalente significativo (por ejemplo, LiMe y MgMe 2 ). [85]
El fluoruro de litio es el único haluro de metal alcalino que es poco soluble en agua, [5] y el hidróxido de litio es el único hidróxido de metal alcalino que no es delicuescente . [5] Por el contrario, el perclorato de litio y otras sales de litio con aniones grandes que no se pueden polarizar son mucho más estables que los compuestos análogos de los otros metales alcalinos, probablemente porque Li + tiene una alta energía de solvatación . [10] : 76 Este efecto también significa que la mayoría de las sales de litio simples se encuentran comúnmente en forma hidratada, porque las formas anhidras son extremadamente higroscópicas : esto permite que sales como el cloruro de litio y el bromuro de litio se utilicen en deshumidificadores y acondicionadores de aire . [10] : 76
También se prevé que el francio presente algunas diferencias debido a su elevado peso atómico , lo que hace que sus electrones viajen a fracciones considerables de la velocidad de la luz y, por tanto, que los efectos relativistas sean más prominentes. En contraste con la tendencia a la disminución de las electronegatividades y las energías de ionización de los metales alcalinos, se prevé que la electronegatividad y la energía de ionización del francio sean mayores que las del cesio debido a la estabilización relativista de los electrones 7s; además, se espera que su radio atómico sea anormalmente bajo. Por tanto, contrariamente a lo esperado, el cesio es el más reactivo de los metales alcalinos, no el francio. [67] [36] : 1729 [86] Todas las propiedades físicas conocidas del francio también se desvían de las tendencias claras que van del litio al cesio, como la primera energía de ionización, la afinidad electrónica y la polarizabilidad de los aniones, aunque debido a la escasez de datos conocidos sobre el francio, muchas fuentes dan valores extrapolados, ignorando que los efectos relativistas hacen que la tendencia del litio al cesio se vuelva inaplicable en el francio. [86] Algunas de las pocas propiedades del francio que se han predicho teniendo en cuenta la relatividad son la afinidad electrónica (47,2 kJ/mol) [87] y la entalpía de disociación de la molécula Fr 2 (42,1 kJ/mol). [88] La molécula de CsFr está polarizada como Cs + Fr − , lo que demuestra que la subcapa 7s del francio se ve mucho más afectada por los efectos relativistas que la subcapa 6s del cesio. [86] Además, se espera que el superóxido de francio (FrO 2 ) tenga un carácter covalente significativo, a diferencia de los otros superóxidos de metales alcalinos, debido a las contribuciones de enlace de los electrones 6p del francio. [86]
Todos los metales alcalinos tienen números atómicos impares; por lo tanto, sus isótopos deben ser impares-impares (tanto el número de protones como el de neutrones son impares) o impares-pares ( el número de protones es impar, pero el número de neutrones es par). Los núcleos impares-impares tienen números de masa pares , mientras que los núcleos impares-pares tienen números de masa impares. Los nucleidos primordiales impares-impares son raros porque la mayoría de los núcleos impares-impares son altamente inestables con respecto a la desintegración beta , porque los productos de desintegración son pares-pares y, por lo tanto, están más fuertemente unidos, debido a los efectos de apareamiento nuclear . [89]
Debido a la gran rareza de los núcleos impar-impar, casi todos los isótopos primordiales de los metales alcalinos son impares-pares (las excepciones son el isótopo estable a la luz litio-6 y el radioisótopo de larga vida potasio-40). Para un número másico impar dado, solo puede haber un único nucleido beta-estable , ya que no hay una diferencia en la energía de enlace entre par-impar e impar-par comparable a la que hay entre par-par e impar-impar, lo que deja a otros nucleidos del mismo número másico ( isóbaros ) libres para la desintegración beta hacia el nucleido de menor masa. Un efecto de la inestabilidad de un número impar de cualquier tipo de nucleones es que los elementos de número impar, como los metales alcalinos, tienden a tener menos isótopos estables que los elementos de número par. De los 26 elementos monoisotópicos que tienen un solo isótopo estable, todos menos uno tienen un número atómico impar y todos menos uno también tienen un número par de neutrones. El berilio es la única excepción a ambas reglas, debido a su bajo número atómico. [89]
Todos los metales alcalinos excepto el litio y el cesio tienen al menos un radioisótopo natural : el sodio-22 y el sodio-24 son radioisótopos traza producidos cosmogénicamente , [90] el potasio-40 y el rubidio-87 tienen vidas medias muy largas y por lo tanto ocurren naturalmente, [91] y todos los isótopos del francio son radiactivos . [91] También se pensaba que el cesio era radiactivo a principios del siglo XX, [92] [93] aunque no tiene radioisótopos naturales. [91] (El francio aún no se había descubierto en ese momento). El radioisótopo natural de larga vida del potasio, el potasio-40, constituye aproximadamente el 0,012% del potasio natural, [94] y, por lo tanto, el potasio natural es débilmente radiactivo. Esta radiactividad natural se convirtió en la base para una afirmación errónea del descubrimiento del elemento 87 (el siguiente metal alcalino después del cesio) en 1925. [30] [31] El rubidio natural es de manera similar ligeramente radiactivo, con un 27,83% del radioisótopo de larga duración rubidio-87. [10] : 74
El cesio-137 , con una vida media de 30,17 años, es uno de los dos principales productos de fisión de vida media , junto con el estroncio-90 , que son responsables de la mayor parte de la radiactividad del combustible nuclear gastado después de varios años de enfriamiento, hasta varios cientos de años después de su uso. Constituye la mayor parte de la radiactividad que aún queda del accidente de Chernóbil . El cesio-137 sufre una desintegración beta de alta energía y finalmente se convierte en bario-137 estable . Es un fuerte emisor de radiación gamma. El cesio-137 tiene una tasa muy baja de captura de neutrones y no se puede eliminar de esta manera, sino que se debe permitir que se descomponga. [95] El cesio-137 se ha utilizado como trazador en estudios hidrológicos, de forma análoga al uso del tritio . [96] Pequeñas cantidades de cesio-134 y cesio-137 fueron liberadas al medio ambiente durante casi todas las pruebas de armas nucleares y algunos accidentes nucleares , más notablemente el accidente de Goiânia y el desastre de Chernóbil . A partir de 2005, el cesio-137 es la principal fuente de radiación en la zona de alienación alrededor de la planta de energía nuclear de Chernóbil . [97] Sus propiedades químicas como uno de los metales alcalinos lo convierten en uno de los productos de fisión de vida corta a media más problemáticos porque se mueve y se propaga fácilmente en la naturaleza debido a la alta solubilidad en agua de sus sales, y es absorbido por el cuerpo, que lo confunde con sus congéneres esenciales sodio y potasio. [98] : 114
Los metales alcalinos son más similares entre sí que los elementos de cualquier otro grupo entre sí. [5] Por ejemplo, al moverse hacia abajo en la tabla, todos los metales alcalinos conocidos muestran un radio atómico creciente , [71] una electronegatividad decreciente , [71] una reactividad creciente , [5] y puntos de fusión y ebullición decrecientes [71] así como calores de fusión y vaporización. [10] : 75 En general, sus densidades aumentan al moverse hacia abajo en la tabla, con la excepción de que el potasio es menos denso que el sodio. [71]

Los radios atómicos de los metales alcalinos aumentan a medida que se desciende en el grupo. [71] Debido al efecto de protección , cuando un átomo tiene más de una capa electrónica , cada electrón siente repulsión eléctrica de los otros electrones, así como atracción eléctrica del núcleo. [99] En los metales alcalinos, el electrón más externo solo siente una carga neta de +1, ya que parte de la carga nuclear (que es igual al número atómico ) es cancelada por los electrones internos; el número de electrones internos de un metal alcalino es siempre uno menos que la carga nuclear. Por lo tanto, el único factor que afecta al radio atómico de los metales alcalinos es el número de capas electrónicas. Dado que este número aumenta a lo largo del grupo, el radio atómico también debe aumentar a lo largo del grupo. [71]
Los radios iónicos de los metales alcalinos son mucho menores que sus radios atómicos. Esto se debe a que el electrón más externo de los metales alcalinos se encuentra en una capa electrónica diferente a la de los electrones internos y, por lo tanto, cuando se lo elimina, el átomo resultante tiene una capa electrónica menos y es más pequeño. Además, la carga nuclear efectiva ha aumentado y, por lo tanto, los electrones son atraídos con mayor fuerza hacia el núcleo y el radio iónico disminuye. [5]

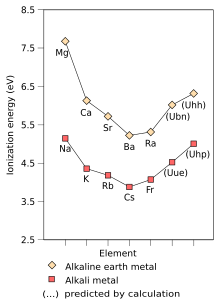
La primera energía de ionización de un elemento o molécula es la energía necesaria para mover el electrón más débilmente sujeto de un mol de átomos gaseosos del elemento o moléculas para formar un mol de iones gaseosos con carga eléctrica +1. Los factores que afectan a la primera energía de ionización son la carga nuclear , la cantidad de protección de los electrones internos y la distancia del electrón más débilmente sujeto al núcleo, que siempre es un electrón externo en los elementos del grupo principal . Los dos primeros factores cambian la carga nuclear efectiva que siente el electrón más débilmente sujeto. Dado que el electrón más externo de los metales alcalinos siempre siente la misma carga nuclear efectiva (+1), el único factor que afecta a la primera energía de ionización es la distancia del electrón más externo al núcleo. Dado que esta distancia aumenta hacia abajo en el grupo, el electrón más externo siente menos atracción desde el núcleo y, por lo tanto, la primera energía de ionización disminuye. [71] Esta tendencia se rompe en el francio debido a la estabilización relativista y la contracción del orbital 7s, lo que acerca el electrón de valencia del francio al núcleo de lo que se esperaría a partir de cálculos no relativistas. Esto hace que el electrón más externo del francio sienta más atracción por el núcleo, lo que aumenta su primera energía de ionización ligeramente más allá de la del cesio. [36] : 1729
La segunda energía de ionización de los metales alcalinos es mucho mayor que la primera, ya que el segundo electrón más débil es parte de una capa de electrones completamente llena y, por lo tanto, es difícil de eliminar. [5]
La reactividad de los metales alcalinos aumenta a medida que se desciende en el grupo. Esto es el resultado de una combinación de dos factores: las energías de primera ionización y las energías de atomización de los metales alcalinos. Debido a que la energía de primera ionización de los metales alcalinos disminuye a medida que se desciende en el grupo, es más fácil que el electrón más externo se retire del átomo y participe en reacciones químicas , aumentando así la reactividad a medida que se desciende en el grupo. La energía de atomización mide la fuerza del enlace metálico de un elemento, que disminuye a medida que los átomos aumentan de radio y, por lo tanto, el enlace metálico debe aumentar en longitud, lo que hace que los electrones deslocalizados se alejen más de la atracción de los núcleos de los metales alcalinos más pesados. La suma de las energías de atomización y primera ionización da una cantidad estrechamente relacionada con (pero no igual a) la energía de activación de la reacción de un metal alcalino con otra sustancia. Esta cantidad disminuye a medida que se desciende en el grupo, y también lo hace la energía de activación; por lo tanto, las reacciones químicas pueden ocurrir más rápido y la reactividad aumenta a medida que se desciende en el grupo. [100]
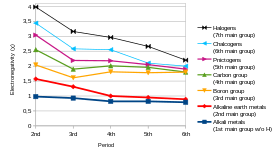
La electronegatividad es una propiedad química que describe la tendencia de un átomo o un grupo funcional a atraer electrones (o densidad electrónica ) hacia sí mismo. [101] Si el enlace entre el sodio y el cloro en el cloruro de sodio fuera covalente , el par de electrones compartidos sería atraído por el cloro porque la carga nuclear efectiva en los electrones externos es +7 en el cloro pero solo es +1 en el sodio. El par de electrones es atraído tan cerca del átomo de cloro que prácticamente se transfieren al átomo de cloro (un enlace iónico ). Sin embargo, si el átomo de sodio fuera reemplazado por un átomo de litio, los electrones no serían atraídos tan cerca del átomo de cloro como antes porque el átomo de litio es más pequeño, lo que hace que el par de electrones sea más fuertemente atraído por la carga nuclear efectiva más cercana del litio. Por lo tanto, los átomos de metales alcalinos más grandes (más abajo en el grupo) serán menos electronegativos ya que el par de enlace es menos fuertemente atraído hacia ellos. Como se mencionó anteriormente, se espera que el francio sea una excepción. [71]
Debido a la mayor electronegatividad del litio, algunos de sus compuestos tienen un carácter más covalente. Por ejemplo, el yoduro de litio (LiI) se disolverá en solventes orgánicos , una propiedad de la mayoría de los compuestos covalentes. [71] El fluoruro de litio (LiF) es el único haluro alcalino que no es soluble en agua, [5] y el hidróxido de litio (LiOH) es el único hidróxido de metal alcalino que no es delicuescente . [5]
El punto de fusión de una sustancia es el punto en el que cambia de estado de sólido a líquido, mientras que el punto de ebullición de una sustancia (en estado líquido) es el punto en el que la presión de vapor del líquido es igual a la presión ambiental que rodea al líquido [102] [103] y todo el líquido cambia de estado a gas. A medida que un metal se calienta hasta su punto de fusión, los enlaces metálicos que mantienen a los átomos en su lugar se debilitan para que los átomos puedan moverse, y los enlaces metálicos finalmente se rompen por completo en el punto de ebullición del metal. [71] [104] Por lo tanto, la caída de los puntos de fusión y ebullición de los metales alcalinos indica que la fuerza de los enlaces metálicos de los metales alcalinos disminuye a lo largo del grupo. [71] Esto se debe a que los átomos de metal se mantienen unidos por la atracción electromagnética de los iones positivos a los electrones deslocalizados. [71] [104] A medida que los átomos aumentan de tamaño al descender en el grupo (debido a que su radio atómico aumenta), los núcleos de los iones se alejan de los electrones deslocalizados y, por lo tanto, el enlace metálico se debilita, de modo que el metal puede fundirse y hervir más fácilmente, reduciendo así los puntos de fusión y ebullición. [71] La mayor carga nuclear no es un factor relevante debido al efecto de blindaje. [71]
Todos los metales alcalinos tienen la misma estructura cristalina ( cúbica centrada en el cuerpo ) [10] y, por lo tanto, los únicos factores relevantes son el número de átomos que pueden caber en un cierto volumen y la masa de uno de los átomos, ya que la densidad se define como masa por unidad de volumen. El primer factor depende del volumen del átomo y, por lo tanto, del radio atómico, que aumenta a medida que se desciende en el grupo; por lo tanto, el volumen de un átomo de metal alcalino aumenta a medida que se desciende en el grupo. La masa de un átomo de metal alcalino también aumenta a medida que se desciende en el grupo. Por lo tanto, la tendencia de las densidades de los metales alcalinos depende de sus pesos atómicos y radios atómicos; si se conocen las cifras de estos dos factores, se pueden calcular las relaciones entre las densidades de los metales alcalinos. La tendencia resultante es que las densidades de los metales alcalinos aumentan a medida que se desciende en la tabla, con una excepción en el potasio. Debido a que tienen el peso atómico más bajo y el radio atómico más grande de todos los elementos en sus períodos, los metales alcalinos son los metales menos densos en la tabla periódica. [71] El litio, el sodio y el potasio son los únicos tres metales de la tabla periódica que son menos densos que el agua: [5] de hecho, el litio es el sólido menos denso conocido a temperatura ambiente . [10] : 75
Los metales alcalinos forman series completas de compuestos con todos los aniones que se encuentran habitualmente, lo que ilustra bien las tendencias de grupo. Estos compuestos pueden describirse como compuestos en los que los metales alcalinos pierden electrones a favor de especies aceptoras y forman iones monopositivos. [10] : 79 Esta descripción es más precisa para los haluros alcalinos y se vuelve cada vez menos precisa a medida que aumentan las cargas catiónicas y aniónicas, y a medida que el anión se hace más grande y más polarizable. Por ejemplo, el enlace iónico da paso al enlace metálico a lo largo de la serie NaCl, Na 2 O, Na 2 S, Na 3 P, Na 3 As, Na 3 Sb, Na 3 Bi, Na. [10] : 81

Todos los metales alcalinos reaccionan vigorosamente o explosivamente con agua fría, produciendo una solución acuosa de un hidróxido de metal alcalino fuertemente básico y liberando gas hidrógeno. [100] Esta reacción se vuelve más vigorosa a medida que desciende en el grupo: el litio reacciona de manera constante con efervescencia , pero el sodio y el potasio pueden encenderse, y el rubidio y el cesio se hunden en el agua y generan gas hidrógeno tan rápidamente que se forman ondas de choque en el agua que pueden romper recipientes de vidrio. [5] Cuando un metal alcalino se deja caer en el agua, produce una explosión, de la cual hay dos etapas separadas. El metal reacciona primero con el agua, rompiendo los enlaces de hidrógeno en el agua y produciendo gas hidrógeno ; esto ocurre más rápido para los metales alcalinos más reactivos y pesados. En segundo lugar, el calor generado por la primera parte de la reacción a menudo enciende el gas hidrógeno, lo que hace que se queme explosivamente en el aire circundante. Esta explosión secundaria de gas hidrógeno produce la llama visible sobre el recipiente con agua, lago u otro cuerpo de agua, no la reacción inicial del metal con el agua (que tiende a ocurrir principalmente bajo el agua). [74] Los hidróxidos de metales alcalinos son los hidróxidos más básicos conocidos. [10] : 87
Investigaciones recientes han sugerido que el comportamiento explosivo de los metales alcalinos en el agua es impulsado por una explosión de Coulomb y no únicamente por la rápida generación de hidrógeno en sí. [105] Todos los metales alcalinos se funden como parte de la reacción con el agua. Las moléculas de agua ionizan la superficie metálica desnuda del metal líquido, dejando una superficie metálica cargada positivamente e iones de agua cargados negativamente. La atracción entre el metal cargado y los iones de agua aumentará rápidamente el área de superficie, causando un aumento exponencial de la ionización. Cuando las fuerzas repulsivas dentro de la superficie del metal líquido exceden las fuerzas de la tensión superficial, explota vigorosamente. [105]
Los hidróxidos en sí son los hidróxidos más básicos conocidos, reaccionan con ácidos para dar sales y con alcoholes para dar alcóxidos oligoméricos . Reaccionan fácilmente con dióxido de carbono para formar carbonatos o bicarbonatos , o con sulfuro de hidrógeno para formar sulfuros o bisulfuros , y pueden usarse para separar tioles del petróleo. Reaccionan con óxidos anfóteros: por ejemplo, los óxidos de aluminio , zinc , estaño y plomo reaccionan con los hidróxidos de metales alcalinos para dar aluminatos, cincatos, estannatos y plumbatos. El dióxido de silicio es ácido y, por lo tanto, los hidróxidos de metales alcalinos también pueden atacar el vidrio de silicato . [10] : 87

Los metales alcalinos forman muchos compuestos intermetálicos entre sí y con los elementos de los grupos 2 al 13 de la tabla periódica de estequiometrías variables, [10] : 81 como las amalgamas de sodio con mercurio , incluyendo Na 5 Hg 8 y Na 3 Hg. [106] Algunas de éstas tienen características iónicas: tomando como ejemplo las aleaciones con oro, el más electronegativo de los metales, NaAu y KAu son metálicos, pero RbAu y CsAu son semiconductores. [10] : 81 NaK es una aleación de sodio y potasio que es muy útil porque es líquida a temperatura ambiente, aunque hay que tomar precauciones debido a su extrema reactividad frente al agua y al aire. La mezcla eutéctica funde a −12,6 °C. [107] Una aleación de 41% de cesio, 47% de sodio y 12% de potasio tiene el punto de fusión más bajo conocido de cualquier metal o aleación, -78 °C. [22]
Los compuestos intermetálicos de los metales alcalinos con los elementos más pesados del grupo 13 (aluminio, galio , indio y talio ), como NaTl, son malos conductores o semiconductores , a diferencia de las aleaciones normales con los elementos anteriores, lo que implica que el metal alcalino involucrado ha perdido un electrón ante los aniones Zintl involucrados. [108] Sin embargo, mientras que los elementos del grupo 14 y posteriores tienden a formar grupos aniónicos discretos, los elementos del grupo 13 tienden a formar iones poliméricos con los cationes de metales alcalinos ubicados entre la red iónica gigante. Por ejemplo, NaTl consiste en un anión polimérico (—Tl − —) n con una estructura cúbica de diamante covalente con iones Na + ubicados entre la red aniónica. Los metales alcalinos más grandes no pueden encajar de manera similar en una red aniónica y tienden a forzar a los elementos más pesados del grupo 13 a formar grupos aniónicos. [109]
El boro es un caso especial, ya que es el único no metal del grupo 13. Los boruros de metales alcalinos tienden a ser ricos en boro, lo que implica un enlace boro-boro apreciable que involucra estructuras deltaédricas , [10] : 147–8 y son térmicamente inestables debido a que los metales alcalinos tienen una presión de vapor muy alta a temperaturas elevadas. Esto hace que la síntesis directa sea problemática porque los metales alcalinos no reaccionan con el boro por debajo de los 700 °C y, por lo tanto, esto debe realizarse en recipientes sellados con el metal alcalino en exceso. Además, excepcionalmente en este grupo, la reactividad con el boro disminuye a medida que avanza el grupo: el litio reacciona completamente a 700 °C, pero el sodio a 900 °C y el potasio no hasta 1200 °C, y la reacción es instantánea para el litio pero lleva horas para el potasio. Los boruros de rubidio y cesio ni siquiera han sido caracterizados. Se conocen varias fases, como LiB 10 , NaB 6 , NaB 15 y KB 6 . [110] [111] Bajo alta presión, el enlace boro-boro en los boruros de litio cambia de seguir las reglas de Wade a formar aniones Zintl como el resto del grupo 13. [112]
El litio y el sodio reaccionan con el carbono para formar acetiluros , Li2C2 y Na2C2 , que también se pueden obtener por reacción del metal con acetileno . El potasio, el rubidio y el cesio reaccionan con el grafito ; sus átomos se intercalan entre las capas hexagonales de grafito, formando compuestos de intercalación de grafito de fórmulas MC 60 (gris oscuro, casi negro), MC 48 (gris oscuro, casi negro), MC 36 (azul), MC 24 (azul acero) y MC 8 (bronce) (M = K, Rb o Cs). Estos compuestos son más de 200 veces más conductores de electricidad que el grafito puro, lo que sugiere que el electrón de valencia del metal alcalino se transfiere a las capas de grafito (por ejemplo, M + C−8). [65] Al calentar KC 8 , la eliminación de átomos de potasio da como resultado la conversión en secuencia a KC 24 , KC 36 , KC 48 y finalmente KC 60 . KC 8 es un agente reductor muy fuerte y es pirofórico y explota al contacto con agua. [113] [114] Mientras que los metales alcalinos más grandes (K, Rb y Cs) forman inicialmente MC 8 , los más pequeños forman inicialmente MC 6 , y de hecho requieren la reacción de los metales con grafito a altas temperaturas alrededor de 500 °C para formarse. [115] Aparte de esto, los metales alcalinos son agentes reductores tan fuertes que incluso pueden reducir el buckminsterfullereno para producir fulleruros sólidos M n C 60 ; El sodio, el potasio, el rubidio y el cesio pueden formar fulleruros donde n = 2, 3, 4 o 6, y el rubidio y el cesio además pueden alcanzar n = 1. [10] : 285
Cuando los metales alcalinos reaccionan con los elementos más pesados del grupo del carbono ( silicio , germanio , estaño y plomo), se forman sustancias iónicas con estructuras tipo jaula, como los siliciuros M 4 Si 4 (M = K, Rb o Cs), que contiene M + y Si tetraédrico .4−4iones. [65] La química de los germanuros de metales alcalinos , que involucra al ion germanuro Ge 4− y otros iones del grupo ( Zintl ) como Ge2−4, En4−9, En2−9, y [(Ge 9 ) 2 ] 6− , es en gran medida análogo al de los siliciuros correspondientes. [10] : 393 Los estanniuros de metales alcalinos son en su mayoría iónicos, a veces con el ion estanniuro ( Sn 4− ), [109] y a veces con iones Zintl más complejos como Sn4−9, que aparece en el nonastanuro tetrapotásico (K 4 Sn 9 ). [116] El ion plumburo monoatómico ( Pb 4− ) es desconocido, y de hecho se predice que su formación es energéticamente desfavorable; los plumburos de metales alcalinos tienen iones Zintl complejos, como Pb4−9Estos germanuros, estanuros y plumbiros de metales alcalinos se pueden producir reduciendo germanio, estaño y plomo con sodio metálico en amoníaco líquido. [10] : 394

El litio, el más ligero de los metales alcalinos, es el único metal alcalino que reacciona con el nitrógeno en condiciones estándar , y su nitruro es el único nitruro de metal alcalino estable. El nitrógeno es un gas no reactivo porque romper el fuerte triple enlace en la molécula de dinitrógeno (N 2 ) requiere mucha energía. La formación de un nitruro de metal alcalino consumiría la energía de ionización del metal alcalino (formando iones M + ), la energía requerida para romper el triple enlace en N 2 y la formación de iones N 3− , y toda la energía liberada de la formación de un nitruro de metal alcalino proviene de la energía reticular del nitruro de metal alcalino. La energía reticular se maximiza con iones pequeños y altamente cargados; los metales alcalinos no forman iones altamente cargados, solo forman iones con una carga de +1, por lo que solo el litio, el metal alcalino más pequeño, puede liberar suficiente energía reticular para hacer que la reacción con el nitrógeno sea exotérmica , formando nitruro de litio . Las reacciones de los otros metales alcalinos con el nitrógeno no liberarían suficiente energía reticular y, por lo tanto, serían endotérmicas , por lo que no forman nitruros en condiciones estándar. [84] El nitruro de sodio (Na 3 N) y el nitruro de potasio (K 3 N), aunque existen, son extremadamente inestables, ya que tienden a descomponerse nuevamente en sus elementos constituyentes y no se pueden producir haciendo reaccionar los elementos entre sí en condiciones estándar. [118] [119] El impedimento estérico prohíbe la existencia de nitruro de rubidio o cesio. [10] : 417 Sin embargo, el sodio y el potasio forman sales de azida incoloras que involucran el N lineal .−3anión; debido al gran tamaño de los cationes de metales alcalinos, son lo suficientemente estables térmicamente como para poder fundirse antes de descomponerse. [10] : 417
Todos los metales alcalinos reaccionan fácilmente con fósforo y arsénico para formar fosfuros y arseniuros con la fórmula M 3 Pn (donde M representa un metal alcalino y Pn representa un pnicógeno : fósforo, arsénico, antimonio o bismuto ). Esto se debe al mayor tamaño de los iones P 3− y As 3− , de modo que se necesita liberar menos energía reticular para que se formen las sales. [65] Estos no son los únicos fosfuros y arseniuros de los metales alcalinos: por ejemplo, el potasio tiene nueve fosfuros conocidos diferentes, con fórmulas K 3 P, K 4 P 3 , K 5 P 4 , KP, K 4 P 6 , K 3 P 7 , K 3 P 11 , KP 10.3 y KP 15 . [120] Mientras que la mayoría de los metales forman arseniuros, solo los metales alcalinos y alcalinotérreos forman principalmente arseniuros iónicos. La estructura de Na 3 As es compleja con distancias Na–Na inusualmente cortas de 328–330 pm que son más cortas que en el metal sodio, y esto indica que incluso con estos metales electropositivos el enlace no puede ser directamente iónico. [10] Se conocen otros arseniuros de metales alcalinos que no se ajustan a la fórmula M 3 As, como LiAs, que tiene un brillo metálico y conductividad eléctrica que indica la presencia de algún enlace metálico . [10] Los antimonuros son inestables y reactivos ya que el ion Sb 3− es un fuerte agente reductor; su reacción con ácidos forma el gas tóxico e inestable estibina (SbH 3 ). [121] De hecho, tienen algunas propiedades metálicas, y los antimonuros de metales alcalinos de estequiometría MSb involucran átomos de antimonio unidos en una estructura espiral de Zintl. [122] Los bismuturos ni siquiera son totalmente iónicos; son compuestos intermetálicos que contienen enlaces parcialmente metálicos y parcialmente iónicos. [123]
Todos los metales alcalinos reaccionan vigorosamente con el oxígeno en condiciones estándar. Forman varios tipos de óxidos, como óxidos simples (que contienen el ion O 2− ), peróxidos (que contienen el ion O2−2ion, donde hay un enlace simple entre los dos átomos de oxígeno), superóxidos (que contienen el O−2ion), y muchos otros. El litio se quema en el aire para formar óxido de litio , pero el sodio reacciona con el oxígeno para formar una mezcla de óxido de sodio y peróxido de sodio . El potasio forma una mezcla de peróxido de potasio y superóxido de potasio , mientras que el rubidio y el cesio forman exclusivamente el superóxido. Su reactividad aumenta a medida que desciende en el grupo: mientras que el litio, el sodio y el potasio simplemente se queman en el aire, el rubidio y el cesio son pirofóricos (se incendian espontáneamente en el aire). [84]
Los metales alcalinos más pequeños tienden a polarizar los aniones más grandes (el peróxido y el superóxido) debido a su pequeño tamaño. Esto atrae los electrones en los aniones más complejos hacia uno de sus átomos de oxígeno constituyentes, formando un ion óxido y un átomo de oxígeno. Esto hace que el litio forme el óxido exclusivamente en la reacción con el oxígeno a temperatura ambiente. Este efecto se vuelve drásticamente más débil para el sodio y el potasio más grandes, lo que les permite formar los peróxidos menos estables. El rubidio y el cesio, en la parte inferior del grupo, son tan grandes que incluso los superóxidos menos estables pueden formarse. Debido a que el superóxido libera la mayor cantidad de energía cuando se forma, el superóxido se forma preferentemente para los metales alcalinos más grandes donde los aniones más complejos no están polarizados. Los óxidos y peróxidos para estos metales alcalinos existen, pero no se forman por reacción directa del metal con el oxígeno en condiciones estándar. [84] Además, el pequeño tamaño de los iones Li + y O 2− contribuye a que formen una estructura reticular iónica estable. Sin embargo, en condiciones controladas, se sabe que todos los metales alcalinos, con excepción del francio, forman sus óxidos, peróxidos y superóxidos. Los peróxidos y superóxidos de metales alcalinos son poderosos agentes oxidantes . El peróxido de sodio y el superóxido de potasio reaccionan con dióxido de carbono para formar carbonato de metal alcalino y gas oxígeno, lo que permite su uso en purificadores de aire submarinos ; la presencia de vapor de agua , presente de forma natural en el aliento, hace que la eliminación de dióxido de carbono por superóxido de potasio sea aún más eficiente. [65] [124] Todos los metales alcalinos estables, excepto el litio, pueden formar ozónidos rojos (MO 3 ) a través de la reacción a baja temperatura del hidróxido anhidro en polvo con ozono : los ozónidos pueden extraerse luego utilizando amoníaco líquido . Se descomponen lentamente en condiciones estándar en superóxidos y oxígeno, y se hidrolizan inmediatamente en hidróxidos cuando entran en contacto con el agua. [10] : 85 El potasio, el rubidio y el cesio también forman sesquióxidos M 2 O 3 , que pueden considerarse mejor como disuperóxidos de peróxido, [(M + ) 4 (O2−2)(Oh−2) 2 ] . [10] : 85
El rubidio y el cesio pueden formar una gran variedad de subóxidos con los metales en estados de oxidación formales por debajo de +1. [10] : 85 El rubidio puede formar Rb 6 O y Rb 9 O 2 (de color cobre) tras la oxidación en el aire, mientras que el cesio forma una inmensa variedad de óxidos, como el ozónido CsO 3 [125] [126] y varios subóxidos de colores brillantes , [127] como Cs 7 O (bronce), Cs 4 O (rojo violeta), Cs 11 O 3 (violeta), Cs 3 O (verde oscuro), [128] CsO, Cs 3 O 2 , [129] así como Cs 7 O 2 . [130] [131] El último de estos puede calentarse al vacío para generar Cs 2 O. [56]
Los metales alcalinos también pueden reaccionar de forma análoga con los calcógenos más pesados ( azufre , selenio , telurio y polonio ), y todos los calcogenuros de metales alcalinos son conocidos (con excepción del francio). La reacción con un exceso de calcógeno puede dar como resultado de forma similar calcogenuros inferiores, con iones de calcógeno que contienen cadenas de los átomos de calcógeno en cuestión. Por ejemplo, el sodio puede reaccionar con azufre para formar el sulfuro ( Na 2 S ) y varios polisulfuros con la fórmula Na 2 S x ( x de 2 a 6), que contienen el S2−
x[65] Debido a la basicidad de los iones Se 2− y Te 2− , los seleniuros y telururos de metales alcalinos son alcalinos en solución; cuando reaccionan directamente con selenio y telurio, se forman poliseleniuros y politelururos de metales alcalinos junto con los seleniuros y telururos con el Se2−
xy Te2−
xiones. [132] Se pueden obtener directamente de los elementos en amoníaco líquido o cuando no hay aire presente, y son compuestos incoloros, solubles en agua que el aire oxida rápidamente de nuevo a selenio o telurio. [10] : 766 Los poloniuros de metales alcalinos son todos compuestos iónicos que contienen el ion Po 2− ; son muy estables químicamente y se pueden producir por reacción directa de los elementos a alrededor de 300–400 °C. [10] : 766 [133] [134]
Los metales alcalinos se encuentran entre los elementos más electropositivos de la tabla periódica y, por lo tanto, tienden a unirse iónicamente a los elementos más electronegativos de la tabla periódica, los halógenos ( flúor , cloro , bromo , yodo y astato ), formando sales conocidas como haluros de metales alcalinos. La reacción es muy vigorosa y, a veces, puede provocar explosiones. [10] : 76 Se conocen los veinte haluros de metales alcalinos estables; los inestables no se conocen, con la excepción del astaturo de sodio, debido a la gran inestabilidad y rareza del astato y el francio. El más conocido de los veinte es sin duda el cloruro de sodio , también conocido como sal común. Todos los haluros de metales alcalinos estables tienen la fórmula MX donde M es un metal alcalino y X es un halógeno. Todos son sólidos cristalinos iónicos blancos que tienen altos puntos de fusión. [5] [84] Todos los haluros de metales alcalinos son solubles en agua excepto el fluoruro de litio (LiF), que es insoluble en agua debido a su altísima entalpía reticular . La elevada entalpía reticular del fluoruro de litio se debe a los pequeños tamaños de los iones Li + y F− , lo que hace que las interacciones electrostáticas entre ellos sean fuertes: [5] un efecto similar ocurre con el fluoruro de magnesio , en consonancia con la relación diagonal entre el litio y el magnesio. [10] : 76
Los metales alcalinos también reaccionan de manera similar con el hidrógeno para formar hidruros de metales alcalinos iónicos, donde el anión hidruro actúa como un pseudohaluro : estos a menudo se usan como agentes reductores, produciendo hidruros, hidruros metálicos complejos o gas hidrógeno. [10] : 83 [65] También se conocen otros pseudohaluros, en particular los cianuros . Estos son isoestructurales a los haluros respectivos excepto el cianuro de litio , lo que indica que los iones de cianuro pueden rotar libremente. [10] : 322 También se conocen óxidos de haluros de metales alcalinos ternarios, como Na 3 ClO, K 3 BrO (amarillo), Na 4 Br 2 O, Na 4 I 2 O y K 4 Br 2 O. [10] : 83 Los polihaluros son bastante inestables, aunque los de rubidio y cesio están muy estabilizados por el débil poder polarizador de estos cationes extremadamente grandes. [10] : 835
Los cationes de metales alcalinos no suelen formar complejos de coordinación con bases de Lewis simples debido a su baja carga de solo +1 y su tamaño relativamente grande; por lo tanto, el ion Li + forma la mayoría de los complejos y los iones de metales alcalinos más pesados forman cada vez menos (aunque ocurren excepciones para complejos débiles). [10] : 90 El litio en particular tiene una química de coordinación muy rica en la que exhibe números de coordinación de 1 a 12, aunque la hexacoordinación octaédrica es su modo preferido. [10] : 90–1 En solución acuosa , los iones de metales alcalinos existen como complejos hexahidratados octaédricos [M(H 2 O) 6 ] + , con la excepción del ion litio, que debido a su pequeño tamaño forma complejos tetraédricos tetrahidratados [Li(H 2 O) 4 ] + ; los metales alcalinos forman estos complejos porque sus iones son atraídos por fuerzas electrostáticas de atracción a las moléculas de agua polares. Debido a esto, las sales anhidras que contienen cationes de metales alcalinos se utilizan a menudo como desecantes . [65] Los metales alcalinos también forman fácilmente complejos con éteres corona (por ejemplo, 12-corona-4 para Li + , 15-corona-5 para Na + , 18-corona-6 para K + y 21-corona-7 para Rb + ) y criptandos debido a la atracción electrostática. [65]
Los metales alcalinos se disuelven lentamente en amoníaco líquido , formando soluciones amoniacales de catión metálico solvatado M + y electrón solvatado e− , que reaccionan para formar gas hidrógeno y la amida de metal alcalino (MNH2 , donde M representa un metal alcalino): esto fue observado por primera vez por Humphry Davy en 1809 y redescubierto por W. Weyl en 1864. El proceso puede acelerarse mediante un catalizador . Soluciones similares se forman con los metales alcalinotérreos divalentes pesados calcio , estroncio , bario , así como los lantánidos divalentes europio e iterbio . La sal de amida es bastante insoluble y precipita fácilmente de la solución, dejando soluciones de amoníaco intensamente coloreadas de los metales alcalinos. En 1907, Charles A. Kraus identificó el color como debido a la presencia de electrones solvatados , que contribuyen a la alta conductividad eléctrica de estas soluciones. En concentraciones bajas (por debajo de 3 M), la solución es azul oscuro y tiene diez veces la conductividad del cloruro de sodio acuoso ; en concentraciones más altas (por encima de 3 M), la solución es de color cobre y tiene aproximadamente la conductividad de metales líquidos como el mercurio . [10] [65] [136] Además de la sal de amida de metal alcalino y los electrones solvatados, estas soluciones de amoníaco también contienen el catión de metal alcalino (M + ), el átomo de metal alcalino neutro (M), moléculas de metal alcalino diatómicas (M 2 ) y aniones de metal alcalino (M − ). Estos son inestables y eventualmente se convierten en la amida de metal alcalino y el gas hidrógeno más estables termodinámicamente. Los electrones solvatados son poderosos agentes reductores y a menudo se utilizan en la síntesis química. [65]
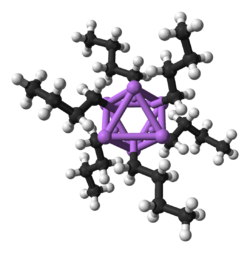
Al ser el metal alcalino más pequeño, el litio forma la variedad más amplia y más estable de compuestos organometálicos , que están unidos covalentemente. Los compuestos de organolitio son sólidos o líquidos volátiles eléctricamente no conductores que se funden a bajas temperaturas y tienden a formar oligómeros con la estructura (RLi) x donde R es el grupo orgánico. Como la naturaleza electropositiva del litio pone la mayor parte de la densidad de carga del enlace en el átomo de carbono, creando efectivamente un carbanión , los compuestos de organolitio son bases y nucleófilos extremadamente poderosos . Para su uso como bases, a menudo se utilizan butillitios y están disponibles comercialmente. Un ejemplo de un compuesto de organolitio es el metillitio ((CH 3 Li) x ), que existe en formas tetraméricas ( x = 4, tetraédrica) y hexaméricas ( x = 6, octaédrica). [65] [140] Los compuestos de organolitio, especialmente el n -butillitio, son reactivos útiles en la síntesis orgánica, como podría esperarse dada la relación diagonal del litio con el magnesio, que desempeña un papel importante en la reacción de Grignard . [10] : 102 Por ejemplo, los alquil-litios y aril-litios pueden usarse para sintetizar aldehídos y cetonas mediante la reacción con carbonilos metálicos . La reacción con níquel-tetracarbonilo , por ejemplo, procede a través de un complejo de acil-níquel-carbonilo inestable que luego sufre una sustitución electrofílica para dar el producto aldehído deseado (usando H + como electrófilo) o cetona (usando un haluro de alquilo). [10] : 105
Los alquil-litios y aril-litios también pueden reaccionar con amidas N , N -disustituidas para dar aldehídos y cetonas, y cetonas simétricas al reaccionar con monóxido de carbono . Se descomponen térmicamente para eliminar un β-hidrógeno, produciendo alquenos e hidruro de litio : otra ruta es la reacción de éteres con alquil- y aril-litios que actúan como bases fuertes. [10] : 105 En disolventes no polares, los aril-litios reaccionan como los carbaniones que efectivamente son, convirtiendo el dióxido de carbono en ácidos carboxílicos aromáticos (ArCO 2 H) y las aril-cetonas en carbinoles terciarios (Ar' 2 C(Ar)OH). Finalmente, pueden usarse para sintetizar otros compuestos organometálicos a través del intercambio metal-halógeno. [10] : 106
A diferencia de los compuestos de organolitio, los compuestos organometálicos de los metales alcalinos más pesados son predominantemente iónicos. La aplicación de compuestos organosódicos en química está limitada en parte debido a la competencia de los compuestos de organolitio , que están disponibles comercialmente y exhiben una reactividad más conveniente. El principal compuesto organosódico de importancia comercial es el ciclopentadienuro de sodio . El tetrafenilborato de sodio también puede clasificarse como un compuesto organosódico ya que en estado sólido el sodio está unido a los grupos arilo. Los compuestos organometálicos de los metales alcalinos superiores son incluso más reactivos que los compuestos organosódicos y de utilidad limitada. Un reactivo notable es la base de Schlosser , una mezcla de n -butillitio y terc -butóxido de potasio . Este reactivo reacciona con el propeno para formar el compuesto alilpotasio (KCH2CHCH2 ) . El cis -2-buteno y el trans - 2 -buteno se equilibran cuando entran en contacto con metales alcalinos. Mientras que la isomerización es rápida con litio y sodio, es lenta con los metales alcalinos más pesados. Los metales alcalinos más pesados también favorecen la conformación estéricamente congestionada. [141] Se han descrito varias estructuras cristalinas de compuestos organopotásicos, estableciéndose que, al igual que los compuestos de sodio, son poliméricos. [142] Los compuestos organosódicos, organopotásicos, organorubidios y organocesiados son en su mayoría iónicos y son insolubles (o casi) en disolventes no polares. [65]
Los derivados de alquilo y arilo del sodio y potasio tienden a reaccionar con el aire. Provocan la escisión de los éteres , generando alcóxidos. A diferencia de los compuestos de alquillitio, los alquilsodios y alquilpotasios no se pueden formar haciendo reaccionar los metales con haluros de alquilo porque se produce el acoplamiento de Wurtz : [122] : 265
Por lo tanto, deben prepararse mediante la reacción de compuestos de alquilmercurio con sodio o potasio metálico en disolventes hidrocarbonados inertes. Mientras que el metilsodio forma tetrámeros como el metillitio, el metilpotasio es más iónico y tiene la estructura de arseniuro de níquel con aniones de metilo discretos y cationes de potasio. [122] : 265
Los metales alcalinos y sus hidruros reaccionan con hidrocarburos ácidos, por ejemplo ciclopentadienos y alquinos terminales, para dar sales. Se utilizan amoníaco líquido, éter o disolventes de hidrocarburos, siendo el más común el tetrahidrofurano . El más importante de estos compuestos es el ciclopentadienuro de sodio , NaC 5 H 5 , un precursor importante de muchos derivados de ciclopentadienilo de metales de transición. [122] : 265 De manera similar, los metales alcalinos reaccionan con ciclooctatetraeno en tetrahidrofurano para dar ciclooctatetraenuros de metales alcalinos ; por ejemplo, el ciclooctatetraenuro dipotásico (K 2 C 8 H 8 ) es un precursor importante de muchos derivados de ciclooctatetraenilo de metales, como el uranoceno . [122] : 266 Los cationes de metales alcalinos grandes y muy débilmente polarizantes pueden estabilizar aniones radicales aromáticos polarizables grandes, como el naftalenuro de sodio verde oscuro , Na + [C 10 H 8 •] − , un fuerte agente reductor. [122] : 266
Al reaccionar con el oxígeno, los metales alcalinos forman óxidos , peróxidos , superóxidos y subóxidos . Sin embargo, los tres primeros son más comunes. La siguiente tabla [143] muestra los tipos de compuestos que se forman en reacción con el oxígeno. El compuesto entre paréntesis representa el producto menor de la combustión.
Los peróxidos de metales alcalinos son compuestos iónicos inestables en agua. El anión peróxido está débilmente unido al catión y se hidroliza, formando enlaces covalentes más fuertes.
Los demás compuestos de oxígeno también son inestables en el agua.
Con el azufre se forman sulfuros y polisulfuros . [145]
Debido a que los sulfuros de metales alcalinos son esencialmente sales de un ácido débil y una base fuerte, forman soluciones básicas.
El litio es el único metal que se combina directamente con el nitrógeno a temperatura ambiente.
El Li3N puede reaccionar con el agua para liberar amoníaco.
Con el hidrógeno, los metales alcalinos forman hidruros salinos que se hidrolizan en agua.
El litio es el único metal que reacciona directamente con el carbono para formar acetiluro de dilitio . El Na y el K pueden reaccionar con el acetileno para formar acetiluros . [146]
Al reaccionar con el agua, generan iones hidróxido y gas hidrógeno . Esta reacción es vigorosa y altamente exotérmica y el hidrógeno resultante puede encenderse en el aire o incluso explotar en el caso del Rb y el Cs. [143]
Los metales alcalinos son muy buenos agentes reductores. Pueden reducir los cationes metálicos menos electropositivos. El titanio se produce industrialmente mediante la reducción del tetracloruro de titanio con Na a 400 °C ( proceso de van Arkel-de Boer ).
Los metales alcalinos reaccionan con derivados halógenos para generar hidrocarburos a través de la reacción de Wurtz .
Alkali metals dissolve in liquid ammonia or other donor solvents like aliphatic amines or hexamethylphosphoramide to give blue solutions. These solutions are believed to contain free electrons.[143]
Due to the presence of solvated electrons, these solutions are very powerful reducing agents used in organic synthesis.

Reaction 1) is known as Birch reduction. Other reductions[143] that can be carried by these solutions are:

Although francium is the heaviest alkali metal that has been discovered, there has been some theoretical work predicting the physical and chemical characteristics of hypothetical heavier alkali metals. Being the first period 8 element, the undiscovered element ununennium (element 119) is predicted to be the next alkali metal after francium and behave much like their lighter congeners; however, it is also predicted to differ from the lighter alkali metals in some properties.[36]: 1729–1730 Its chemistry is predicted to be closer to that of potassium[41] or rubidium[36]: 1729–1730 instead of caesium or francium. This is unusual as periodic trends, ignoring relativistic effects would predict ununennium to be even more reactive than caesium and francium. This lowered reactivity is due to the relativistic stabilisation of ununennium's valence electron, increasing ununennium's first ionisation energy and decreasing the metallic and ionic radii;[41] this effect is already seen for francium.[36]: 1729–1730 This assumes that ununennium will behave chemically as an alkali metal, which, although likely, may not be true due to relativistic effects.[148] The relativistic stabilisation of the 8s orbital also increases ununennium's electron affinity far beyond that of caesium and francium; indeed, ununennium is expected to have an electron affinity higher than all the alkali metals lighter than it. Relativistic effects also cause a very large drop in the polarisability of ununennium.[36]: 1729–1730 On the other hand, ununennium is predicted to continue the trend of melting points decreasing going down the group, being expected to have a melting point between 0 °C and 30 °C.[36]: 1724

The stabilisation of ununennium's valence electron and thus the contraction of the 8s orbital cause its atomic radius to be lowered to 240 pm,[36]: 1729–1730 very close to that of rubidium (247 pm),[5] so that the chemistry of ununennium in the +1 oxidation state should be more similar to the chemistry of rubidium than to that of francium. On the other hand, the ionic radius of the Uue+ ion is predicted to be larger than that of Rb+, because the 7p orbitals are destabilised and are thus larger than the p-orbitals of the lower shells. Ununennium may also show the +3[36]: 1729–1730 and +5 oxidation states,[149] which are not seen in any other alkali metal,[10]: 28 in addition to the +1 oxidation state that is characteristic of the other alkali metals and is also the main oxidation state of all the known alkali metals: this is because of the destabilisation and expansion of the 7p3/2 spinor, causing its outermost electrons to have a lower ionisation energy than what would otherwise be expected.[10]: 28 [36]: 1729–1730 Indeed, many ununennium compounds are expected to have a large covalent character, due to the involvement of the 7p3/2 electrons in the bonding.[86]
Not as much work has been done predicting the properties of the alkali metals beyond ununennium. Although a simple extrapolation of the periodic table (by the Aufbau principle) would put element 169, unhexennium, under ununennium, Dirac-Fock calculations predict that the next element after ununennium with alkali-metal-like properties may be element 165, unhexpentium, which is predicted to have the electron configuration [Og] 5g18 6f14 7d10 8s2 8p1/22 9s1.[36]: 1729–1730 [147] This element would be intermediate in properties between an alkali metal and a group 11 element, and while its physical and atomic properties would be closer to the former, its chemistry may be closer to that of the latter. Further calculations show that unhexpentium would follow the trend of increasing ionisation energy beyond caesium, having an ionisation energy comparable to that of sodium, and that it should also continue the trend of decreasing atomic radii beyond caesium, having an atomic radius comparable to that of potassium.[36]: 1729–1730 However, the 7d electrons of unhexpentium may also be able to participate in chemical reactions along with the 9s electron, possibly allowing oxidation states beyond +1, whence the likely transition metal behaviour of unhexpentium.[36]: 1732–1733 [150] Due to the alkali and alkaline earth metals both being s-block elements, these predictions for the trends and properties of ununennium and unhexpentium also mostly hold quite similarly for the corresponding alkaline earth metals unbinilium (Ubn) and unhexhexium (Uhh).[36]: 1729–1733 Unsepttrium, element 173, may be an even better heavier homologue of ununennium; with a predicted electron configuration of [Usb] 6g1, it returns to the alkali-metal-like situation of having one easily removed electron far above a closed p-shell in energy, and is expected to be even more reactive than caesium.[151][152]
The probable properties of further alkali metals beyond unsepttrium have not been explored yet as of 2019, and they may or may not be able to exist.[147] In periods 8 and above of the periodic table, relativistic and shell-structure effects become so strong that extrapolations from lighter congeners become completely inaccurate. In addition, the relativistic and shell-structure effects (which stabilise the s-orbitals and destabilise and expand the d-, f-, and g-orbitals of higher shells) have opposite effects, causing even larger difference between relativistic and non-relativistic calculations of the properties of elements with such high atomic numbers.[36]: 1732–1733 Interest in the chemical properties of ununennium, unhexpentium, and unsepttrium stems from the fact that they are located close to the expected locations of islands of stability, centered at elements 122 (306Ubb) and 164 (482Uhq).[153][154][155]
Many other substances are similar to the alkali metals in their tendency to form monopositive cations. Analogously to the pseudohalogens, they have sometimes been called "pseudo-alkali metals". These substances include some elements and many more polyatomic ions; the polyatomic ions are especially similar to the alkali metals in their large size and weak polarising power.[156]
The element hydrogen, with one electron per neutral atom, is usually placed at the top of Group 1 of the periodic table because of its electron configuration. But hydrogen is not normally considered to be an alkali metal.[157] Metallic hydrogen, which only exists at very high pressures, is known for its electrical and magnetic properties, not its chemical properties.[158] Under typical conditions, pure hydrogen exists as a diatomic gas consisting of two atoms per molecule (H2);[159] however, the alkali metals form diatomic molecules (such as dilithium, Li2) only at high temperatures, when they are in the gaseous state.[160]
Hydrogen, like the alkali metals, has one valence electron[122] and reacts easily with the halogens,[122] but the similarities mostly end there because of the small size of a bare proton H+ compared to the alkali metal cations.[122] Its placement above lithium is primarily due to its electron configuration.[157] It is sometimes placed above fluorine due to their similar chemical properties, though the resemblance is likewise not absolute.[161]
The first ionisation energy of hydrogen (1312.0 kJ/mol) is much higher than that of the alkali metals.[162][163] As only one additional electron is required to fill in the outermost shell of the hydrogen atom, hydrogen often behaves like a halogen, forming the negative hydride ion, and is very occasionally considered to be a halogen on that basis. (The alkali metals can also form negative ions, known as alkalides, but these are little more than laboratory curiosities, being unstable.)[79][80] An argument against this placement is that formation of hydride from hydrogen is endothermic, unlike the exothermic formation of halides from halogens. The radius of the H− anion also does not fit the trend of increasing size going down the halogens: indeed, H− is very diffuse because its single proton cannot easily control both electrons.[122]: 15–6 It was expected for some time that liquid hydrogen would show metallic properties;[161] while this has been shown to not be the case, under extremely high pressures, such as those found at the cores of Jupiter and Saturn, hydrogen does become metallic and behaves like an alkali metal; in this phase, it is known as metallic hydrogen.[164] The electrical resistivity of liquid metallic hydrogen at 3000 K is approximately equal to that of liquid rubidium and caesium at 2000 K at the respective pressures when they undergo a nonmetal-to-metal transition.[165]
The 1s1 electron configuration of hydrogen, while analogous to that of the alkali metals (ns1), is unique because there is no 1p subshell. Hence it can lose an electron to form the hydron H+, or gain one to form the hydride ion H−.[10]: 43 In the former case it resembles superficially the alkali metals; in the latter case, the halogens, but the differences due to the lack of a 1p subshell are important enough that neither group fits the properties of hydrogen well.[10]: 43 Group 14 is also a good fit in terms of thermodynamic properties such as ionisation energy and electron affinity, but hydrogen cannot be tetravalent. Thus none of the three placements are entirely satisfactory, although group 1 is the most common placement (if one is chosen) because of the electron configuration and the fact that the hydron is by far the most important of all monatomic hydrogen species, being the foundation of acid-base chemistry.[161] As an example of hydrogen's unorthodox properties stemming from its unusual electron configuration and small size, the hydrogen ion is very small (radius around 150 fm compared to the 50–220 pm size of most other atoms and ions) and so is nonexistent in condensed systems other than in association with other atoms or molecules. Indeed, transferring of protons between chemicals is the basis of acid-base chemistry.[10]: 43 Also unique is hydrogen's ability to form hydrogen bonds, which are an effect of charge-transfer, electrostatic, and electron correlative contributing phenomena.[161] While analogous lithium bonds are also known, they are mostly electrostatic.[161] Nevertheless, hydrogen can take on the same structural role as the alkali metals in some molecular crystals, and has a close relationship with the lightest alkali metals (especially lithium).[166]

The ammonium ion (NH+4) has very similar properties to the heavier alkali metals, acting as an alkali metal intermediate between potassium and rubidium,[156][167][168] and is often considered a close relative.[169][170][171] For example, most alkali metal salts are soluble in water, a property which ammonium salts share.[172] Ammonium is expected to behave stably as a metal (NH+4 ions in a sea of delocalised electrons) at very high pressures (though less than the typical pressure where transitions from insulating to metallic behaviour occur around, 100 GPa), and could possibly occur inside the ice giants Uranus and Neptune, which may have significant impacts on their interior magnetic fields.[170][171] It has been estimated that the transition from a mixture of ammonia and dihydrogen molecules to metallic ammonium may occur at pressures just below 25 GPa.[170] Under standard conditions, ammonium can form a metallic amalgam with mercury.[173]
Other "pseudo-alkali metals" include the alkylammonium cations, in which some of the hydrogen atoms in the ammonium cation are replaced by alkyl or aryl groups. In particular, the quaternary ammonium cations (NR+4) are very useful since they are permanently charged, and they are often used as an alternative to the expensive Cs+ to stabilise very large and very easily polarisable anions such as HI−2.[10]: 812–9 Tetraalkylammonium hydroxides, like alkali metal hydroxides, are very strong bases that react with atmospheric carbon dioxide to form carbonates.[122]: 256 Furthermore, the nitrogen atom may be replaced by a phosphorus, arsenic, or antimony atom (the heavier nonmetallic pnictogens), creating a phosphonium (PH+4) or arsonium (AsH+4) cation that can itself be substituted similarly; while stibonium (SbH+4) itself is not known, some of its organic derivatives are characterised.[156]
Cobaltocene, Co(C5H5)2, is a metallocene, the cobalt analogue of ferrocene. It is a dark purple solid. Cobaltocene has 19 valence electrons, one more than usually found in organotransition metal complexes, such as its very stable relative, ferrocene, in accordance with the 18-electron rule. This additional electron occupies an orbital that is antibonding with respect to the Co–C bonds. Consequently, many chemical reactions of Co(C5H5)2 are characterized by its tendency to lose this "extra" electron, yielding a very stable 18-electron cation known as cobaltocenium. Many cobaltocenium salts coprecipitate with caesium salts, and cobaltocenium hydroxide is a strong base that absorbs atmospheric carbon dioxide to form cobaltocenium carbonate.[122]: 256 Like the alkali metals, cobaltocene is a strong reducing agent, and decamethylcobaltocene is stronger still due to the combined inductive effect of the ten methyl groups.[174] Cobalt may be substituted by its heavier congener rhodium to give rhodocene, an even stronger reducing agent.[175] Iridocene (involving iridium) would presumably be still more potent, but is not very well-studied due to its instability.[176]

Thallium is the heaviest stable element in group 13 of the periodic table. At the bottom of the periodic table, the inert-pair effect is quite strong, because of the relativistic stabilisation of the 6s orbital and the decreasing bond energy as the atoms increase in size so that the amount of energy released in forming two more bonds is not worth the high ionisation energies of the 6s electrons.[10]: 226–7 It displays the +1 oxidation state[10]: 28 that all the known alkali metals display,[10]: 28 and thallium compounds with thallium in its +1 oxidation state closely resemble the corresponding potassium or silver compounds stoichiometrically due to the similar ionic radii of the Tl+ (164 pm), K+ (152 pm) and Ag+ (129 pm) ions.[177][178] It was sometimes considered an alkali metal in continental Europe (but not in England) in the years immediately following its discovery,[178]: 126 and was placed just after caesium as the sixth alkali metal in Dmitri Mendeleev's 1869 periodic table and Julius Lothar Meyer's 1868 periodic table.[21] Mendeleev's 1871 periodic table and Meyer's 1870 periodic table put thallium in its current position in the boron group and left the space below caesium blank.[21] However, thallium also displays the oxidation state +3,[10]: 28 which no known alkali metal displays[10]: 28 (although ununennium, the undiscovered seventh alkali metal, is predicted to possibly display the +3 oxidation state).[36]: 1729–1730 The sixth alkali metal is now considered to be francium.[179] While Tl+ is stabilised by the inert-pair effect, this inert pair of 6s electrons is still able to participate chemically, so that these electrons are stereochemically active in aqueous solution. Additionally, the thallium halides (except TlF) are quite insoluble in water, and TlI has an unusual structure because of the presence of the stereochemically active inert pair in thallium.[180]
The group 11 metals (or coinage metals), copper, silver, and gold, are typically categorised as transition metals given they can form ions with incomplete d-shells. Physically, they have the relatively low melting points and high electronegativity values associated with post-transition metals. "The filled d subshell and free s electron of Cu, Ag, and Au contribute to their high electrical and thermal conductivity. Transition metals to the left of group 11 experience interactions between s electrons and the partially filled d subshell that lower electron mobility."[181] Chemically, the group 11 metals behave like main-group metals in their +1 valence states, and are hence somewhat related to the alkali metals: this is one reason for their previously being labelled as "group IB", paralleling the alkali metals' "group IA". They are occasionally classified as post-transition metals.[182] Their spectra are analogous to those of the alkali metals.[29] Their monopositive ions are paramagnetic and contribute no colour to their salts, like those of the alkali metals.[183]
In Mendeleev's 1871 periodic table, copper, silver, and gold are listed twice, once under group VIII (with the iron triad and platinum group metals), and once under group IB. Group IB was nonetheless parenthesised to note that it was tentative. Mendeleev's main criterion for group assignment was the maximum oxidation state of an element: on that basis, the group 11 elements could not be classified in group IB, due to the existence of copper(II) and gold(III) compounds being known at that time.[29] However, eliminating group IB would make group I the only main group (group VIII was labelled a transition group) to lack an A–B bifurcation.[29] Soon afterward, a majority of chemists chose to classify these elements in group IB and remove them from group VIII for the resulting symmetry: this was the predominant classification until the rise of the modern medium-long 18-column periodic table, which separated the alkali metals and group 11 metals.[29]
The coinage metals were traditionally regarded as a subdivision of the alkali metal group, due to them sharing the characteristic s1 electron configuration of the alkali metals (group 1: p6s1; group 11: d10s1). However, the similarities are largely confined to the stoichiometries of the +1 compounds of both groups, and not their chemical properties.[10]: 1177 This stems from the filled d subshell providing a much weaker shielding effect on the outermost s electron than the filled p subshell, so that the coinage metals have much higher first ionisation energies and smaller ionic radii than do the corresponding alkali metals.[10]: 1177 Furthermore, they have higher melting points, hardnesses, and densities, and lower reactivities and solubilities in liquid ammonia, as well as having more covalent character in their compounds.[10]: 1177 Finally, the alkali metals are at the top of the electrochemical series, whereas the coinage metals are almost at the very bottom.[10]: 1177 The coinage metals' filled d shell is much more easily disrupted than the alkali metals' filled p shell, so that the second and third ionisation energies are lower, enabling higher oxidation states than +1 and a richer coordination chemistry, thus giving the group 11 metals clear transition metal character.[10]: 1177 Particularly noteworthy is gold forming ionic compounds with rubidium and caesium, in which it forms the auride ion (Au−) which also occurs in solvated form in liquid ammonia solution: here gold behaves as a pseudohalogen because its 5d106s1 configuration has one electron less than the quasi-closed shell 5d106s2 configuration of mercury.[10]: 1177
The production of pure alkali metals is somewhat complicated due to their extreme reactivity with commonly used substances, such as water.[5][65] From their silicate ores, all the stable alkali metals may be obtained the same way: sulfuric acid is first used to dissolve the desired alkali metal ion and aluminium(III) ions from the ore (leaching), whereupon basic precipitation removes aluminium ions from the mixture by precipitating it as the hydroxide. The remaining insoluble alkali metal carbonate is then precipitated selectively; the salt is then dissolved in hydrochloric acid to produce the chloride. The result is then left to evaporate and the alkali metal can then be isolated.[65] Lithium and sodium are typically isolated through electrolysis from their liquid chlorides, with calcium chloride typically added to lower the melting point of the mixture. The heavier alkali metals, however, are more typically isolated in a different way, where a reducing agent (typically sodium for potassium and magnesium or calcium for the heaviest alkali metals) is used to reduce the alkali metal chloride. The liquid or gaseous product (the alkali metal) then undergoes fractional distillation for purification.[65] Most routes to the pure alkali metals require the use of electrolysis due to their high reactivity; one of the few which does not is the pyrolysis of the corresponding alkali metal azide, which yields the metal for sodium, potassium, rubidium, and caesium and the nitride for lithium.[122]: 77
Lithium salts have to be extracted from the water of mineral springs, brine pools, and brine deposits. The metal is produced electrolytically from a mixture of fused lithium chloride and potassium chloride.[184]
Sodium occurs mostly in seawater and dried seabed,[5] but is now produced through electrolysis of sodium chloride by lowering the melting point of the substance to below 700 °C through the use of a Downs cell.[185][186] Extremely pure sodium can be produced through the thermal decomposition of sodium azide.[187] Potassium occurs in many minerals, such as sylvite (potassium chloride).[5] Previously, potassium was generally made from the electrolysis of potassium chloride or potassium hydroxide,[188] found extensively in places such as Canada, Russia, Belarus, Germany, Israel, United States, and Jordan, in a method similar to how sodium was produced in the late 1800s and early 1900s.[189] It can also be produced from seawater.[5] However, these methods are problematic because the potassium metal tends to dissolve in its molten chloride and vaporises significantly at the operating temperatures, potentially forming the explosive superoxide. As a result, pure potassium metal is now produced by reducing molten potassium chloride with sodium metal at 850 °C.[10]: 74
Although sodium is less reactive than potassium, this process works because at such high temperatures potassium is more volatile than sodium and can easily be distilled off, so that the equilibrium shifts towards the right to produce more potassium gas and proceeds almost to completion.[10]: 74
Metals like sodium are obtained by electrolysis of molten salts. Rb & Cs obtained mainly as by products of Li processing. To make pure caesium, ores of caesium and rubidium are crushed and heated to 650 °C with sodium metal, generating an alloy that can then be separated via a fractional distillation technique. Because metallic caesium is too reactive to handle, it is normally offered as caesium azide (CsN3). Caesium hydroxide is formed when caesium interacts aggressively with water and ice (CsOH).[190]
Rubidium is the 16th most abundant element in the earth's crust; however, it is quite rare. Some minerals found in North America, South Africa, Russia, and Canada contain rubidium. Some potassium minerals (lepidolites, biotites, feldspar, carnallite) contain it, together with caesium. Pollucite, carnallite, leucite, and lepidolite are all minerals that contain rubidium. As a by-product of lithium extraction, it is commercially obtained from lepidolite. Rubidium is also found in potassium rocks and brines, which is a commercial supply. The majority of rubidium is now obtained as a byproduct of refining lithium. Rubidium is used in vacuum tubes as a getter, a material that combines with and removes trace gases from vacuum tubes.[191][192]

For several years in the 1950s and 1960s, a by-product of the potassium production called Alkarb was a main source for rubidium. Alkarb contained 21% rubidium while the rest was potassium and a small fraction of caesium.[193] Today the largest producers of caesium, for example the Tanco Mine in Manitoba, Canada, produce rubidium as by-product from pollucite.[194] Today, a common method for separating rubidium from potassium and caesium is the fractional crystallisation of a rubidium and caesium alum (Cs, Rb)Al(SO4)2·12H2O, which yields pure rubidium alum after approximately 30 recrystallisations.[194][195] The limited applications and the lack of a mineral rich in rubidium limit the production of rubidium compounds to 2 to 4 tonnes per year.[194] Caesium, however, is not produced from the above reaction. Instead, the mining of pollucite ore is the main method of obtaining pure caesium, extracted from the ore mainly by three methods: acid digestion, alkaline decomposition, and direct reduction.[194][196] Both metals are produced as by-products of lithium production: after 1958, when interest in lithium's thermonuclear properties increased sharply, the production of rubidium and caesium also increased correspondingly.[10]: 71 Pure rubidium and caesium metals are produced by reducing their chlorides with calcium metal at 750 °C and low pressure.[10]: 74
As a result of its extreme rarity in nature,[62] most francium is synthesised in the nuclear reaction 197Au + 18O → 210Fr + 5 n, yielding francium-209, francium-210, and francium-211.[197] The greatest quantity of francium ever assembled to date is about 300,000 neutral atoms,[198] which were synthesised using the nuclear reaction given above.[198] When the only natural isotope francium-223 is specifically required, it is produced as the alpha daughter of actinium-227, itself produced synthetically from the neutron irradiation of natural radium-226, one of the daughters of natural uranium-238.[199]
Lithium, sodium, and potassium have many useful applications, while rubidium and caesium are very notable in academic contexts but do not have many applications yet.[10]: 68 Lithium is the key ingredient for a range of lithium-based batteries, and lithium oxide can help process silica. Lithium stearate is a thickener and can be used to make lubricating greases; it is produced from lithium hydroxide, which is also used to absorb carbon dioxide in space capsules and submarines.[10]: 70 Lithium chloride is used as a brazing alloy for aluminium parts.[200] In medicine, some lithium salts are used as mood-stabilising pharmaceuticals. Metallic lithium is used in alloys with magnesium and aluminium to give very tough and light alloys.[10]: 70
Sodium compounds have many applications, the most well-known being sodium chloride as table salt. Sodium salts of fatty acids are used as soap.[201] Pure sodium metal also has many applications, including use in sodium-vapour lamps, which produce very efficient light compared to other types of lighting,[202][203] and can help smooth the surface of other metals.[204][205] Being a strong reducing agent, it is often used to reduce many other metals, such as titanium and zirconium, from their chlorides. Furthermore, it is very useful as a heat-exchange liquid in fast breeder nuclear reactors due to its low melting point, viscosity, and cross-section towards neutron absorption.[10]: 74 Sodium-ion batteries may provide cheaper alternatives to their equivalent lithium-based cells. Both sodium and potassium are commonly used as GRAS counterions to create more water-soluble and hence more bioavailable salt forms of acidic pharmaceuticals.[206]
Potassium compounds are often used as fertilisers[10]: 73 [207] as potassium is an important element for plant nutrition. Potassium hydroxide is a very strong base, and is used to control the pH of various substances.[208][209] Potassium nitrate and potassium permanganate are often used as powerful oxidising agents.[10]: 73 Potassium superoxide is used in breathing masks, as it reacts with carbon dioxide to give potassium carbonate and oxygen gas. Pure potassium metal is not often used, but its alloys with sodium may substitute for pure sodium in fast breeder nuclear reactors.[10]: 74
Rubidium and caesium are often used in atomic clocks.[210] Caesium atomic clocks are extraordinarily accurate; if a clock had been made at the time of the dinosaurs, it would be off by less than four seconds (after 80 million years).[56] For that reason, caesium atoms are used as the definition of the second.[211] Rubidium ions are often used in purple fireworks,[212] and caesium is often used in drilling fluids in the petroleum industry.[56][213]
Francium has no commercial applications,[60][61][214] but because of francium's relatively simple atomic structure, among other things, it has been used in spectroscopy experiments, leading to more information regarding energy levels and the coupling constants between subatomic particles.[215] Studies on the light emitted by laser-trapped francium-210 ions have provided accurate data on transitions between atomic energy levels, similar to those predicted by quantum theory.[216]
Pure alkali metals are dangerously reactive with air and water and must be kept away from heat, fire, oxidising agents, acids, most organic compounds, halocarbons, plastics, and moisture. They also react with carbon dioxide and carbon tetrachloride, so that normal fire extinguishers are counterproductive when used on alkali metal fires.[217] Some Class D dry powder extinguishers designed for metal fires are effective, depriving the fire of oxygen and cooling the alkali metal.[218]
Experiments are usually conducted using only small quantities of a few grams in a fume hood. Small quantities of lithium may be disposed of by reaction with cool water, but the heavier alkali metals should be dissolved in the less reactive isopropanol.[217][219] The alkali metals must be stored under mineral oil or an inert atmosphere. The inert atmosphere used may be argon or nitrogen gas, except for lithium, which reacts with nitrogen.[217] Rubidium and caesium must be kept away from air, even under oil, because even a small amount of air diffused into the oil may trigger formation of the dangerously explosive peroxide; for the same reason, potassium should not be stored under oil in an oxygen-containing atmosphere for longer than 6 months.[220][221]

The bioinorganic chemistry of the alkali metal ions has been extensively reviewed.[222]Solid state crystal structures have been determined for many complexes of alkali metal ions in small peptides, nucleic acid constituents, carbohydrates and ionophore complexes.[223]
Lithium naturally only occurs in traces in biological systems and has no known biological role, but does have effects on the body when ingested.[224] Lithium carbonate is used as a mood stabiliser in psychiatry to treat bipolar disorder (manic-depression) in daily doses of about 0.5 to 2 grams, although there are side-effects.[224] Excessive ingestion of lithium causes drowsiness, slurred speech and vomiting, among other symptoms,[224] and poisons the central nervous system,[224] which is dangerous as the required dosage of lithium to treat bipolar disorder is only slightly lower than the toxic dosage.[224][225] Its biochemistry, the way it is handled by the human body and studies using rats and goats suggest that it is an essential trace element, although the natural biological function of lithium in humans has yet to be identified.[226][227]
Sodium and potassium occur in all known biological systems, generally functioning as electrolytes inside and outside cells.[228][229] Sodium is an essential nutrient that regulates blood volume, blood pressure, osmotic equilibrium and pH; the minimum physiological requirement for sodium is 500 milligrams per day.[230] Sodium chloride (also known as common salt) is the principal source of sodium in the diet, and is used as seasoning and preservative, such as for pickling and jerky; most of it comes from processed foods.[231] The Dietary Reference Intake for sodium is 1.5 grams per day,[232] but most people in the United States consume more than 2.3 grams per day,[233] the minimum amount that promotes hypertension;[234] this in turn causes 7.6 million premature deaths worldwide.[235]
Potassium is the major cation (positive ion) inside animal cells,[228] while sodium is the major cation outside animal cells.[228][229] The concentration differences of these charged particles causes a difference in electric potential between the inside and outside of cells, known as the membrane potential. The balance between potassium and sodium is maintained by ion transporter proteins in the cell membrane.[236] The cell membrane potential created by potassium and sodium ions allows the cell to generate an action potential—a "spike" of electrical discharge. The ability of cells to produce electrical discharge is critical for body functions such as neurotransmission, muscle contraction, and heart function.[236] Disruption of this balance may thus be fatal: for example, ingestion of large amounts of potassium compounds can lead to hyperkalemia strongly influencing the cardiovascular system.[237][238] Potassium chloride is used in the United States for lethal injection executions.[237]

Due to their similar atomic radii, rubidium and caesium in the body mimic potassium and are taken up similarly. Rubidium has no known biological role, but may help stimulate metabolism,[239][240][241] and, similarly to caesium,[239][242] replace potassium in the body causing potassium deficiency.[239][241] Partial substitution is quite possible and rather non-toxic: a 70 kg person contains on average 0.36 g of rubidium, and an increase in this value by 50 to 100 times did not show negative effects in test persons.[243] Rats can survive up to 50% substitution of potassium by rubidium.[241][244] Rubidium (and to a much lesser extent caesium) can function as temporary cures for hypokalemia; while rubidium can adequately physiologically substitute potassium in some systems, caesium is never able to do so.[240] There is only very limited evidence in the form of deficiency symptoms for rubidium being possibly essential in goats; even if this is true, the trace amounts usually present in food are more than enough.[245][246]
Caesium compounds are rarely encountered by most people, but most caesium compounds are mildly toxic. Like rubidium, caesium tends to substitute potassium in the body, but is significantly larger and is therefore a poorer substitute.[242] Excess caesium can lead to hypokalemia, arrythmia, and acute cardiac arrest,[247] but such amounts would not ordinarily be encountered in natural sources.[248] As such, caesium is not a major chemical environmental pollutant.[248] The median lethal dose (LD50) value for caesium chloride in mice is 2.3 g per kilogram, which is comparable to the LD50 values of potassium chloride and sodium chloride.[249] Caesium chloride has been promoted as an alternative cancer therapy,[250] but has been linked to the deaths of over 50 patients, on whom it was used as part of a scientifically unvalidated cancer treatment.[251]
Radioisotopes of caesium require special precautions: the improper handling of caesium-137 gamma ray sources can lead to release of this radioisotope and radiation injuries. Perhaps the best-known case is the Goiânia accident of 1987, in which an improperly-disposed-of radiation therapy system from an abandoned clinic in the city of Goiânia, Brazil, was scavenged from a junkyard, and the glowing caesium salt sold to curious, uneducated buyers. This led to four deaths and serious injuries from radiation exposure. Together with caesium-134, iodine-131, and strontium-90, caesium-137 was among the isotopes distributed by the Chernobyl disaster which constitute the greatest risk to health.[97] Radioisotopes of francium would presumably be dangerous as well due to their high decay energy and short half-life, but none have been produced in large enough amounts to pose any serious risk.[199]
{{cite journal}}: CS1 maint: numeric names: authors list (link)