En la investigación de materiales y baterías eléctricas , las nanopartículas de óxido de cobalto generalmente se refieren a partículas de óxido de cobalto (II, III) Co
3Oh
4de tamaño nanométrico, con diversas formas y estructuras cristalinas.
Las nanopartículas de óxido de cobalto tienen aplicaciones potenciales en baterías de iones de litio [1] [2] y sensores electrónicos de gas . [3] [4]
Los cátodos de las baterías de iones de litio suelen estar hechos de óxidos litiados de cobalto , níquel o manganeso, que pueden incorporar iones de litio en su estructura molecular de forma fácil y reversible. Los nanomateriales de óxido de cobalto, como los nanotubos , [1] ofrecen una alta relación superficie-volumen y longitudes de recorrido cortas para el transporte de cationes de litio , lo que conduce a capacidades de carga rápida. Sin embargo, la capacidad, la eficiencia coulombiana y la vida útil pueden verse afectadas debido a la formación excesiva de SEI. Los nanocables pueden incorporar otras sustancias, por ejemplo, difenilalanina . [5]

Las partículas de óxido de cobalto se pueden anclar en sustratos como el grafeno para mejorar la estabilidad dimensional del ánodo y evitar la agregación de partículas durante los procesos de carga y descarga de litio. [2]
Se han investigado nanoesferas huecas de óxido de cobalto como materiales para electrodos de sensores de gas , para la detección de tolueno, acetona y otros vapores orgánicos. [3]
Se han investigado nanopartículas de óxido de cobalto ancladas en nanotubos de carbono de pared simple para detectar óxidos de nitrógeno NO
incógnitay el hidrógeno . Esta aplicación aprovecha la reactividad entre el gas y el óxido, así como la conexión eléctrica con el sustrato (ambos son semiconductores de tipo p ). Los óxidos de nitrógeno reaccionan con el óxido como aceptores de electrones , reduciendo la resistencia del electrodo; mientras que el hidrógeno actúa como donador de electrones , aumentando la resistencia. [4]
Se ha observado que las nanopartículas de óxido de cobalto entran fácilmente en las células , una propiedad que posiblemente podría dar lugar a aplicaciones en el tratamiento hipertérmico, la terapia génica y la administración de fármacos. Sin embargo, su toxicidad es un obstáculo que habría que superar. [6]
El óxido de cobalto se obtiene a menudo mediante síntesis hidrotermal en un autoclave. [7]
La síntesis hidrotermal en un solo recipiente de esferas huecas de óxido metálico comienza con carbohidratos y sales metálicas disueltas en agua a 100-200 °C. La reacción produce esferas de carbono, con iones metálicos integrados en la capa hidrófoba. Los núcleos de carbono se eliminan por calcinación , dejando esferas huecas de óxido metálico. El área de superficie y el espesor de la capa se pueden manipular variando la concentración de carbohidratos en sales metálicas, así como la temperatura, la presión y el pH del medio de reacción, y los cationes de las sales iniciales. [8] El tiempo de finalización del procedimiento varía de horas a días. [9]

Una desventaja de este enfoque es su menor rendimiento en comparación con otros métodos.
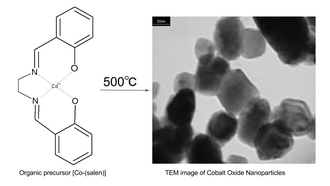
Otra vía para la síntesis de nanopartículas de óxido de cobalto es la descomposición térmica de compuestos organometálicos. Por ejemplo, calentando el complejo de salen metálico bis(salicilaldehído)etilendiiminacobalto(II) ("Co-salen") en aire a 500 °C. [10] [11] El precursor Co-salen se puede obtener haciendo reaccionar acetato de cobalto(II) tetrahidratado en propanol a 50 °C bajo atmósfera de nitrógeno con el ligando salen (bis(salicilaldehído)etilendiimina). [11]
Los compuestos de óxido de cobalto y grafeno se sintetizan formando primero hidróxido de cobalto (II) Co(OH)
2sobre la lámina de grafeno a partir de una sal de cobalto (II) e hidróxido de amonio NH
4OH , que luego se calienta a 450 °C durante dos horas para producir el óxido.
Como la mayoría de los compuestos de cobalto, las nanopartículas de óxido de cobalto son tóxicas para los humanos y también para la vida acuática. [12] [13]