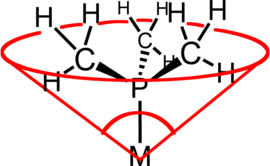
En química de coordinación , el ángulo del cono del ligando (θ) es una medida del volumen estérico de un ligando en un complejo de coordinación de metal de transición . Se define como el ángulo sólido formado con el metal en el vértice de un cono y el borde más externo de las esferas de van der Waals de los átomos del ligando en el perímetro de la base del cono. Los ligandos de fosfina terciaria se clasifican comúnmente utilizando este parámetro, pero el método se puede aplicar a cualquier ligando. El término ángulo del cono fue introducido por primera vez por Chadwick A. Tolman , un químico investigador de DuPont . Tolman desarrolló originalmente el método para ligandos de fosfina en complejos de níquel, determinándolos a partir de mediciones de modelos físicos precisos. [1] [2] [3]
El concepto de ángulo de cono se visualiza más fácilmente con ligandos simétricos, por ejemplo PR 3 . Pero el enfoque se ha perfeccionado para incluir ligandos menos simétricos del tipo PRR′R″ así como difosfinas. En tales casos asimétricos, los semiángulos de los ángulos sustituyentes,θ yo/2, se promedian y luego se duplican para encontrar el ángulo total del cono, θ . En el caso de las difosfinas, laθ yo/2del esqueleto se aproxima a la mitad del ángulo de mordida del quelato , suponiendo un ángulo de mordida de 74°, 85° y 90° para difosfinas con esqueletos de metileno, etileno y propileno, respectivamente. El ángulo del cono de Manz suele ser más fácil de calcular que el ángulo del cono de Tolman: [4] [ se necesita aclaración ]
El método del ángulo del cono de Tolman asume datos de enlace empíricos y define el perímetro como la máxima circunscripción posible de un sustituyente idealizado de giro libre. La longitud del enlace metal-ligando en el modelo de Tolman se determinó empíricamente a partir de estructuras cristalinas de complejos tetraédricos de níquel. Por el contrario, el concepto de ángulo sólido deriva tanto la longitud del enlace como el perímetro de estructuras cristalinas empíricas en estado sólido. [5] [6] Hay ventajas para cada sistema.
Si se conoce la geometría de un ligando, ya sea mediante cristalografía o cálculos, se puede calcular un ángulo de cono exacto ( θ ). [7] [8] [9] No se hacen suposiciones sobre la geometría, a diferencia del método Tolman.
El concepto de ángulo del cono es de importancia práctica en catálisis homogénea porque el tamaño del ligando afecta la reactividad del centro metálico adjunto. Por ejemplo, [10] la selectividad de los catalizadores de hidroformilación está fuertemente influenciada por el tamaño de los coligandos. A pesar de ser monovalentes , algunas fosfinas son lo suficientemente grandes como para ocupar más de la mitad de la esfera de coordinación de un centro metálico. Investigaciones recientes han encontrado que otros descriptores, como el porcentaje de volumen enterrado, son más precisos que el ángulo del cono para capturar los efectos estéricos relevantes del ligando de fosfina cuando se une al centro metálico. [11]