El ácido acetoacético ( nombre IUPAC : ácido 3-oxobutanoico , también conocido como ácido acetonacarboxílico o ácido diacético ) es el compuesto orgánico con la fórmula CH3COCH2COOH . Es el beta -cetoácido más simple y, como otros miembros de esta clase, es inestable. Los ésteres metílicos y etílicos , que son bastante estables, se producen a gran escala industrialmente como precursores de tintes. El ácido acetoacético es un ácido débil . [3]
En condiciones fisiológicas típicas, el ácido acetoacético existe como su base conjugada , acetoacetato :
El acetoacetato no unido se produce principalmente en las mitocondrias del hígado a partir de su tioéster con coenzima A (CoA):
El propio acetoacetato-CoA se forma por tres vías:
En los mamíferos, el acetoacetato producido en el hígado (junto con los otros dos " cuerpos cetónicos ") se libera al torrente sanguíneo como fuente de energía durante los períodos de ayuno , ejercicio o como resultado de la diabetes mellitus tipo 1. [ 5] Primero, se le transfiere enzimáticamente un grupo CoA desde el succinil CoA , convirtiéndolo nuevamente en acetoacetil CoA; este luego se descompone en dos moléculas de acetil CoA por acción de la tiolasa, y estas luego ingresan al ciclo del ácido cítrico . El músculo cardíaco y la corteza renal prefieren el acetoacetato a la glucosa. El cerebro usa acetoacetato cuando los niveles de glucosa son bajos debido al ayuno o la diabetes. [4] : 394
El ácido acetoacético se puede preparar por hidrólisis de dicetena . Sus ésteres se producen de manera análoga a través de reacciones entre dicetena y alcoholes, [3] y el ácido acetoacético se puede preparar por hidrólisis de estas especies. [6] En general, el ácido acetoacético se genera a 0 °C y se utiliza in situ inmediatamente. [7]
Se descompone a una velocidad de reacción moderada en acetona y dióxido de carbono :
La forma ácida tiene una vida media de 140 minutos a 37 °C en agua, mientras que la forma básica (el anión) tiene una vida media de 130 horas. Es decir, reacciona aproximadamente 55 veces más lentamente. [8] La descarboxilación correspondiente del trifluoroacetoacetato se utiliza para preparar trifluoroacetona :
Es un ácido débil (como la mayoría de los ácidos alquilcarboxílicos), con un p K a de 3,58.
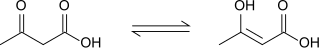
El ácido acetoacético muestra tautomerización ceto-enólica , con la forma enólica parcialmente estabilizada por conjugación extendida y enlace de hidrógeno intramolecular . El equilibrio depende en gran medida del solvente; la forma ceto predomina en solventes polares (98% en agua) y la forma enólica representa el 25-49% del material en solventes no polares. [9]

Los ésteres acetoacéticos se utilizan para la reacción de acetoacetilación , que se utiliza ampliamente en la producción de amarillos de arilida y tintes de diarilida . [3] Aunque los ésteres se pueden utilizar en esta reacción, la dicetena también reacciona con alcoholes y aminas para formar los correspondientes derivados del ácido acetoacético en un proceso llamado acetoacetilación . Un ejemplo es la reacción con 4-amino indano : [10]
El ácido acetoacético se mide en la orina de personas con diabetes para detectar cetoacidosis [11] y para controlar a las personas que siguen una dieta cetogénica o baja en carbohidratos [12] [13] Esto se hace utilizando tiras reactivas recubiertas de nitroprusiato o reactivos similares. El nitroprusiato cambia de color de rosa a violeta en presencia de acetoacetato, la base conjugada del ácido acetoacético, y el cambio de color se clasifica a simple vista. La prueba no mide el β-hidroxibutirato, la cetona más abundante en el cuerpo; durante el tratamiento de la cetoacidosis, el β-hidroxibutirato se convierte en acetoacetato, por lo que la prueba no es útil después de que comienza el tratamiento [11] y puede ser falsamente baja en el momento del diagnóstico [14] .
Se utilizan pruebas similares en vacas lecheras para comprobar la cetosis . [15]