En el sistema nervioso , una sinapsis [1] es una estructura que permite que una neurona (o célula nerviosa) transmita una señal eléctrica o química a otra neurona o a la célula efectora diana. Las sinapsis pueden ser químicas o eléctricas. En el caso de las sinapsis eléctricas , las neuronas están acopladas bidireccionalmente en tiempo continuo entre sí [2] [3] [4] y se sabe que producen actividad de red sincrónica en el cerebro [5] pero pueden dar lugar a dinámicas a nivel de red mucho más complicadas, como el caos. [6] [7] Como tal, la direccionalidad de la señal no siempre se puede definir a través de sinapsis eléctricas. [8]
Las sinapsis son esenciales para la transmisión de impulsos nerviosos de una neurona a otra [9] y desempeñan un papel fundamental al permitir una comunicación rápida y directa mediante la creación de circuitos. Además, una sinapsis sirve como punto de unión donde se produce tanto la transmisión como el procesamiento de la información, lo que la convierte en un medio vital de comunicación entre neuronas [10] . Las neuronas están especializadas para transmitir señales a células diana individuales y las sinapsis son el medio por el cual lo hacen.
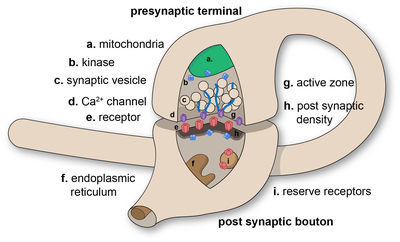
En una sinapsis, la membrana plasmática de la neurona que pasa la señal (la neurona presináptica ) entra en estrecha aposición con la membrana de la célula objetivo ( postsináptica ). Tanto los sitios presinápticos como los postsinápticos contienen amplias matrices de maquinaria molecular que unen las dos membranas y llevan a cabo el proceso de señalización. En muchas sinapsis, la parte presináptica se encuentra en un axón y la parte postsináptica se encuentra en una dendrita o soma . Los astrocitos también intercambian información con las neuronas sinápticas, respondiendo a la actividad sináptica y, a su vez, regulando la neurotransmisión . [9] Las sinapsis (al menos las sinapsis químicas) se estabilizan en su posición mediante moléculas de adhesión sináptica (SAM) que se proyectan desde la neurona presináptica y postsináptica y se adhieren entre sí donde se superponen; las SAM también pueden ayudar en la generación y el funcionamiento de las sinapsis. [11] Además, los SAM coordinan la formación de sinapsis, y varios tipos trabajan juntos para lograr la notable especificidad de las sinapsis. [10] [12] En esencia, los SAM funcionan tanto en sinapsis excitatorias como inhibidoras, y probablemente sirven como dispositivos para la transmisión de señales. [10]
Santiago Ramón y Cajal propuso que las neuronas no son continuas a lo largo del cuerpo, pero aún así se comunican entre sí, una idea conocida como la doctrina de la neurona . [13] La palabra "sinapsis" fue introducida en 1897 por el neurofisiólogo inglés Charles Sherrington en el Textbook of Physiology de Michael Foster . [1] Sherrington luchó por encontrar un buen término que enfatizara la unión entre dos elementos separados , y el término real "sinapsis" fue sugerido por el erudito clásico inglés Arthur Woollgar Verrall , un amigo de Foster. [14] [15] La palabra se deriva del griego synapsis ( σύναψις ), que significa "conjunción", que a su vez deriva de synaptein ( συνάπτειν ), de syn ( σύν ) "juntos" y haptein ( ἅπτειν ) "sujetar". [14] [16]
Sin embargo, mientras que la brecha sináptica siguió siendo una construcción teórica, y a veces se informó como una discontinuidad entre terminaciones axónicas contiguas y dendritas o cuerpos celulares, los métodos histológicos que utilizaban los mejores microscopios ópticos de la época no podían resolver visualmente su separación, que ahora se sabe que es de unos 20 nm. Se necesitó el microscopio electrónico en la década de 1950 para mostrar la estructura más fina de la sinapsis con sus membranas y procesos pre y postsinápticos separados y paralelos, y la hendidura entre los dos. [17] [18] [19]

Las sinapsis químicas y eléctricas son dos formas de transmisión sináptica.
La formación de circuitos neuronales en los sistemas nerviosos parece depender en gran medida de las interacciones cruciales entre las sinapsis químicas y eléctricas. Por lo tanto, estas interacciones rigen la generación de la transmisión sináptica. [21] La comunicación sináptica es distinta de un acoplamiento efáptico , en el que la comunicación entre neuronas se produce a través de campos eléctricos indirectos. Una autapsis es una sinapsis química o eléctrica que se forma cuando el axón de una neurona hace sinapsis con las dendritas de la misma neurona.
Un influjo de Na+ impulsado por neurotransmisores excitadores abre canales de cationes, despolarizando la membrana postsináptica hacia el umbral del potencial de acción. Por el contrario, los neurotransmisores inhibidores hacen que la membrana postsináptica se despolarice menos abriendo canales de Cl- o K+, lo que reduce la activación. Dependiendo de su lugar de liberación, los receptores a los que se unen y las circunstancias iónicas que encuentran, varios transmisores pueden ser excitadores o inhibidores. Por ejemplo, la acetilcolina puede excitar o inhibir dependiendo del tipo de receptores a los que se une. [25] Por ejemplo, el glutamato actúa como un neurotransmisor excitador, en contraste con el GABA, que actúa como un neurotransmisor inhibidor. Además, la dopamina es un neurotransmisor que ejerce efectos duales, mostrando impactos tanto excitadores como inhibidores a través de la unión a receptores distintos. [26]
El potencial de membrana impide que el Cl- entre en la célula, incluso cuando su concentración es mucho mayor en el exterior que en el interior. El potencial de inversión del Cl- en muchas neuronas es bastante negativo, casi igual al potencial de reposo . La apertura de los canales de Cl- tiende a amortiguar el potencial de membrana, pero este efecto se contrarresta cuando la membrana empieza a despolarizarse, lo que permite que entren en la célula más iones Cl- con carga negativa. En consecuencia, resulta más difícil despolarizar la membrana y excitar la célula cuando los canales de Cl- están abiertos. La apertura de los canales de K+ produce efectos similares. La importancia de los neurotransmisores inhibidores es evidente a partir de los efectos de las toxinas que impiden su actividad. Por ejemplo, la estricnina se une a los receptores de glicina, bloqueando la acción de la glicina y provocando espasmos musculares, convulsiones y muerte. [25]
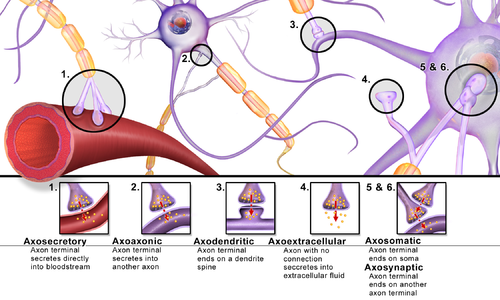
Las sinapsis se pueden clasificar según el tipo de estructuras celulares que actúan como componentes pre y postsinápticos. La gran mayoría de las sinapsis en el sistema nervioso de los mamíferos son sinapsis axodendríticas clásicas (axones que hacen sinapsis sobre una dendrita); sin embargo, existen otras configuraciones, entre las que se incluyen, entre otras, [ aclaración necesaria ] las sinapsis axoaxónicas , dendrodendríticas , axosecretoras, axociliares, [27] somatodendríticas, dendrosomáticas y somatosomáticas. [ cita requerida ]
De hecho, el axón puede hacer sinapsis con una dendrita, con un cuerpo celular, con otro axón o terminal axónico, así como con el torrente sanguíneo o de forma difusa con el tejido nervioso adyacente.
Los neurotransmisores son pequeñas moléculas señalizadoras que se almacenan en vesículas sinápticas rodeadas de membranas y se liberan por exocitosis. De hecho, un cambio en el potencial eléctrico de la célula presináptica desencadena la liberación de estas moléculas. Al unirse a los canales iónicos controlados por transmisores, el neurotransmisor provoca una alteración eléctrica en la célula postsináptica y se difunde rápidamente a través de la hendidura sináptica. Una vez liberado, el neurotransmisor se elimina rápidamente, ya sea al ser absorbido por la terminal nerviosa que lo produjo, captado por las células gliales cercanas o degradado por enzimas específicas en la hendidura sináptica. Numerosas proteínas transportadoras de neurotransmisores dependientes de Na+ reciclan los neurotransmisores y permiten que las células mantengan tasas rápidas de liberación.
En las sinapsis químicas, los canales iónicos activados por transmisores desempeñan un papel vital en la conversión rápida de impulsos químicos extracelulares en señales eléctricas. Estos canales están ubicados en la membrana plasmática de la célula postsináptica en la región de la sinapsis y se abren temporalmente en respuesta a la unión de moléculas de neurotransmisores, lo que provoca una alteración momentánea en la permeabilidad de la membrana. Además, los canales activados por transmisores son comparativamente menos sensibles al potencial de membrana que los canales activados por voltaje, por lo que no pueden generar excitación autoamplificada por sí mismos. Sin embargo, dan lugar a variaciones graduales en el potencial de membrana debido a la permeabilidad local, influenciada por la cantidad y la duración del neurotransmisor liberado en la sinapsis. [25]
Recientemente, se ha descubierto que la tensión mecánica, un fenómeno que nunca se consideró relevante para la función sináptica, es necesaria para que las neuronas del hipocampo se activen. [28]
Los neurotransmisores se unen a los receptores ionotrópicos de las neuronas postsinápticas, lo que provoca su apertura o cierre. [26] Las variaciones en las cantidades de neurotransmisores liberados por la neurona presináptica pueden desempeñar un papel en la regulación de la eficacia de la transmisión sináptica. De hecho, la concentración de calcio citoplasmático interviene en la regulación de la liberación de neurotransmisores de las neuronas presinápticas. [29]
La transmisión química implica varios procesos secuenciales:
La función de las neuronas depende de la polaridad celular . La estructura distintiva de las células nerviosas permite que los potenciales de acción viajen direccionalmente (desde las dendritas hasta el cuerpo celular a través del axón) y que estas señales sean recibidas y transportadas por neuronas postsinápticas o recibidas por células efectoras. Las células nerviosas se han utilizado durante mucho tiempo como modelos para la polarización celular y son de particular interés los mecanismos subyacentes a la localización polarizada de las moléculas sinápticas. La señalización PIP2 regulada por la IMPasa desempeña un papel integral en la polaridad sináptica.
Los fosfoinosítidos ( PIP , PIP2 y PIP3 ) son moléculas que han demostrado afectar la polaridad neuronal. [31] Se identificó un gen ( ttx-7 ) en Caenorhabditis elegans que codifica la mioinositol monofosfatasa (IMPasa), una enzima que produce inositol desfosforilando el fosfato de inositol . Los organismos con genes ttx-7 mutantes demostraron defectos de comportamiento y localización, que fueron rescatados por la expresión de IMPasa. Esto llevó a la conclusión de que la IMPasa es necesaria para la localización correcta de los componentes de la proteína sináptica. [32] [33] El gen egl-8 codifica un homólogo de la fosfolipasa C β (PLCβ), una enzima que escinde PIP2. Cuando los mutantes ttx-7 también tenían un gen egl-8 mutante, los defectos causados por el gen ttx-7 defectuoso se revirtieron en gran medida. Estos resultados sugieren que la señalización PIP2 establece una localización polarizada de los componentes sinápticos en neuronas vivas. [32]
La modulación de la liberación de neurotransmisores por los receptores acoplados a proteína G (GPCR) es un mecanismo presináptico importante para la regulación de la transmisión sináptica . La activación de los GPCR ubicados en la terminal presináptica puede disminuir la probabilidad de liberación de neurotransmisores. Esta depresión presináptica implica la activación de proteínas G de tipo Gi/o que median diferentes mecanismos inhibidores, incluida la inhibición de los canales de calcio dependientes de voltaje , la activación de los canales de potasio y la inhibición directa del proceso de fusión de vesículas .
Los endocannabinoides , sintetizados y liberados desde los elementos neuronales postsinápticos y sus receptores cognados , incluido el receptor (GPCR) CB1 ubicado en la terminal presináptica, están involucrados en esta modulación mediante un proceso de señalización retrógrada , en el que estos compuestos se sintetizan y liberan desde los elementos neuronales postsinápticos y viajan de regreso a la terminal presináptica para actuar sobre el receptor CB1 para una depresión sináptica a corto o largo plazo, que causa una disminución a corto o largo plazo en la liberación de neurotransmisores. [34]
Desde hace mucho tiempo se ha considerado que los fármacos son objetivos cruciales para los canales iónicos activados por transmisores. La mayoría de los medicamentos utilizados para tratar la esquizofrenia, la ansiedad, la depresión y el insomnio actúan en las sinapsis químicas, y muchos de estos fármacos funcionan uniéndose a los canales activados por transmisores. Por ejemplo, algunos fármacos como los barbitúricos y los tranquilizantes se unen a los receptores GABA y potencian el efecto inhibidor del neurotransmisor GABA. Por tanto, la concentración reducida de GABA permite la apertura de los canales de Cl-.
Además, los fármacos psicoactivos podrían tener como blanco a muchos otros componentes de la maquinaria de señalización sináptica. De hecho, numerosos neurotransmisores son liberados por transportadores impulsados por Na+ y posteriormente son eliminados de la hendidura sináptica. Al inhibir a dichos transportadores, la transmisión sináptica se fortalece ya que la acción del transmisor se prolonga. Por ejemplo, Prozac es un medicamento antidepresivo que actúa impidiendo la absorción del neurotransmisor serotonina. Además, otros antidepresivos actúan inhibiendo la reabsorción tanto de serotonina como de noradrenalina. [25]
En las terminales nerviosas, las vesículas sinápticas se producen rápidamente para compensar su rápido agotamiento durante la liberación de neurotransmisores. Su biogénesis implica la segregación de las proteínas de membrana de las vesículas sinápticas de otras proteínas celulares y el empaquetamiento de esas proteínas distintas en vesículas del tamaño adecuado. Además, implica la endocitosis de las proteínas de membrana de las vesículas sinápticas desde la membrana plasmática. [35]
Los términos sinaptoblástico y sinaptoclástico se refieren a las actividades de producción y eliminación de sinapsis dentro de la cadena de señalización bioquímica. Esta terminología está asociada con el Protocolo de Bredesen para el tratamiento de la enfermedad de Alzheimer , que conceptualiza la enfermedad de Alzheimer como un desequilibrio entre estos procesos. A fecha de octubre de 2023, los estudios relacionados con este protocolo siguen siendo escasos y se han obtenido pocos resultados dentro de un marco de control estandarizado.
Se acepta ampliamente que la sinapsis desempeña un papel clave en la formación de la memoria . [36] La estabilidad de la memoria a largo plazo puede persistir durante muchos años; sin embargo, las sinapsis, la base neurológica de la memoria, son muy dinámicas. [37] La formación de conexiones sinápticas depende significativamente de la plasticidad sináptica dependiente de la actividad observada en varias vías sinápticas. De hecho, la conexión entre la formación de la memoria y las alteraciones en la eficacia sináptica permite el refuerzo de las interacciones neuronales entre neuronas. A medida que los neurotransmisores activan receptores a través de la hendidura sináptica, la conexión entre las dos neuronas se fortalece cuando ambas neuronas están activas al mismo tiempo, como resultado de los mecanismos de señalización del receptor. Se cree que la fuerza de dos vías neuronales conectadas da como resultado el almacenamiento de información, lo que resulta en la memoria. Este proceso de fortalecimiento sináptico se conoce como potenciación a largo plazo (LTP) . [36]
Al alterar la liberación de neurotransmisores, se puede controlar la plasticidad de las sinapsis en la célula presináptica. La célula postsináptica se puede regular alterando la función y el número de sus receptores. Los cambios en la señalización postsináptica se asocian más comúnmente con una LTP dependiente del receptor de ácido N-metil-D-aspártico (NMDAR) y una depresión a largo plazo (LTD) debido al influjo de calcio en la célula postsináptica, que son las formas más analizadas de plasticidad en las sinapsis excitatorias. [38]
Además, la proteína quinasa II dependiente de Ca2+/calmodulina (CaM) (CaMKII) es mejor reconocida por sus funciones en el cerebro, particularmente en las regiones del neocórtex y el hipocampo, porque actúa como un mediador ubicuo de las señales celulares de Ca2+. La CaMKII es abundante en el sistema nervioso, y se concentra principalmente en las sinapsis de las células nerviosas. De hecho, la CaMKII ha sido identificada definitivamente como un regulador clave de los procesos cognitivos, como el aprendizaje y la plasticidad neuronal. La primera evidencia experimental concreta de la función asumida durante mucho tiempo de la CaMKII en el almacenamiento de la memoria se demostró
Aunque la unión de Ca2+/CaM estimula la actividad de CaMKII, la actividad autónoma de CaMKII independiente de Ca2+ también puede producirse por varios otros procesos. La CaMKII se activa al autofosforilarse tras la unión de Ca2+/calmodulina. La CaMKII sigue activa y se fosforila a sí misma incluso después de que se escinda el Ca2+; como resultado, el cerebro almacena recuerdos a largo plazo utilizando este mecanismo. Sin embargo, cuando la enzima CaMKII es desfosforilada por una enzima fosfatasa, se vuelve inactiva y se pierden los recuerdos. Por lo tanto, la CaMKII desempeña un papel vital tanto en la inducción como en el mantenimiento de la LTP. [39]
Por razones técnicas, la estructura y función sináptica se han estudiado históricamente en sinapsis modelo inusualmente grandes , por ejemplo:
Las sinapsis funcionan como conjuntos dentro de redes cerebrales particulares para controlar la cantidad de actividad neuronal, que es esencial para la memoria, el aprendizaje y la conducta. En consecuencia, las interrupciones sinápticas pueden tener efectos negativos. De hecho, las alteraciones en los sistemas moleculares intrínsecos de las células o las modificaciones de los procesos bioquímicos ambientales pueden provocar una disfunción sináptica. La sinapsis es la unidad primaria de transferencia de información en el sistema nervioso, y la creación correcta de contactos sinápticos durante el desarrollo es esencial para el funcionamiento normal del cerebro. Además, varias mutaciones se han relacionado con trastornos del desarrollo neurológico, y esa función comprometida en diferentes ubicaciones de las sinapsis es un sello distintivo de las enfermedades neurodegenerativas.
Los defectos sinápticos se asocian causalmente con enfermedades neurológicas de aparición temprana, incluidos los trastornos del espectro autista (TEA), la esquizofrenia (SCZ) y el trastorno bipolar (BP). Por otro lado, en patologías degenerativas de aparición tardía, como las enfermedades de Alzheimer (EA), Parkinson (PD) y Huntington (HD), se cree que la sinaptopatía es el resultado final inevitable de una cascada fisiopatológica en curso. Estas enfermedades se identifican por una pérdida gradual de la función cognitiva y conductual y una pérdida constante de tejido cerebral. Además, estos deterioros se han relacionado principalmente con la acumulación gradual de agregados de proteínas en las neuronas, cuya composición puede variar según la patología; todos tienen los mismos efectos nocivos sobre la integridad neuronal. Además, el elevado número de mutaciones ligadas a la estructura y función sináptica, así como alteraciones de las espinas dendríticas en tejido post mortem, ha llevado a la asociación entre defectos sinápticos y trastornos del neurodesarrollo, como el TEA y la SCZ, caracterizados por fenotipos conductuales o cognitivos anormales.
Sin embargo, debido al acceso limitado al tejido humano en etapas tardías y a la falta de una evaluación exhaustiva de los componentes esenciales de las enfermedades humanas en los modelos animales experimentales disponibles, ha sido difícil comprender plenamente el origen y el papel de la disfunción sináptica en los trastornos neurológicos. [41]
La palabra sinapsis apareció por primera vez en 1897, en la séptima edición del
Textbook of Physiology
de Michael Foster .